男57岁,反复腹胀半年,水肿3个月
患者,男性,57岁,工人。
主诉:反复腹胀半年,水肿3个月。
现病史:患者半年前无明显诱因出现腹胀,食欲减退,恶心,无腹痛,无呕血、黑便。到当地医院就诊,查胃镜示浅表性胃炎伴糜烂,幽门螺杆菌+++。给予“兰索拉唑、阿莫西林、克拉霉素、多潘立酮片、磷酸铝凝胶”等治疗,效果不佳,患者腹胀症状未见减轻,且腹部逐渐胀大。3个月前开始出现下肢水肿,休息减轻,活动后加重,夜尿次数增多,3~4次/晚,小便有泡沫。到当地医院就诊,B 超提示肝脏增大,腹水(深度8.0cm),胆囊壁厚。收入消化科住院治疗。入院后查血常规:白细胞6.5×10 9/L,红细胞3.94 ×10 12/L,血红蛋白107g/L,血小板491×10 9/L。尿蛋白+++;24小时尿蛋白定量5.36g。生化系列:转氨酶及胆红素正常,尿素氮9.0mmol/L,肌酐162μmol/L,白蛋白21g/L,碱性磷酸酶370U/L,γ‐谷氨酰转移酶385U/L,胆固醇8.8mmol/L。肿瘤标志物:癌胚抗原86.69mI U/L(0~76.4mI U/L),CA125 176﹒84U/ml(0~30U/ml),CA19‐9 60﹒18U/ml(0~37U/ml)。乙肝五项均阴性,丙肝抗体、甲肝抗体、戊肝抗体均为阴性。抗核抗体及抗ENA 抗体系列(RNP、Sm、SSA、SSB、Jo‐1、Scl‐70)阴性;腹水检查符合漏出液。肾脏超声:双肾大小形态正常,实质回声稍强。上腹部增强CT:肝大(密度均匀),腹水,胆胰脾未见异常,腹膜后未见异常淋巴结。当地给予保肝、降脂、利尿等治疗措施,住院2周,腹胀、下肢水肿无明显缓解。为进一步明确诊治,以“肾病综合征”转入我院。
既往史:2年前有“心肌梗死”病史,长期口服阿司匹林治疗,平日无明显胸闷、胸痛。
体格检查:体温36.0℃,脉搏70次/分,呼吸18次/分,血压100/70mmHg。神志清,精神差,皮肤黏膜无黄染及出血点,浅表淋巴结未触及肿大,双肺呼吸音清,未闻及干湿性啰音,心率70次/分,律齐,各瓣膜听诊区未闻及病理性杂音。腹膨隆,肝脏肋下4 指可触及,质韧,有触痛,脾脏未触及,腹水征阳性,双肾区无叩击痛,双下肢水肿。
入院诊断:①肾病综合征;②慢性肾衰竭;③肝大原因待查。
病情分析
患者中老年男性,病史半年,临床特点表现为肝大、腹水、水肿、蛋白尿。入院前在当地医院已做了较详细的检查,24小时尿蛋白定量大于3.5g,低蛋白血症,高胆固醇血症,肾病综合征诊断明确。肾病综合征有原发、继发之分,中老年原发肾病综合征多见于膜性肾病,继发肾病综合征多见于糖尿病肾病、骨髓瘤肾病、肾淀粉样变性、淋巴瘤或实体肿瘤性肾病,此患者无糖尿病史不支持糖尿病肾病;患者体检没有发现无痛性淋巴结肿大,有关辅助检查也没发现体腔内异常肿大淋巴结,无发热等临床表现,不支持淋巴瘤;患者有贫血、肝大、肾功能损害,虽无骨痛等临床表现,不排除骨髓瘤,可完善血清蛋白电泳、骨髓象等检查进一步明确诊断;患者目前检查也未发现实体瘤的证据,但发现肿瘤标志物增高,仍需进一步检查,必要时可查PET‐CT 以排除肿瘤;是否原发膜性肾病、肾淀粉样变可行肾活检,肾脏病理进一步明确。
患者肾损伤的病史超过3个月,病程中没有明显的少尿,血肌酐轻度异常,诊断为慢性肾衰竭,经计算患者内生肌酐清除率处于失代偿期。
患者腹水的原因有肾病综合征导致的水肿,但此患者腹水量较大,肢体水肿相对轻,用肾病综合征水肿似乎不能全部解释腹水形成的原因。患者无腹痛,当地医院腹水检查为漏出液,不支持癌性腹水及感染性腹水。患者肝脏肿大,肝功能检查碱性磷酸酶及γ‐谷氨酰转移酶升高,考虑腹水与肝脏病变有一定关系。结合患者现有临床资料,大体可排除肝癌、病毒性肝炎、脂肪肝、乙醇性肝病、心衰等疾病所致肝淤血、药物型肝炎、血吸虫病等疾病。患者经腹部超声及上腹部CT 检查均未发现门静脉增宽、脾脏肿大,不支持各种病因导致的肝硬化失代偿引起腹水。目前肝脏病变性质不明,进一步明确诊断可考虑肝活检。
辅助检查:血常规:白细胞6﹒3 ×10 9/L,红细胞3﹒19 ×10 12/L,血红蛋白85g/L,血小板537 ×10 9/L,网织红细胞1﹒47%。尿检:蛋白质+++,尿本周蛋白阴性,24小时尿蛋白定量3﹒57g。生化系列:肌酐140﹒7μmol/L,尿酸457﹒8μmol/L,尿素氮9﹒23mmol/L,丙氨酸氨基转移酶30U/L,天冬氨酸氨基转移酶30U/L,总胆红素5﹒3μmol/L,白蛋白23﹒5g/L,球蛋白19﹒4g/L,碱性磷酸酶503U/L,γ谷氨酰转移酶360U/L,胆固醇7﹒8mmol/L,葡萄糖4﹒52mmol/L,血清铁3﹒9μmol/L,钙离子1﹒9mmol/L,磷1﹒43mmol/L,钾离子4﹒8mmol/L,钠离子140mmol/L,氯离子105mmol/L,二氧化碳结合力24mmol/L。免疫检查:免疫球蛋白G5﹒43(8﹒00~17﹒00)g/L,免疫球蛋白A2﹒31(0﹒72~4﹒29)g/L,免疫球蛋白M 2﹒21(0.29~3.44)g/L,免疫球蛋白轻链κ158(170~370)mg/dl,免疫球蛋白轻链λ96.7(90~210)mg/dl,补体C3 0﹒95(0.80~2.10)g/L,补体C4 0﹒38(0.17~0.48)g/L。血清蛋白电泳:白蛋白50(54~74)%,α1球蛋白4.1(0.5~5.0)%,α2球蛋白15.1(3.6~10.0)%,β球蛋白15.7(5.0~12.5)%,γ球蛋白15.1(10~24)%,白/球1.0(1.2~2.2),未发现M 蛋白成分。自身免疫性肝病谱检查(抗核抗体、抗平滑肌抗体、抗肝肾微粒体抗体、抗线粒体抗体、抗线粒体M2 型抗体)均为阴性。肿瘤标志物:癌胚抗原3.63(0~5.00)ng/ml,甲胎蛋白3.3(0~9.00)ng/ml,CA125:500(0~35)U/ml,CA19‐9:112(0~37)U/ml,CA50:41(0~20)U/ml,CA242:9(0~25)U/ml。骨髓象:结合临床符合肾性贫血,继发性血小板增多症,其中浆细胞比例1.5%。心电图:肢导联低电压,Ⅱ、Ⅲ、aVF 导联呈QS 型,V1~V4 导联T 波倒置。超声心动图:心脏各腔室内径正常,室间隔及左室后壁增厚,各瓣膜形态正常,左室射血分数80%,左室舒张功能减退。双肾静脉超声:未见明显异常。颅骨平片:未见骨质破坏。全身PET/CT:未见明显异常。
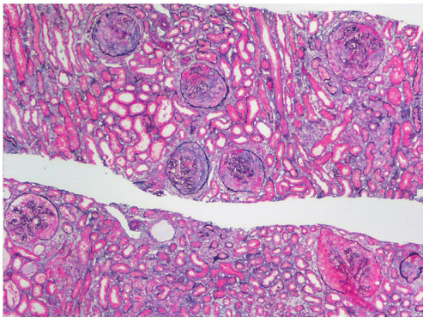
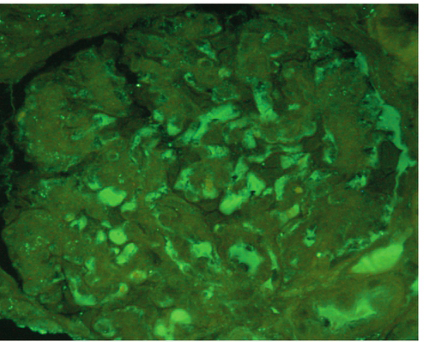
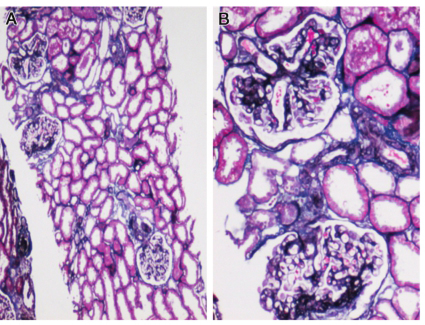
肾脏病理:光镜可见1条肾组织,全片共19个肾小球,3个球性硬化。肾小球细胞数不多,未见明显系膜细胞增生,系膜基质节段性增多,系膜区呈无细胞性增宽。部分毛细血管袢受压变窄。肾小球基底膜(GBM)节段性增厚。肾小球系膜区、GBM 内可见大量嗜伊红、厌银的无定性物质沉积。肾小管上皮细胞可见颗粒及脂肪变性。管腔内可见蛋白管型。可见数处小灶性的TBM增厚和肾小管萎缩。间质可见数处小灶性的纤维化,伴有较多单个核为主的炎症细胞浸润。间质内亦可见嗜伊红、厌银的无定形物质沉积。部分肾内小血管管壁增厚、管腔狭窄。刚果红染色可见砖红色物质在肾小球及间质内沉积,高锰酸钾预处理刚果红染色仍为阳性,偏振光下可见肾小球系膜区、GBM、肾小管基底膜(TBM)及间质内呈现绿色双折光现象(图9‐1,9‐2)。免疫荧光:肾小球数5个。IgM 弥漫团块状分布于系膜区,颗粒状分布于毛细血管袢,染色强度++~+++;C1q、Fi、λ‐chain 均为弥漫颗粒状分布于系膜区及毛细血管襻,染色强度+。IgG、IgA、C3、C4、κ‐chain 均为阴性。结论:肾脏淀粉样变性病。
图9‐1 光镜下肾脏病理改变HE×200
图9‐2 光镜下肾脏病理改变PASM ×200
诊断:原发性系统性淀粉样变。
治疗及转归
入院后给予静脉应用甲泼尼龙40mg/d,并给予抗凝、抗血小板,间断补充血浆并利尿等治疗措施,患者白蛋白维持于23~26g/L 左右,24小时尿蛋白维持于3g 左右。24小时尿量维持在1000ml 左右。患者治疗期间水肿、腹胀感觉有所加重。在肾脏病理明确诊断及经过PET/CT 检查排除肿瘤后,治疗选用地塞米松+沙利度胺(MD)的方案(地塞米松20mg/d,口服,第1~4日,每4周重复1次;沙利度胺100mg/d,每2周加量50mg/d,至400mg/d 维持)。患者获治疗方案后回原籍治疗,失访。
讨论
本病例主要表现为肝大、腹水、蛋白尿、肾功能受损,肝肾两脏器同时受累。肝脏病与肾脏病之间有着密切的相互关系,中医就有“肝肾同源”、“肝肾同病”的讲法。现代医学肝肾同病主要见于下面四种情况:①肝病继发肾损害,也是临床上常首先想到的,比如病毒肝炎相关肾损害,肝肾综合征等。②肾病继发肝损害,常由肾病综合征、肾衰竭引起。上述两种情况常需要鉴别,关键在于明确哪个为原发病,另外继发的肝肾损害具有一定的可逆性。③原发性肝病与原发性肾病同时并存,两者之间并无发病机制上的联系,但临床思维应坚持一元论,此种情况一般不被首先考虑。④同一病因同时引起肝病变和肾病变,如结缔组织病(系统性红斑狼疮、结节性多动脉炎等)、心力衰竭、败血症、休克及中毒(如四氯化碳、毒蕈等)、钩端螺旋体病、淀粉样变性等,除了肝肾受累之外,多同时合并多脏器损害。本病例肾组织刚果红染色阳性,高锰酸钾处理染色仍阳性,λ轻链阳性,无感染、系统性红斑狼疮、肿瘤等疾病,排除了多发性骨髓瘤,最终诊断为原发性系统性淀粉样变。
淀粉样变是一种不同病因所致的血浆中正常的可溶性蛋白以不可溶纤维形式在细胞外沉积的一组疾病。这种疾病可以影响多系统器官,可以是系统的也可以是局部的,可以是先天的也可以是后天获得。淀粉样物质各种不同且高度有序的构象决定了它相对的稳定性和抗蛋白水解作用,当淀粉样物质沉积在细胞外间隙,造成受累组织、器官的功能损伤和结构破坏。根据淀粉样物质的不同,临床可分为原发性淀粉样变(AL)、透析相关性淀粉样变、继发性淀粉样变(AA)、家族性淀粉样变[1]。
原发性系统性淀粉样变(PSA)为淀粉样蛋白轻链(AL)型,是单株浆细胞产生的单克隆免疫球蛋白轻链(κ或λ)或轻链片段以淀粉样纤维素的形式沉积在组织所形成的疾病[2],病因不明,发病率低,发病年龄多在40岁以上,男性较女性多见。主要累及心、肝、肾、脾、胃肠及肌肉等组织器官。其中以心脏、肝脏、肾脏受累最为常见,其临床表现复杂多样[3]。
肾脏为PSA 最常见受累器官。其临床进程为:①临床前期:无症状,仅在病理检查时发现;②单纯蛋白尿期;③肾病综合征期;④肾衰竭期。肾淀粉样变有以下临床特点[4]:①多无镜下血尿;②多无高血压,且易出现低血压尤其是体位性低血压;③严重肾衰竭时仍存在肾病综合征;④肾脏体积增大,即使慢性肾衰竭终末期肾脏体积也无缩小;⑤常伴肾静脉血栓。本患者既具备上述特点中的前4条。
肝脏是淀粉样变性常累及的器官之一,肝脏淀粉样变性临床特点主要为肝脏增大,然而肝大并不意味着一定有肝淀粉样物质沉积,如心肌淀粉样变引起心衰时亦可引起肝脏充血肿大,单从临床表现难以鉴别,必须依靠肝活检[5]。本患者无心衰的临床表现,故不考虑肝淤血。肝淀粉样变其他常见临床表现均不具有特异性,出现比例较高的有腹胀、腹水、脾大等。实验室检查特点为肝细胞损伤性指标如转氨酶升高不明显,而梗阻性指标如碱性磷酸酶(ALP)及γ‐谷氨酰转移酶(γ‐GT)升高较常见,升高幅度也大,而无门脉高压和胆汁淤积[6]。此患者即符合上述特点。由于淀粉样变患者肝活检出血风险增加,且此患者符合肝脏淀粉样变的临床特点,故未再进行肝活检。
淀粉样变心肌病的临床表现早期为心脏舒张功能障碍以后发展到限制性心肌病,有右心衰竭的症状和体征,部分患者发展为难治性充血性心力衰竭[7]。如果影响到心脏传导系统可导致多种难治性心律失常,最常见的是传导阻滞和心房颤动。心电图表现为标准肢导联低电压和胸导联R 波递增不良。超声心动图表现为心室壁和室间隔明显对称性肥厚,左室心腔正常或缩小,左室舒张功能减退,而患者血压不高,合并有心肌特征性回声增强(颗粒状闪烁样表现)。此患者肾脏病理为淀粉样变,心电图及超声心动图较符合上述淀粉样变心肌病表现,故考虑存在淀粉样变心肌病。此患者诉2年前曾诊为“心肌梗死(MI)”,虽然淀粉样变心肌病也可合并MI[3],但患者2年前无持续心前区疼痛的症状,平日也未发作明显胸闷、胸痛,超声心动图未见室壁节段性运动不良,且淀粉样变心肌病也可出现类似陈旧性心肌梗死(OMI)图形,故倾向于此患者不合并OMI。进一步明确患者是否存在MI,可做冠状动脉造影或多层螺旋CT 冠状动脉成像,但上述检查均需应用造影剂,患者有肾功能不全,不宜做上述检查,且是否合并OMI,对此患者的治疗并无影响,进一步检查的意义不大。
患者贫血可用肾性贫血解释,血小板增多是由于由于淀粉样物质替代正常脾组织,导致脾功能低下,脾脏吞噬血小板的功能减退,继发性血小板增多症[8]。此患者骨髓象检查结果也支持肾性贫血及继发性血小板增多症。
此患者由于肿瘤标志物明显升高,不易排除恶性肿瘤,行PET/CT 仍未发现恶性肿瘤的迹象,那么如何解释此患者的肿瘤标志物的异常?
Kumar 等报道在结核性腹水、心功能不全以及创伤造成腹水的患者中CA125 同样明显增加,其在非妇科肿瘤致腹水患者中也有明显升高[9]。有学者认为腹水可能刺激腹膜间皮细胞,使其产生CA125 增加,通过腹膜屏障,以一定的比例吸收进入血液循环,引起血清CA125 升高[10]。Col azos 等发现CA125 在检测少量到中等量腹水的敏感性上强于体格检查,其水平升高可能代表腹水的存在[11]。相反,CA125 正常就可排除腹水的可能。此患者有明显的腹水,其CA125 升高应与此有关。
CA19‐9 可由胆道上皮细胞分泌[12],因此它在一些非肿瘤个体中也可测到,但含量一般较低。在一些特殊情况下,如胆道感染、胆道梗阻、肝功能异常时,CA19‐9 清除减少及胆道上皮分泌CA19‐9 增多,可致血清中CA19‐9 含量升高。CA19‐9 与肝功能各指标间相关性密切,有研究提示CA19‐9 与总胆红素(TBil)和碱性磷酸酶(ALP)存在线性关系,随着TBil 和ALP 增加而增加。以上结果提示CA19‐9 与胆汁排出或胆道通畅程度密切有关。胆道梗阻时CA19‐9 可随胆红素等反流入血,故当存在胆红素、γ‐GT及胆汁酸明显升高时应注意CA19‐9 假阳性的可能[13,14]。本例患者ALP、γ‐GT 明显升高,结合上述观点考虑此患者CA19‐9 假阳性的可能性大。
淀粉样变的诊断依靠组织活检,受累脏器如肝、肾活检阳性率非常高,也可采取创伤性较小的部位活检,如腹部皮下脂肪、直肠黏膜等[15]。刚果红染色是诊断淀粉样变的“金标准”,刚果红染色阳性确定为淀粉样变后,应用特异性抗体的免疫组化和免疫荧光检查方法,可进一步区分淀粉样变的类型。高锰酸钾染色虽简便易行,但准确性较差,已失去淀粉样变临床分型意义[16]。原发性系统性淀粉样变免疫组化或免疫荧光检查显示κ或λ轻链阳性。但现有的轻链抗体可能因其轻链结合部位不同,以致部分免疫组化检测为假阴性,另由于部分轻链存在缺陷,导致抗原决定簇缺失时,免疫荧光检查也可能出现假阴性结果,需结合血、尿免疫固定电泳单克隆带检测。本例患者虽由于检验条件限制未进行血、尿免疫固定电泳,但肾组织λ轻链免疫荧光阳性,不影响最后诊断。诊断原发性系统性淀粉样变性还要除外多发性骨髓瘤等恶性浆细胞疾病所伴发的淀粉样变性。本例患者无骨痛等症状,颅骨平片未见溶骨性改变,骨髓象浆细胞比例不高,不支持多发性骨髓瘤。
在2000年前后,大剂量静脉应用美法仑联合自体外周造血干细胞移植(HDM/SCT),逐步成为治疗原发淀粉样变性的主要方法,但有2个以上器官累及或有严重心脏受累的被认为是高度危险,其围移植期死亡率高,因此这类患者不适宜行干细胞移植[17]。不适于造血干细胞移植的可予MP(美法仑、泼尼松)或MD(美法仑、地塞米松)方案治疗,MP 或MD 方案无效者可应用沙利度胺加地塞米松方案[18]。Jaccard 等报道了一项RCT,比较了HDM/SCT 与MD 方案,结果显示HDM/SCT 并不优于MD 方案[19]。目前对于原发淀粉样变性病最佳治疗方案的选择尚无定论,治疗应考虑患者的具体病情和医疗单位的条件后决定。本例患者显然不适合干细胞移植,且患者已经出现肾衰竭,故选择了副作用相对小的沙利度胺加地塞米松方案。
原发性淀粉样变预后不佳,确诊后的平均生存期为2年[20]。生存期主要取决于脏器受累的程度和部位,患者多死于心脏和肾脏病变。
参考文献
[1]Lachmann HJ,Hawkins PN .Systemic amyloidosis .Curr Opin Phar macol,2006,6(2):214‐220 .
[2]Katzmann JA,Abraham RS,Dispenzieri A,et al .Diagnostic perfor mance of quantitative kappa and lambda free light chain assays in clinical prac tice.Clin Chem,2005,51(5):878‐881 .
[3]Neben‐Wittich MA,Wittich CM,Mueller PS,et al .Obstructiveintramural coronary amyloidosis and myocardial ischemia are common in primary amyloidosis .AmJ Med,2005,118(11):1287 .
[4]陈楠.肾淀粉样变性诊断治疗的临床体会.肾脏病与透析肾移植杂志,2005,14(5):36‐37 .
[5]Park MA,Muel er PS,Kyle RA,et al .Primary(AL)hepatic amyloidosis:clinical features and natural history in 98 patients .Medicine(Baltimore),2003,82(5):291‐298 .
[6]张进安,肖婉侠,董济民,等.原发性系统性淀粉样变24例临床病理分析.中国老年学杂志.2008 .28(4):391‐392 .
[7]马爱群,吴格如.心脏淀粉样变性诊断与治疗(附病例介绍与分析).中华心血管病杂志,2006,34(12):1150‐1152 .
[8]Kyle RA,Gertz MA,Greipp PR,et al .Long‐ter msurvival(10 years or more)in 30 patients with primary amyloidosis .Blood,1999,93(3):1062‐1066 .
[9]Kumar KS,Lee WM.Chylous ascites with marked elevation of CA‐125 in cirrhosis .AmJ Gastroenterol,2000,95(11):3313‐3314 .
[10]肖文斌,刘玉兰.肝硬化患者血清和腹水CA125 升高.世界华人消化杂志,2003,11(11):1720‐1722 .
[11]Col azos J,Genol a J,Ruibal A .CA 125 serum levels in patients with non‐neoplastic liver diseases .A clinical and laboratory study .Scand J Clin Lab Invest,1992,52(3):201‐206 .
[12]Maestranzi S,Przemioslo R,Mitchel H,et al .The effect of benign and malignant liver disease on the tumour markers CA19‐9 and CEA .Ann Clin Biochem,1998,35(1):99‐103 .
[13]Mann DV,Edwards R,Ho S,et al .Elevated tumour marker CA19‐9:clinical interpretation and influence of obstructive jaundice.Eur J Surg Oncol,2000,26(5):474‐479 .
[14]Peterli R,Meyer‐Wyss B,Herzog U,et al .CA19‐9 has no value as a tumor marker in obstructive jaundice.Schweiz Med Wochenschr,1999,129(3):77‐79 .
[15]Kaplan B,Vidal R,Kumar A,et al .I mmunochemical microanalysis of amyloid proteins in fine‐needle aspirates of abdominal fat .Am J Clin Pathol,1999,112(3):403‐407 .
[16]Picken MM .New insights into systemic amyloidosis:the i mportance of diagnosis of specific type.Curr Opin Nephrol Hypertens,2007,16(3):196‐203 .
[17]林洁,段云,武永吉.原发性系统性淀粉样变性的诊断及治疗.中华血液学杂志,2003,24(6):335‐336 .
[18]Comenzo RL .Managing systemic light‐chain amyloidosis .J Natl Compr Canc Net w,2007,5(2):179‐187 .
[19]Jaccard A,Moreau P,Leblond V,et al .High‐dose melphalan versus mel phalan plus dexamethasonefor AL amyloidosis .N Engl J Med,2007,357(11):1083‐1093 .
[20]Kumar V,Abulk AB,Fausto N.Pathologic basis of disease.7th ed . Philadelphia:W.B.Elsevier Saunders Company,2005:258‐264 .
来源:《内科疑难病例.泌尿分册》
作者:杜新 齐卡
参编:陈光磊 余鹏程 徐德宇 毕礼明 刘伟
页码:78-93
出版:人民卫生出版社
- 评价此内容
- 我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号
 会员登录
会员登录

