发热、出血和肾脏损害 你能想到这种病吗?
患者,女,42岁,安徽东至县人。于2008年6月4日入院。
主诉:发热4天,无尿1天。
现病史:患者4天前无明显诱因下出现畏寒、发热,发热呈持续性,体温在38℃以上。当地医院拟诊“急性上呼吸道感染”,予“青霉素、双黄连”静滴,发热症状无好转,查血吸虫间接红细胞凝集试验(I HA)阴性,有轻微腰痛。1天前出现少尿,24小时尿量小于100ml。当地医院查血常规:血红蛋白83g/L,白细胞16.1×10 9/L,中性粒细胞76%,血小板25 ×10 9/L;血肌酐368μmol/L,尿素氮20.2mmol/L,尿酸468μmol/L,二氧化碳结合力16.5mmol/L。遂转入院,门诊拟“急性肾衰竭”收入院。病程中,有恶心、呕吐,无头痛、意识障碍,无皮疹及出血点,无腹痛、腹泻及黑便。食欲及精神差。
既往史:有疫水接触史,该地区有肾综合征出血热散发病例报告史。
体格检查:体温:37℃,脉搏:86次/分,呼吸:19次/分,血压:120/80mmHg。神志清楚,轻度贫血貌。全身皮肤黏膜无黄染,无皮疹。全身浅表淋巴结无肿大。颜面部无潮红,眼睑轻度水肿;咽充血,扁桃体未见肿大。颈软,无抵抗,颈静脉无怒张。双肺呼吸音清晰,双肺未闻及干、湿性啰音。心尖搏动正常,心率86次/分,律齐,各瓣膜听诊区未闻及杂音。腹平坦,腹部柔软,无压痛、反跳痛,腹部无包块。肝脾均未触及,移动性浊音阴性,双肾区轻度叩击痛,双下肢轻度凹陷性水肿。
病情分析
患者,中年女性,畏寒、发热伴腰痛,伴急性肾功能损害,当地检查有血白细胞升高、中度贫血、血小板减少,有无一过性低血压史不详。体格检查血压正常,基础血压不详,全身未发现出血点及瘀斑,双肾区轻度叩击痛。从发热、贫血、血小板减少、急性肾衰竭分析,要考虑TTP‐HUS。TTP‐HUS 是血栓性微血管病,是临床上较少见的一种病因不明的血栓性微血管病(thrombotic microangiopathy,T MA),典型临床表现具有TTP“五联症”(发热、严重中枢神经系统症状、微血管病性溶血性贫血、血小板减少、肾功能损害)和HUS“三联症”(TTP 后三联表现),临床除外弥散性血管内凝血(disseminated intravascular coagulation,DI C)等疾病时可考虑诊断,需要进一步寻找溶血的依据,如血乳酸脱氢酶、网织红细胞升高,非结合胆红素升高,外周血发现畸形、破碎红细胞等。
该患者没有典型“三红、三痛”及明确的低血压休克期,但患者处于出血热疫区,有腰痛及血小板显著减少、白细胞升高、蛋白尿、肾功能损害,故需要行出血热抗体进一步明确。
对于发热、血小板减少、急性肾衰竭的育龄女性,还要注意排除自身免疫系统疾病,尤其是SLE。Ⅳ型狼疮肾炎临床可表现为急进性肾小球肾炎,可有发热及血小板减少、血尿、蛋白尿表现,但多有狼疮的多系统表现,如皮疹、关节痛、白细胞减少、脱发、口腔溃疡、光过敏等,自身免疫抗体可以进一步鉴别。
某些发热性传染性疾病,如伤寒、钩端螺旋体病、登革热等。重型钩端螺旋体病可出现发热、中枢神经系统损害、黄疸、血小板减少及球结膜出血,可结合抗钩端螺旋体抗体和疫水接触史加以鉴别。
入院初步诊断为急性肾衰竭:①血栓性血小板减少性紫癜‐溶血性尿毒症综合征(thrombotic thrombocytopenia purpura‐‐‐hemolytic uremic syndrome,TTP‐HUS)?②肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)?③自身免疫系统疾病?系统性红斑狼疮(systemic lupus erythematosus,SLE)?④急性发热性传染性疾病?
院内观察
入院后即给予急诊血液透析治疗,并围绕初步诊断进一步完善实验室检查。
血常规:血红蛋白78g/L,白细胞(WBC)21.2×10 9/L,中性粒细胞57%,血小板16 ×10 9/L,血网织红细胞3.0%。血沉:53mm/h。尿液检查:蛋白++,红细胞镜检16/μL,比重1.010,p H5.5,小圆上皮细胞4.6/HP,余正常;24小时尿蛋白定量0.8g/24h(210ml)。大便常规未见异常,潜血++。血清生化:总蛋白52g/L,白蛋白27g/L,球蛋白25g/L,总胆红素及非结合胆红素正常,丙氨酸氨基转移酶64U/L,天门冬氨酸氨基转移酶128U/L,γ‐谷氨酰基转移酶10U/L,碱性磷酸酶60U/L。肌酐443μmol/L,尿素氮16.1mmol/L。葡萄糖4.8mmol/L,尿酸412μmol/L,二氧化碳结合力21mmol/L,钾离子5.0mmol/L,钠离子136mmol/L,氯离子97mmol/L,钙离子1.75mmol/L,磷1.98mmol/L。免疫学检查:补体C3 0﹒87g/L,补体C4 0﹒15g/L。自身抗体检查:ANA、抗ds‐DNA 抗体、抗Sc1‐70 抗体、抗Jo‐1 抗体、抗Sm 抗体、抗SSA 抗体、抗SSB 抗体等均为阴性;ASO 阴性;Coombs test(直接法)阴性;血清出血热抗体IgM 及IgG 阳性。凝血功能:凝血酶原时间15.5秒,血浆纤维蛋白原2.2g/L,纤维蛋白降解产物阴性,D‐二聚体阴性。外周血涂片:成熟红细胞可见苍白区扩大、皱缩红细胞及碎片。心电图及全胸片正常。
骨髓细胞学检查:① 骨髓增生活跃,粒系49.5%,红系40.5%,粒∶红=1.22;②粒系增生活跃,可见胞体肿胀、颗粒增粗。红系增生活跃,以中晚幼红为主,部分中晚幼红可见核小浆少,边缘不齐,成熟红细胞大小不一,部分红细胞可见皱缩、头盔、泪滴样改变;③巨核细胞增生活跃,产血小板功能不佳。
双肾彩超:双肾轮廓清楚,形态正常,体积增大。左肾大小约13.8cm×6.2c m×6.5cm,右肾大小约12.4c m×5.4cm×5.3cm,左肾实质厚2.0c m,右肾实质厚1.8cm,皮质髓质界限清晰,实质回声减低,肾盂无分离,双输尿管无扩张。
治疗及转归
根据患者临床有发热、血小板减少、蛋白尿、腰痛及肾损害,血清特异性抗体Ig M 及IgG 阳性,故HFRS 诊断成立。给予间断血液透析,纠正水、电解质及酸碱平衡紊乱;加用利巴韦林抗病毒治疗;短期使用糖皮质激素改善发热等中毒症状;扩容、补充血容量,稳定血压,防治DI C,营养支持等综合治疗措施。患者发热腰痛明显好转,血压平稳,贫血改善,尿量逐渐增多,住院第12天进入多尿期,第20天肾功能完全恢复出院。
讨论
肾综合征出血热(HFRS)又称流行性出血热(epidemic hem orrhagic fever,EHF),是一类以鼠类为主要传染源,由汉坦病毒(hantavirus)感染引起的急性自然疫源性疾病。临床可表现为突发高热、寒战、头痛、畏寒、咳嗽和肌肉、关节、腰痛为特征,出现肾脏和其他脏器出血,常伴随恶心、呕吐。突出的临床表现是发热、出血和肾损害。1982年WHO 在日本东京会议正式命名肾综合征出血热[1]。目前世界上有30 多个国家发现HFRS,我国是HFRS 流行最严重的国家,每年发病人数占世界汉坦病毒感染病例的90%以上[2]。我国大陆除青海省与新疆维吾尔自治区外,各省、自治区、直辖市均有病例发生,台湾也有汉坦病毒感染病例报道。本病在我国主要分为姬鼠型和家鼠型两种类型,其中黑线姬鼠、黄颈姬鼠和大林姬鼠为姬鼠型出血热的主要宿主动物和传染源,褐家鼠为家鼠型出血热的主要宿主动物和传染源。HFRS 根据血清型不同有不同的季节发病特点,在姬鼠型出血热疫区,高发季节为冬季;在家鼠型出血热疫区,高发季节为春季;在混合型疫区,高发季节为冬春季。进入90年代以来,春季流行高峰有所增强,而冬季流行高峰趋于下降[3]。
目前对HFRS 传播途径存在着多途径的看法,认为可能的传播途径有3 类5 种[4],即动物源性传播(包括通过伤口、呼吸道和消化道三种途径传播)、虫媒传播和垂直传播。其中动物源性传播是主要的传播途径,啮齿类动物感染后,病毒可随、尿、粪、唾液及血液排出体外,当人从呼吸道吸入、消化道食入或皮肤黏膜破损处直接接触污染物后,即可能被感染。不同年龄、性别、职业的人群对汉坦病毒具有普遍的易感性[5],其中隐性感染率较显性感染(发病)率一般大几十到几百倍以上,家鼠型疫区人群隐性感染率(8%~20%)明显大于姬鼠型疫区(1%~5%)。
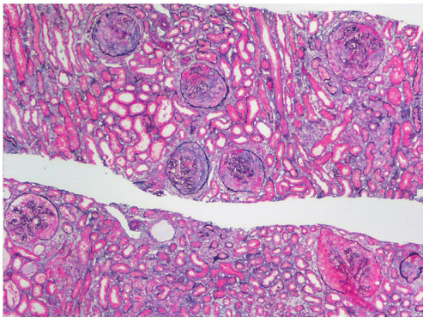
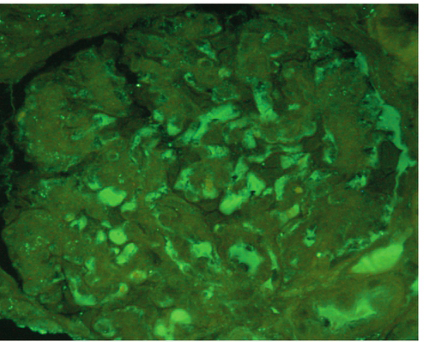
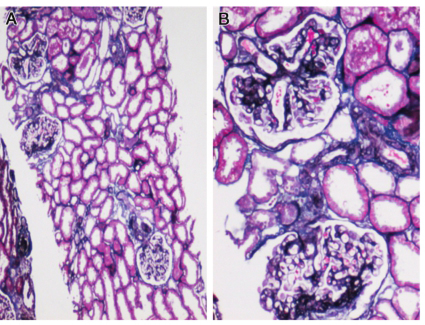
肾综合征出血热的发病机制尚未完全阐明,现认为汉坦病毒作为始动因素,不仅可以直接引起组织的损伤,还诱导机体免疫应答及多种细胞因子和炎症介质的释放,导致进一步的免疫损伤和机体内环境的紊乱。主要有3 种学说:①病毒直接损伤学说;②免疫介导学说;③细胞因子/介质作用学说。其中血管内皮细胞损伤成为研究的焦点,病毒抗原通过直接损伤或免疫因素导致全身微血管广泛性损害。血管病变可以通过以下途径损伤肾脏:①血浆大量外渗导致低血容量、低血压,肾脏血流灌注不足;②肾脏血流减少刺激肾素分泌,使血管紧张素分泌增多,进一步收缩肾动脉而加重肾缺血;③微血管病变致肾间质水肿出血,压迫肾小管;④肾血流量减少、少尿,导致T‐H 蛋白(Tamm‐Horsefal protein)及滤过的血浆蛋白形成管型,堵塞肾小管。这些因素均可以导致肾小管坏死,另外弥散性血管内凝血、肾微循环障碍、免疫复合物进一步加重肾脏损伤。肾脏病理改变以肾间质及血管损害为主,而肾小球病变轻微。光镜下可见小血管内皮细胞肿胀、变形和坏死,管腔内可有微血栓形成。肾实质细胞缺血变形坏死,肾间质水肿、出血及炎症细胞浸润,病程后期可有轻度纤维化。肾小管上皮细胞发生不同程度的变形,严重者出现广泛肾小管坏死,其管腔内有较多红细胞及管型。免疫荧光检查发现可见IgG 或IgM 及C3 呈颗粒样沉积于肾小球、肾小管、小血管壁及肾间质。电镜检查在肾小球基底膜内、内皮下及系膜区见到电子致密物。
引起出血热患者出血原因复杂多样,有时以单一原因为主,有时则是多种原因的交错。一般认为发热期皮肤黏膜的出血点,主要是毛细血管损伤与血小板减少及功能异常所致。皮下全身广泛大片瘀斑,伴胃肠道出血或泌尿道出血等,主要以弥散性血管内凝血(DI C)、肝素类物质增加,以及尿毒症等原因所致,此外血小板减少及功能障碍,各种凝血因子障碍亦为其因素之一。
典型HFRS 具有三主征,即发热、出血和肾脏损害,病程中依次出现5 期经过,即发热期、低血压休克期、少尿期、多尿期和恢复期。重症病例可有2 期或3 期重叠,而轻症或不典型病例可不具备5 期经过。该病发热期的临床表现主要为发热、全身中毒症状、毛细血管和小血管损害、肾脏损害及肝损害[6]。①发热:以高热多见,体温38~40℃,部分患者体温高达40℃以上。大多数患者起病急骤,有畏寒,部分患者可有寒战,也有体温缓慢上升,2~3天后升至40℃。热型以稽留热和弛张热多见,少数为不规则热型。热程多数为3~7天,平均5天,亦有达10天以上者,家鼠型病例热程似较姬鼠型长。一般患者体温升高程度和持续时间与病情轻重密切相关。轻型病例及家鼠型患者,常于热退后病情减轻;中、重型病例热退后病情反而加重。②全身中毒症状:表现为困倦无力,全身肌肉关节酸痛;食欲减退、恶心、呕吐、腹痛及腹泻等消化道症状,可因剧烈腹痛、腹部压痛及反跳痛而误诊为急腹症,亦可因腹泻或黏液血便诊断为细菌性痢疾。重症患者可出现嗜睡、烦躁、谵妄及抽搐等神经精神症状。③毛细血管损害表现:充血、渗血和出血现象。包括“三红”,表现为颜面、颈部、上胸部处皮肤显著充血、潮红,状如日晒,压之可褪色,似酒醉貌;也可见眼结膜、舌尖及舌乳头充血、潮红。水肿为本病的特点,可出现皮下水肿、球结膜水肿或胸腔积液、腹水。由于渗出而出现“三痛”,即头痛、腰痛和眼眶痛。出血表现为软腭、口腔黏膜、眼结膜以及皮肤出血点。典型出血热的出血点分布在腋下、前胸及后背皮肤,呈条索样、鞭击样、挠抓样或串珠样瘀点或瘀斑。亦可有鼻出血、咯血、血尿及消化道出血。④肾脏损害表现:病后1~2天即可出现,主要表现为尿蛋白、镜下或肉眼血尿,尿中膜状物和少尿,以至急性肾衰竭。⑤肝脏损害表现:尤其在家鼠型患者多见,约80%出现转氨酶增高,个别可有黄疸,甚至表现为暴发型肝炎。
本病实验室检查的特点有:①WBC 系在发热期改变不明显,随着病程进展和加重,WBC 计数及中性粒细胞计数均明显升高,至少尿期达高峰,其峰值的高低与病情轻重呈正比。②外周血异型淋巴细胞增多是诊断HFRS 的重要依据之一,发病早期(病程1~3天)就可查见异型淋巴细胞,且随着病程及病情加重明显增多,可占分类的3%~30%,当异型淋巴细胞数量>10%提示病情危重、预后差。③血小板及其参数的改变最为明显。血小板减少也是诊断本病的重要依据。血小板于发热期有所下降,随病情发展,进一步减少,少尿期下降至最低值。血小板减少的程度与病情的轻重成正相关,当血小板数量<40 ×10 9/L 时,常伴有大面积皮肤出血或腔道出血,提示病情严重,需尽早补充血小板。④血清特异性IgM 抗体发病第2天即可阳性,1周左右达高峰,而IgG 抗体出现较晚。IgM 抗体阳性或者IgG 抗体1周后上升4倍或4倍以上具有诊断价值。⑤尿液的主要改变是蛋白质、隐血、比重、尿融合细胞的出现,镜检有红细胞。尿蛋白检查是反映肾脏损害的最早表现,重症患者可出现肾病综合征范围的蛋白尿,提示肾小球病变。我国及日本患者尿中可有膜状物(纤维蛋白与细胞碎片的凝集物),对提示本病有意义。
“三早一就”(即早发现、早休息、早治疗,就近治疗)、预防性治疗和发热期抗病毒治疗是出血热治疗的基本原则。目前HFRS的治疗以综合治疗措施为主,包括抗病毒、液体疗法、血液透析疗法、维持内环境稳定和必要的对症治疗等,随着HFRS 发病机制和各期病理生理变化的进一步阐明,本病的治愈率显著提高,近年全国平均病死率已降至1%以下。①抗病毒治疗:汉坦病毒的直接致病作用为早期抗病毒治疗提供了理论依据,一般认为起病5~7天内使用抗病毒治疗有效,现应用较广泛的抗病毒药物包括利巴韦林(病毒唑)和干扰素。应用利巴韦林和干扰素能缓解病情、缩短病程、提高治愈率。②液体疗法:HFRS 患者各期均有水电解质失衡,故合理的液体疗法仍是治疗本病的关键。发热期患者血容量已有下降,血浆胶体和晶体渗透压均有降低,补液应以平衡液为主,适量给予胶体液如白蛋白和血浆。补液量不宜过多,1000~2000ml/d。低血压休克期胶体和晶体渗透压下降更为明显,应采用晶体液和胶体液结合,充分补足血容量。少尿期患者处于高血容量、高晶体渗透压和细胞内脱水状态,应严格限制补液量并尽量减少使用晶体液。③抗休克治疗:HFRS 患者血浆外渗,有效循环血量不足是HFRS 早期休克的主要原因,应尽早、尽快、适量的补充血容量,同时纠正酸中毒,改善微循环。补液宜遵循“先快后慢”、“先晶后胶”、“三晶一胶”的原则,根据血压、脉搏、尿量、外周循环灌注、血红蛋白和血细胞比容等情况调整补液量和速度。在扩容、纠正酸中毒、血容量补足后血压仍低时,可选用血管活性药物如多巴胺、间羟胺和山莨菪碱。肾上腺皮质激素可改善中毒症状、降低毛细血管通透性,可酌情使用。④急性肾衰竭的治疗:透析疗法除了可以排出毒性代谢产物,为组织修复赢得时间,还能起到部分调节免疫细胞平衡,清除过多的细胞因子和炎症介质等作用。我国《出血热防治方案》[7]规定的透析指针为:少尿超过5日或尿闭2日以上,经利尿等治疗无效或尿量增加缓慢,尿毒症表现日趋严重,血尿素氮大于28.6~35.7mmol/L;高血容量综合征保守治疗无效,伴肺水肿、脑水肿及肠道大出血者;合并高钾血症(大于6.5mmol/L),心电图出现高钾血症图形,用一般方法不能缓解者;凡进入少尿期后,病情进展迅速,早期出现严重意识障碍,持续性呕吐、大出血、血尿素氮上升速度快,每日超过9mmol/L(高分解代谢型)。但临床研究发现适当放宽透析指征,尽早透析可提高治愈率。⑤出血的治疗:HFRS 患者出血的机制复杂,包括毛细血管通透性增加;血小板数量减少和功能障碍;弥散性血管内凝血所致的消耗性低凝和继发性纤溶亢进等,应针对不同的原因采取适当的治疗。血小板数量与功能的下降是早期出血的重要原因,故输注新鲜浓缩血小板是防治出血的有效替代措施。研究发现血小板表面免疫复合物的沉积是导致血小板数量与功能下降的原因之一,故有报道用静脉丙种球蛋白治疗可明显提高血小板的计数,减少出血。此外,有明确DI C 证据者加用肝素,有出血和纤溶证据者加用氨基己酸或羧基苄胺。
参考文献
[1]WHO.Requirements for hemorrhagic fever with renal syndrome(HFRS)vaccine(inactivated).WHO Technical Report Seties,1994:848‐854 .
[2]王晓芳,王茂武,孙辉.2004‐2005年中国肾综合征出血热疫情分析.疾病监测,2007,22(5):307‐309 .
[3]陈化新.中国肾综合征出血热监测.中华流行病学杂志,2002,23(1):68‐71.
[4]张云.肾综合征出血热传播途径的研究.中华流行病学杂志,2003,24(4):68‐70 .
[5]杨占清,刘运喜,王锦凤.山东省流行性出血热病人与宿主动物血清学分型及其意义的研究.中国人兽共患病杂志,1999,15(2):56‐58 .
[6]杨为松.肾综合征出血热.北京:人民军医出版社,1999:289‐296 .
[7]中华人民共和国卫生部.流行性出血热防治方案.中华传染病杂志,1988,6(3):188‐192 .
(刘伟 柳昔敖)
来源:《内科疑难病例.泌尿分册》
作者:杜新 齐卡
参编:陈光磊 余鹏程 徐德宇 毕礼明 刘伟
页码:11-21
出版:人民卫生出版社
- 评价此内容
- 我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号
 会员登录
会员登录

