方全副主委:ICD预防非缺血性收缩性心衰患者猝死——DANISH试验解读
一、研究重温
2016 年8 月在意大利罗马,欧洲心脏病学年会(ESC)期间,来自丹麦哥本哈根Rigshospitalet医院的Køber医学博士公布了DANISH试验的临床结果,文章[1]同期发表在新英格兰医学杂志上,引起了广泛的关注和讨论。
DANISH试验的主要目的是评估ICD对非缺血性收缩性心力衰竭患者死亡率的影响。研究纳入了1116 例非冠状动脉病变原因导致的非缺血性收缩性心力衰竭(LVEF≤35%)患者,随机分为植入ICD治疗组(556 例)和对照组(560 例),研究的主要终点是全因死亡率的差异,次要终点是心脏性猝死(SCD)和心血管死亡风险在ICD组是否获益。
在中位随访67.6个月后,ICD组中120 例患者(21.6%,4.4个事件/100 人•年)出现主要终点,对照组出现主要终点则有131 例患者(23.4%,5.0个事件/100 人•年),两组比较并无统计学差异(HR=0.87,95%CI:0.68~1.12,P=0.28)。在心血管死亡方面,ICD组有77 例患者(13.8%),对照组有95 例患者(17.0%),两组比较亦无统计学差异(HR=0.77,95%CI:0.57~1.05,P=0.10)。然而,在心脏性猝死发生率方面,ICD组(24例,4.3%)较对照组(46 例,8.2%)显著降低(HR=0.50,95%CI:0.31~0.82,P=0.005)。
在安全性终点方面,ICD组(27 例)和对照组(20 例)的器械感染发生率方面无统计学差异(4.9% vs 3.6%,P=0.29)。在ICD组,33 例患者(5.9%)发生不恰当放电。
在对预设亚组进行亚组分析时发现,在<68 岁的相对年轻人亚组中,ICD组的全因死亡率较对照组显著降低(HR=0.64,95%CI:0.45~0.90,P=0.01);在<59 岁的更加年轻的人群中,ICD组的全因死亡率同样较对照组显著下降(HR=0.51,95%CI:0.29~0.92,P=0.02)。
在LVEF<25% 和≥25% 亚组、心功能NYHA Ⅱ级和Ⅲ~Ⅳ级亚组中,两组死亡率均无差异。而在植入CRT 人群和非植入CRT 人群的两个亚组中,全因死亡率在ICD组和治疗组均无统计学差异,提示ICD的治疗效果和是否植入CRT 无关(相互作用P=0.73)。在不同病因的亚组(特发性/ 瓣膜性/ 高血压导致/其他病因)中,上述死亡率也没有差异。
二、猝死一级预防再添新证
目前欧美以及我国心力衰竭诊治处理指南对收缩性心力衰竭患者心脏性猝死的一级预防的推荐是基本一致的。2013 年ACCF/AHA 心力衰竭处理指南[2]对于非缺血性扩张型心肌病且LVEF≤35% 的患者,若心功能NYHAⅡ或Ⅲ级,已经稳定充分应用指南推荐的药物治疗,而且预期寿命超过1 年者,推荐植入ICD进行SCD 一级预防,以降低死亡率(Ⅰ类推荐,证据等级A);2016 年ESC 急慢性心力衰竭诊治指南[3]同样推荐对于具备上述情况的患者植入ICD以降低心脏性猝死和全因死亡的风险(Ⅰ类推荐,证据等级B);2014 年中华医学会中国心力衰竭诊断和治疗指南同样给予了类似推荐(Ⅰ类推荐,证据等级B)[4]。然而,ICD对于非缺血性收缩性心力衰竭患者心脏性猝死的一级预防的证据并不充分。
2004 年新英格兰医学杂志发表的DEFINITE 研究[5],纳入了458 例非缺血性扩心病(LVEF<36%)伴室早或非持续性室速的患者,随机分为标准药物治疗组(229 例)和药物联合ICD组(229 例),平均随访(29.0±14.4)个月,共发生68 例死亡,其中ICD组28 例,药物组40 例(HR=0.65,95%CI:0.40~1.06,P=0.08)ICD组有下降的趋势;在心律失常性猝死方面,共发生17 例,其中ICD组3 例,另外14 例发生在标准药物治疗组(HR=0.20,95%CI:0.06~0.71,P=0.006),首次通过RCT 研究证实ICD显著降低此类患者SCD 风险。
2005 年发表的SCD-HeFT研究[6]证实,与安慰剂组相比,ICD组显著降低全因死亡率23%(HR=0.77,95%CI:0.62~0.96,P=0.007)。另一篇文章对SCD-HeFT研究的死亡原因进行分析发现,植入ICD可显著减少室性心律失常导致的猝死(HR=0.40,95%CI:0.27~0.59,P<0.001)[7]。然而,在SCD-HeFT入选的患者中,非缺血性患者仅占48%[6]。
DANISH 研究作为一项多中心随机对照研究,继DEFINITE 研究和SCD-HeFT研究之后,再次对非缺血性收缩性(LVEF≤35%)心力衰竭患者的心脏性猝死一级预防提供了最高等级的证据支持:对于上述患者,在合理优化药物和器械治疗的基础上,植入ICD,能够将首次SCD 发生相对风险显著降低50%。因此,DANISH 研究进一步确立了ICD在心脏性猝死一级预防中的地位,充分证明:无论是缺血还是非缺血性原因,在减少心脏性猝死方面,植入ICD均可显著获益(图1)。
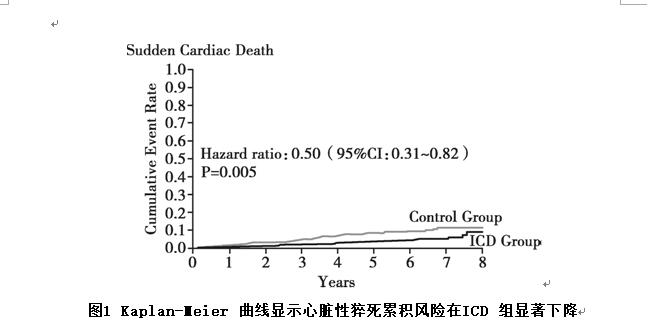
图1 Kaplan-Meier 曲线显示心脏性猝死累积风险在ICD组显著下降
三、未能降低全因死亡率:原因何在
在DANISH 研究中,ICD未能显著降低全因死亡率,研究主要终点为阴性结果。其原因可能是多样的,总体而言可能有以下3个原因。
首先是收缩性心力衰竭的药物治疗获得了重大进展。在DANISH 研究中,无论治疗组还是对照组,目前指南推荐的治疗收缩性心力衰竭的药物,包括ACEI、ARB、β受体阻滞剂和盐皮质激素拮抗剂的应用比例均很高,而且大部分都应用至目标剂量。例如,ACEI 或ARB 的应用均超过95%,β受体阻滞剂的应用均达到92%,醛固酮受体拮抗剂的应用比例也接近60%。而反观2005 年发表的SCD-HeFT研究(同时纳入缺血性和非缺血性心力衰竭患者),只有69% 患者应用β受体阻滞剂,20% 应用醛固酮受体拮抗剂[6]。由于优化药物治疗,显著改善了心力衰竭预后,在此基础上加用ICD期望进一步降低全因死亡,是非常困难的。而且,优化药物治疗还令收缩性心力衰竭患者的死亡原因构成比例发生了改变,心血管死亡显著下降,而非心血管死亡原因增加。
一项系统性综述汇总分析了既往评估收缩性心力衰竭患者死亡率的66 项临床研究共136 182 例患者,共32 140 例死亡,结果发现非心血管死亡的比例,从较低β受体阻滞剂应用组(应用比例<33%)的11.4%,升高到较高β受体阻滞剂应用组(应用比例>66%)的19.1%(P<0.001)[8]。
DANISH 研究中,无论是治疗组还是对照组,均有58% 的患者植入了CRT,在完全性左束支传导阻滞且QRS 波时程≥150 毫秒的患者中,93% 植入了CRT。CRT 可显著改善收缩性心力衰竭患者预后,在COMPANION 研究中[9],尽管CRT-P 未能显著降低全因死亡率,但是已经接近了临界的统计学差异(HR=0.76,95%CI:0.58~1.01,P=0.059),提示CRT-P 本身即可显著改善心力衰竭预后,因此DANISH 研究中高比例的CRT 植入率令ICD的治疗效果发生了稀释并不令人意外。
另一项研究纳入了1705 例植入CRT-P(535 例)或CRT-D(1170 例)的患者,随访2 年,评估两组患者的全因死亡率和不同死亡原因的差异,发现尽管CRT-P 组患者总体死亡率较高(HR=1.54,95%CI:1.07~2.21,P=0.0209)但两组相比SCD 发生率并无统计学差异(RR=1.21,95%CI:0.45~3.29,P=0.70),CRT-P 组主要升高的死亡原因并非猝死,而是心力衰竭的进展( RR=2.27,95%CI:1.62~3.18)和其他心血管死亡(RR=4.40,95%CI:1.29~15.03)[10],提示已经植入了CRT-P 的患者,继续进行ICD干预,并没有增加额外的潜在获益。而且,CRT 治疗后,以LVEF% 改善为突出表现的心功能恢复、左心室逆重构,令恶性心律失常减少,同样降低了ICD的干预效果。
一篇荟萃分析纳入6 项回顾性队列研究或RCT 研究的事后分析,包括1740 例患者,结果发现,植入CRT 后如果LVEF% 恢复到≥45%,ICD恰当放电显著减少到(2.3 次/100 人•年),与LVEF% 仍小于<45% 的患者相比,减少了5.8 次/100 人•年(95%CI:-7.6~-4.0,P<0.001)[11]。
第三,和缺血性患者相比,非缺血性患者的预后相对较好,CRT 治疗的反应性较高,也令ICD的进一步干预作用减弱。在MADIT-CRT 研究中,共191 例超反应的植入CRT 患者(LVEF% 改善≥14.5%),非既往心肌梗死造成的非缺血性病因是超反应的预测因素(OR =1.80,P<0.005),与超反应患者相比,无反应患者的全因死亡或心力衰竭显著升高(HR=5.25,95%CI:2.01~13.74,P=0.001)[12]。
因此,在优化的药物和CRT 治疗的基础上,非缺血心力衰竭患者预后显著改善,希望通过ICD进一步降低全因死亡率是非常困难的,DANISH 研究获得阴性结果是可以理解的。
四、值得注意的年龄分界点
DANISH 研究预设的年龄亚组中,在<68 岁的相对年轻人亚组中,ICD组的全因死亡率较对照组显著降低(HR=0.64,95%CI:0.45~0.90,P=0.01);而在≥68 岁的亚组,则为阴性结果。一项荟萃分析[13]纳入了5项ICD一级预防的RCT 研究,共3530 例患者,患者中位年龄62 岁,与年轻患者相比,年老患者合并症负荷更加严重,包括更多的心房颤动、高血压、外周血管疾病、肺病等,肌酐水平也更高;同时接受更多的PCI或外科血管重建,相反,接受β受体阻滞剂和ACEI 的比例却更少。
一项荟萃分析纳入4 项ICD一级预防的RCT 研究,评估了吸烟、肺病、糖尿病、外周血管疾病、心房颤动、冠心病和慢性肾脏疾病等合并症对ICD降低全因死亡率获益的影响;研究共纳入3348 例患者,少于2个合并症的患者有830 例(25%),2个以上(包括2个)合并症的患者2518 例(75%),与少于2个合并症的患者相比(HR=0.59,95%CI:0.40~0.87),2个以上(包括2个)合并症的患者中ICD的降低全因死亡率的获益减少(HR=0.71,95%CI:0.61~0.84);在校正了年龄、性别、人种、左室射血分数和药物应用之后,ICD的获益随着合并症数量的增多而减少(P=0.004)[14]。
而今年发表的一篇荟萃分析纳入了包括DANISH 研究在内的6 项既往ICD对非缺血性心力衰竭一级预防的RCT 研究同样发现,年轻人(<65 岁)中ICD显著降低全因死亡率(HR=0.63,95%CI:0.46~0.86,P=0.004),但老年人群并无此效果(HR=0.97,95%CI:0.56~1.68,P=0.92)[15]。
因此,随着年龄的增加,合并症也会增加,导致非心血管死亡增加,而ICD对于非心脏性猝死并无干预作用,因此老年患者植入ICD需要谨慎把握适应证。
五、非缺血收缩性心力衰竭:ICD与全因死亡率
至今为止,尚无一项随机对照研究证实在非缺血性收缩性心力衰竭患者中,植入ICD进行一级预防能降低全因死亡率。2005 年发表的SCD-HeFT研究[6]发现在常规药物治疗的基础上联合ICD,可显著降低收缩性心力衰竭患者(包括缺血性和非缺血性原因)全因死亡率,然而在预设的非缺血性心力衰竭亚组中,与安慰剂组相比,ICD组全因死亡率仅有下降的趋势(HR=0.73,95%CI:0.50~1.07,P=0.06)未达到统计学差异。在仅纳入非缺血性心力衰竭患者的DEFINITE 研究中,尽管证实ICD可降低心脏性猝死风险,但仍未能证实降低全因死亡率(HR=0.65,95%CI:0.40~1.06,P=0.08)[5]。
在DANISH 研究中[1],同样未能证实ICD的上述获益。我国学者对DANISH 研究未能取得全因死亡率的下降作出了分析,认为可能与研究的把握度设置、样本量的大小有关,如果增加样本量,或可取得主要终点的阳性结果[16]。增加样本量的方法之一是进行荟萃分析。今年发表的一项荟萃分析纳入6 项既往RCT 研究(包括CAT、AMIOVIRT、DEFINITE、SCD-HeFT、COMPANION 和DANISH 研究),共2967 例患者(ICD组1553 例,对照组1414例),ICD与显著降低全因死亡率有关(HR=0.78,95%CI:0.66~0.92,P=0.003)并显著降低心律失常死亡(HR=0.46,95%CI:0.29~0.71,P=0.0005)[15]。
六、总结和展望
从DANISH 研究的结果看,其充分肯定了ICD在非缺血性收缩性心力衰竭患者中对心脏性猝死一级预防的作用,进一步巩固了ICD在一级预防中的地位;尽管其未能在全因死亡率方面取得阳性结果,但是通过荟萃分析,ICD在非缺血性心力衰竭患者中的应用仍旧获得了高质量的证据支持。如何在心力衰竭优化治疗的背景之下,提高ICD一级预防的效率,是目前的主要研究方向。如何筛选出真正心脏性猝死高危的患者,排除非猝死的心血管死亡和非心血管死亡的干扰是一项重大的挑战。目前,指南[2-4]主要通过左室射血分数和NYHA 心功能分级来进行危险分层过于简化,应该充分利用其他风险评估手段,例如心脏磁共振检查、微伏级T 波电交替、基因筛查、致病因素的进一步细分等[17],都是潜在可利用的手段。
参考文献
1. Køber L,Thune JJ,Nielsen JC,et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med,2016,375(13):1221-1230.
2. Writing Committee Members,Yancy CW,Jessup M,et al. 2013 ACCF/AHA Guideline for the Management of Heart Failure:A Report of theAmerican College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation,2013,128(16):e240-e327.
3. Ponikowski P,Voors AA,Anker SD,et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure:The Task Forcefor the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology( ESC)Developed with the special contributionof the Heart Failure Association( HFA) of the ESC. Eur Heart J,2016,37(27):2129-2200.
4. 中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2014. 中华心血管病杂志,2014,42(2):98-122.
5. Kadish A,Dyer A,Daubert JP,et al. Prophylactic Defibrillator Implantation in Patients with Nonischemic Dilated Cardiomyopathy. N Engl J Med,2004,350(21):2151-2158.
6. Bardy GH,Lee KL,Mark DB,et al. Amiodarone or an Implantable Cardioverter-Defibrillator for Congestive Heart Failure. N Engl J Med,2005,352(3):225-237.
7. Packer DL,Prutkin JM,Hellkamp AS,et al. Impact of Implantable Cardioverter-Defibrillator,Amiodarone,and Placebo on the Mode of Death inStable Patients With Heart Failure Analysis From the Sudden Cardiac Death in Heart Failure Trial. Circulation,2009,120(22):2170-2176.
8. Rush CJ,Campbell RT,Jhund PS,et al. Falling Cardiovascular Mortality in Heart Failure With Reduced Ejection Fraction and Implications forClinical Trials. J Am CollCardiol HF,2015,3(8):603-614.
9. Bristow MR,Saxon LA,Boehmer J,et al. Cardiac-Resynchronization Therapy with or without an Implantable Defibrillator in Advanced ChronicHeart Failure. N Engl J Med,2004,350(21):2140-2150.
10. Marijon E,Leclercq C,Narayanan K,et al. Causes-of-death analysis of patients with cardiac resynchronization therapy:an analysis of theCeRtiTuDe cohort study. Eur Heart J,2015,36(41):2767-2776.
11. Chatterjee NA,Roka A,Lubitz SA,et al. Reduced appropriate implantable cardioverter-defibrillator therapy after cardiac resynchronizationtherapy-induced left ventricular function recovery:a meta-analysis and systematic review. Eur Heart J,2015,36(41):2780-2789.
12. Hsu JC,Solomon SD,Bourgoun M,et al. Predictors of Super-Response to Cardiac Resynchronization Therapy and Associated Improvement inClinical Outcome The MADIT-CRT( Multicenter Automatic Defibrillator Implantation Trial With Cardiac Resynchronization Therapy) Study. J AmCollCardiol,2012,59(25):2366-2373.
13. Hess PL,Al-Khatib SM,Han JY,et al. Survival Beneft of the Primary Prevention Implantable Cardioverter-Defbrillator Among Older Patients DoesAge Matter ? An Analysis of Pooled Data From 5 Clinical Trials. CircCardiovascQual Outcomes,2015,8(2):179-186.
14. Steinberg BA,Al-Khatib SM,Edwards R,et al. Outcomes of Implantable Cardioverter-Defibrillator Use in Patients With Comorbidities:ResultsFrom a Combined Analysis of 4 Randomized Clinical Trials. JACC Heart Fail,2014,2(6):623-629.
15. Stavrakis S,Asad Z,Reynolds D. Implantable Cardioverter Defibrillators for Primary Prevention of Mortality in Patients With NonischemicCardiomyopathy:A Meta-Analysis of Randomized Controlled Trials. J CardiovascElectrophysiol,2017,28(6):659-665.
16. 黄德嘉,张澍. 非缺血性心力衰竭患者心脏性猝死的预防——DANISH 研究带给我们的思考和启示. 中华心律失常学杂志,2016,20(6):461-463.
17. Disertori M,Quintarelli S,Mazzola S,et al. The need to modify patient selection to improve the benefits of implantable cardioverterdefibrillator forprimary prevention of sudden death in non-ischaemic dilated cardiomyopathy. Europace,2013,15(12):1693-1701.

方全,男,主任医师,教授,心内科主任,1982年12月毕业于浙江大学医学院。英国纽卡斯大学哲学硕士学位。现任北京协和医院心内科教授、主任。卫生部心血管介入诊疗技术培训基地(北京协和医院)主任。中华医学会心血管病分会第七、第八届常委、首批专家会员,中国医师协会心血管医师分会常委,中华医学会北京分会副主任委员,中国生物工程学会心律分会副主任委员,中华心律失常学会委员、中国生物医学工程起搏与电生理分会委员、中华医学会心电生理和起搏专科医师培训中心管理委员会委员。
来源:人民卫生出版社《临床知识》约稿
作者:方全,北京协和医院心内科教授、主任;杨德彦
编辑:环球医学资讯贾朝娟
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号



 会员登录
会员登录

