【遏制细菌耐药白皮书】严静教授:耐药菌感染与抗菌药物合理使用的研究进展
浙江医院
严静 胡伟航 毛文超 朱玫
2021年一项涉及到全球24个国家重症医学科(Intensive Care Unit, ICU)的菌血症微生物学的横断面研究显示ICU病房内多重耐药菌(multidrug-resistant organisms, MDROs)的发病率为65.1%,泛耐药菌(Extensively drug-resistant, XDROs)的比例为4.9%。尤其是在发展中国家,耐药菌的比例更高。这其中32.1%的MDROs是肺炎克雷伯菌,55.3%的XDROs是鲍曼不动杆菌[1]。 而无论是发达国家还是发展中国家,耐碳青霉烯类的肠杆菌科已经全球开枝散叶,其中不乏产金属酶的MDR病原菌,这给临床抗感染治疗带来了极大的困难以及巨大的经济负担[2]。 印度的一项回顾性研究显示MDROs感染的患者总死亡率为13.1%,与敏感菌株感染患者相比,MDROs感染的患者死亡率是其2-3倍[3]。因此,面对全球性且日益进展的细菌耐药情况,如何更加合理的使用抗菌药物来遏制耐药菌发展的势头显得尤为关键。
抗菌药物在全世界ICU病房中大量使用,高达70%的ICU患者接受抗菌治疗,估算该人群中抗菌药物的平均消费量为每千个患者日1563个确定的日剂量(defined daily dose,DDD)(95%置信区间1472-1653),这几乎是普通病房患者的三倍,尤其第三代头孢菌素等广谱药物的使用量显著高于普通病房[4, 5]。虽然经验性广覆盖和尽早实施对于治愈社区和医院获得性脓毒症的患者至关重要,但抗菌药物治疗并非总是必需的,超过1/2的患者在未确诊感染的情况下就接受了抗菌药[6, 7],此外,未充分考虑抗菌药物的降阶梯及缩短抗菌药物暴露时间,由此产生的压力选择以及对MDROs交叉感染控制的不完善,使得ICU成为MDROs在医院内传播的重要环节。因此,我们试图总结ICU 中抗菌药物合理使用从而遏制细菌耐药的“四个时刻”,包括耐药风险的评估,更准确诊断工具可用于重症感染的确诊/排除方法;个性化推理选择单一药物或联合经验方案;使用适当的剂量和给药方案以确保达到药物代谢动力学(pharmacokinetics,PK)/药物效应动力学(pharmacodynamics,PD)目标;并对抗菌药物初始治疗进行重新评估,以通过降阶梯和缩短治疗时间来最大程度地减少对微生态系统的损害。
一、是否需要抗感染治疗
(一)目前ICU抗菌治疗存在的问题和弊端
1. 抗菌药物过度使用(未明确感染情况下开始使用抗菌药物)
现有证据支持及早使用抗菌药物对脓毒症和脓毒症休克患者生存有利,但也存在局限性:(1)对于有多个并发疾病过程的危重患者,脓毒症的临床诊断极具挑战性,高达50%的发热是非感染性发热[8],例如几种情况可能会出现胸部影像学改变导致误认为是肺部感染,包括吸入性肺炎、肺不张、充血性心力衰竭、肺栓塞或病毒感染,而抗菌药物的使用并不能使这些患者获益,反而会增加不良反应和产生抗菌药物耐药性。因此在面对孤立性发热的情况时,不要单纯考虑感染的因素,更需要考虑的是发热是否为非感染因素的过程。同时,ICU内大部分培养到的细菌可能是处于定植状态,如肺部、口咽部、尿路等,定植状态下的细菌并不是使用抗菌药物的指征。无症状性菌尿并不需要使用抗菌药物,大部分为定植的细菌,除非出现明显的症状或影响到全身情况,否则对于无症状菌尿的处理只会增加尿路耐药菌产生的可能性。(2)临床认为感染的患者中,实际上30~80%的培养是阴性[9, 10]。这一部分患者感染的病原体很有可能为不可培养的病原体,如病毒、寄生虫和某些的真菌,而大部分情况下抗菌药物并不能起到消灭这部分病原菌的作用。另一方面可能受限于现有培养方法,传统的微生物学方法通常无法成功识别致病微生物。使用聚合酶链反应 (polymerase chain reaction, PCR)可以在脓毒症患者的血液中快速检测到微生物脱氧核糖核酸(deoxyribonucleic acid, DNA),并且可以检测到未从血培养中检索到的潜在重要真菌和细菌[11]。同时有研究表明PCR检测阳性率比血培养高约两倍,而且可以做到6-8小时内提供微生物结果,相比较于传统培养方法,PCR大大提高了效率,避免了不必要的抗菌药物使用。因此目前临床上基于PCR方法的二代测序(Next-Generation Sequencing,NGS)方法可以为临床抗菌药物的使用提供更快更准确的依据[12]。(3)入住ICU的肺炎病例中,多达三分之一是病毒感染[13]。在近两年流行的新冠肺炎患者当中,依据经验,这些ICU患者绝大多数使用了抗菌药物,但大部分患者的疾病早期并没有细菌或真菌感染的依据,单纯表现为病毒性肺炎,抗菌药物的使用并不会改善患者的结局,而只会筛选出耐药菌株。但在疾病中后程,由于淋巴细胞消耗,免疫功能低下,屏障功能破坏等因素可合并细菌或真菌感染。因此,对于病毒性肺炎,在没有合并其他病原菌感染的情况下,并不推荐抗菌药物的使用,这同样适用于其他病毒导致的肺炎[14]。
2. 抗菌药物使用后微生物发生变化包括:(1)正常倍增:抗菌药物的暴露消灭了感染部位的敏感菌群,而对所用抗菌物具有“内在或获得抵抗力”的病原体过度生长,如抗菌药物使用后非发酵革兰氏阴性菌“外排泵”的过表达,单药暴露后就选择出了MDR突变体[15];(2)肠道菌群紊乱:在抗菌药物全身暴露期间,胆汁中抗菌药物排入胃肠道 (gastrointestinal tract ,GIT)对肠道微生物群有破坏性影响,包括微生物多样性的丧失和微生物的选择,如艰难梭菌和念珠菌,反过来会导致继发性感染[16]。此外,即使只有 1~3天的短暂抗菌药物暴露,GIT中耐药病原体(无论是内在的还是后天的)也容易过度生长[7]。
(二)何时开始抗感染治疗?
1. 寻找诊断感染的方法和评分
已发表的数据表明,快速序贯器官衰竭评估 (quick Sequential Organ Failure Assessment,qSOFA)评分和全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)诊断标准等缺乏早期识别脓毒症的特异性[17]。旨在减少疑似感染患者抗菌药物使用的目标没有实现,临床上疑似脓毒症低门槛的经验性抗菌药物处方依然是主流。诊断脓毒症最合适的方法和评分还在探索中。
2. 生物标志物识别需要抗感染的患者
生物标志物可能有助于识别/排除细菌感染,目的减少不必要的抗菌药物的应用:(1)降钙素原(Procalcitonin,PCT)在细菌性脓毒症中升高明显,而在病毒感染和大多数非感染性患者中不高。据此原因在ICU患者中推广使用基于PCT启动抗菌药物治疗(或逐步升级),但结果既没有减少总体抗菌药物的消耗,也没缩短充分疗程或改善治疗效果[18]。因此,PCT目前不推荐作为ICU患者抗菌药物启动决策过程的指标;(2)大量研究已经评估了许多细胞因子,如细胞表面标志物,可溶性受体,补体因子,凝血因子和急性期反应因子用于脓毒症的诊断,但大部分因子的脓毒症鉴别力不高[19];(3)考虑到宿主反应和生物标志物动力学的复杂性,Mearelli F团队[20]设计一项多中心前瞻性研究,基于生物标志物(PCT、可溶性磷脂酶A2 、可溶性CD14亚型 Presepsin 、可溶性白细胞介素2受体α和髓样细胞18表达的可溶性触发受体)和临床指标(年龄、序贯器官衰竭评估评分、最近的抗菌治疗、发热、白细胞增多和C反应蛋白值)的联合算法(诊断模型)用于急诊区分细菌性脓毒症和非感染性SIRS,证实具有高敏感性的特点(阴性预测值为 93%)。基于人工智能鉴别脓毒症的联合算法可能是今后临床研究和转化医学的热点。目前这类算法敏感性虽高,但次优的特异性限制了临床的应用,多用于排除诊断。相反,临床样本中病原体的快速新型分子测定法显示出良好的特异性,是目前临床医师决定启用、停用或推迟抗菌治疗比较信赖的手段之一。
3. 快速新型分子测定感染病原菌及耐药情况
早期微生物学诊断,与传统培养方法周期长(>48h)相比,分子诊断加快了这一进程。常用的方法包括:(1)聚合酶链式反应(polymerase chain reaction,PCR)[21]:利用PCR面板对多种病原体进行监测。1)优点:比传统方法(即1.5-6小时)更快地识别病原体;2)缺点:①昂贵(每次测试>100美元);②必须与传统培养物一起进行,因为它们不能完全替代;③只能提供部分药敏信息,因为只筛选了有限数量的获得性耐药基因(例如,那些编码超广谱β-内酰胺酶或碳青霉烯酶的基因);④需要进一步的调查来充分评估它们对患者预后的潜在影响。(2)宏基因组学[22]:直接对核酸进行基因测序,以鉴定所有细菌病原体及其耐药性。1)优点:快速测序如纳米孔只需6-8小时的周转时间;这种方法还可以通过对逆转录RNA进行测序来评估感染部位的宿主反应,可能会提高其诊断率。2)缺点:对核酸提取率、抗菌药物敏感性推断以及将结果转化为可行的数据方面仍有待提高,通量偏低、价格高、准确度偏低的缺点也严重限制了它的应用场景。
4. 早期控制感染源对于抗感染的重要性
决定预后的一个主要因素是早期感染源控制,特别是对于脓毒症休克患者,这似乎比早期充分的抗菌治疗更为重要[23]。这需要重症医生、外科医生、放射科医生和其他同事的多学科合作。源头控制遵循引流,清创,去除器械,减压的原则;感染源头控制的效力是时间依赖性的,因此应尽快执行适当的程序。
由于无法获得能够可靠的区分需要抗菌药物和不需要抗菌药物的快速床旁检测,ICU医生对可疑感染患者常常根据经验在大多数患者中使用了抗菌药物[24]。然而一项有启发性的队列研究表明,积极经验性使用抗菌药物可能对该人群不一定有益[25]。实际上,保守的方法(只有在确诊感染后才开始使用抗菌药物)与早期积极的经验治疗相比,可降低50%以上的死亡率,并使得治疗时间更短。因此,Timsit 和Denny 等[6, 7]人提出了ICU 患者“何时不开始使用抗菌药物”的观点,与“何时开始使用抗菌药物”的原则相反,“推迟”对一部分疑似脓毒症的危重病人进行抗菌药物治疗,以减少ICU中抗菌药物的用量,减少耐药菌产生。
简而言之,使用抗菌药物的决定应该包括:对耐药性风险的评估,这需要综合患者层面的数据和环境因素;在敏感性数据可用之前,考虑是否在某些疑似脓毒症患者中延迟使用抗菌药物。
二、初始抗感染治疗抗菌药物的选择
美国一项大型队列研究证实对非耐药菌感染的社区获得性脓毒症患者使用广谱抗菌药物,与较差的预后有关。接受过度治疗的患者耐药菌感染率增加,死亡率增加20%[26]。这与先前的报道一致,更积极的抗菌药物治疗可能与危重病人的高死亡率相关[27]。由于这些原因,决定初始选择哪种抗菌药物,是否需要联合用药,需要考虑许多因素。
(一)了解ICU的微生物流行病学特征
虽然大多数入住ICU的感染是由社区获得性敏感菌引起的,但非常有必要了解每个ICU环境中的主要致病菌、掌握最新的ICU特异性病原体和耐药情况,以及本地区的细菌流行病学情况,可增加开出合适初始抗菌药物处方的可能性[28]。这也适用于需要抗菌药物联合治疗病例,尤其适用于难治的MDR病原体引起的医院相关感染[29]。通过积极的监测ICU微生物流行病学特征不仅可以实现经验性的抗菌药物选择和指南制定,还可为控制院感提供信息。
(二)多重耐药菌感染危险因素的评估
抗菌药物、宿主和微生物三者间存在着复杂的相互作用,影响着MDROs感染、定值的可能。某些危险因素易诱导细菌耐药、有利MDROs定值。这些因素往往是相似的,一般可分为患者特定因素(如高龄、合并症、免疫抑制、营养不良)、流行病学决定因素(如既往或长期住院、常住老年护理院、长期透析)、抗菌药物暴露(如多疗程或特定类别高诱导抗菌药物)、既往定植(如肠道或气道内)和体内留置装置(如导尿管、深静脉导管、透析导管)[30]。甄别MDROs感染高危因素的价值是在细菌培养+药敏试验结果之前为临床医生提供经验性抗菌药物治疗指导。
(三)免疫状态的影响
ICU中初始抗菌药物治疗的选择,宿主免疫状态是关键因素之一。1.器官移植群体[31]:接受免疫抑制药物预防和治疗移植排斥反应,是发生条件致病菌感染和感染性休克的高危人群;2.接受化疗的癌症人群/中性粒细胞减少症患者[32]:中性粒细胞减少的持续时间和水平是选择经验性抗感染治疗的必要因素;3.HIV感染者:不仅易患社区获得性感染,而且易遭受依赖CD4细胞计数的机会性感染;4.其他[33]:包括免疫球蛋白缺陷和医源性免疫抑制。由于免疫功能低下的患者可能有多种免疫功能失调途径,因此可能会合并多种机会性感染(细菌和/或病毒和/或真菌),因此初始治疗往往需要联合几种抗菌药物作为经验性治疗的一部分。
(四)评估感染与定植风险
MDROs的存在是初始抗菌药物治疗失败的重要危险因素。因此,如何准确预测哪些ICU患者更具有定植或感染MDROs的风险,以及根据什么选择有效的经验性抗菌药物是当前ICU热门话题。Burillo等人[30]最近发表了一份较全面的MDROs定植或感染风险分层的预测评分清单。清单首先根据MDROs定植易感性对患者进行分类,其次是根据发展为严重感染的风险分类,第三是根据预后不佳的风险分类。风险因素的分层已经越来越流行,许多人认为预测评分对抗菌药物初始选择至关重要。然而临床实践中,这类的预测评分显示出不同的准确性,基于分层评分初始选择假定MDROs感染的经验性广谱抗菌药物时,作为“排除”决策工具可能比“纳入”决策工具有更好效果。目前临床上可能只有病情轻/中度、没有特定危险因素(如长期住院、免疫抑制、近期长期使用抗菌药物或这些因素的组合等)的早期感染患者,比较确认应该接受经验性窄谱抗菌药物治疗[34]。
定植明显增加了MDROs的风险。然而,这种风险的阳性预测值从不超过50%[35]。例如,仅10%至25%的ESBL-E携带者,在ICU救治期间发生ESBL-E感染[36]。
常规的联合治疗不太可能预防细菌耐药性的出现或改善患者的预后,一般应避免经验性联合用药,特别是在病情不严重或没有感染性休克的情况下。在做出联合用药的决定时,考虑添加第二种药物是否能改善抗菌谱而没有因暴露增加细菌耐药性。根据我国2015版《抗菌药物临床应用指导原则》,仅在以下情况时有指征联合用药:1.病原菌尚未查明的严重感染,包括免疫缺陷者的严重感染。2.单一抗菌药物不能控制的严重感染,需氧菌及厌氧菌混合感染,2种及2种以上复数菌感染,以及多重耐药菌或泛耐药菌感染。3.需长疗程治疗,但病原菌易对某些抗菌药物产生耐药性的感染,如某些侵袭性真菌病;或病原菌含有不同生长特点的菌群,需要应用不同抗菌机制的药物联合使用,如结核和非结核分枝杆菌。4.毒性较大的抗菌药物,联合用药时剂量可适当减少,但需有临床资料证明其同样有效。联合用药时宜选用具有协同或相加作用的药物联合。联合用药通常采用2种药物联合,3种及 3 种以上药物联合仅适用于个别情况,如结核病的治疗。此外必须注意联合用药后药物不良反应亦可能增多。
简而言之,在MDROs的分层评分得到改进和外部验证及判定工具具有临床意义的临界阈值之前,关于选用哪种经验性抗菌药物/是否联合用药的决定还应依赖于疾病的抗菌谱和机构指南。
三、优化抗菌药物给药剂量
(一)优化PK/PD基本概述
面对抗菌药耐药率高的问题,2015年美国公布了《抗击耐药细菌国家行动计划》。这份计划共有5个方面,而第一项即为提高抗菌药物的合理应用水平。对于抗菌药物的合理应用,尤其是对于重症患者,通过优化抗菌药物的PK/PD来更加合理的使用抗菌药物显得尤为重要。国际拯救脓毒症运动指南推荐通过优化PK/PD来优化抗菌药物给药方案。2016年美国感染性疾病学会/美国胸科协会联合发布的医院获得性肺炎与呼吸机相关性肺炎指南中也推荐抗菌药物应该根据PK/PD给药,而不应该仅根据说明书给药[37]。因此基于抗菌药物PK/PD理论优化抗菌药物方案,可使抗菌药物在人体内,达到最大杀菌活性和最佳临床疗效和安全性,减少细菌耐药性的发生和发展,最大程度改善患者预后同时减少耐药的发生。但在中国境内的一项横断面研究显示ICU医师对于抗菌药物PK/PD知识的掌握情况并不理想,这是今后我们需要努力改进的方向[38]。
(二)根据抗菌药物PK/PD特点进行抗菌药物分类
PK的主要评价指标包括药峰浓度(Peak Concentration,Cmax)、药物浓度-时间曲线下面积(area under the curve,AUC0~24)、表观分布容积(apparent volume of distribution,Vd)、清除半衰期(elimination half-time,T1/2)以及清除率(clearance,CL)等。PD主要通过体外药敏试验确定,常用评价指标包括最低抑菌浓度(minimum inhibitory concentration,MIC)、最低杀菌浓度(minimum bactericidal concentration,MBC)、抗菌药物后效应(post-antibiotic effects,PAE)、防耐药突变浓度(mutation preventive concentration,MPC)等。临床上最常用评价抗菌药与病原菌之间关系与抗菌效果的指标主要包括:1. Cmax/MIC:血药峰浓度与最低抑菌浓度的比值。2. AUC0~24/MIC:药物浓度-时间曲线下面积与最低抑菌浓度的比值。3. %fT>MIC:游离药物的血药浓度大于最低抑菌浓度的时间所占百分比。
根据抗菌药物PK/PD特性,目前抗菌药物主要分为以下三类:1时间依赖性抗菌药物:代表药物为β-内酰胺类,这类抗菌药物在血药浓度达4-5倍MIC值后抗菌效果即达到饱和,增加剂量不会提高其疗效,而取决于药物与病原菌的接触时间,即%fT>MIC,这类药物推荐日剂量多次给药、延长输注时间。2浓度依耐性抗菌药物:代表药物有氨基糖苷类、喹诺酮类、达托霉素、多粘菌素、棘白菌素类等,抗菌活性取决于血药峰浓度,一般要求Cmax/MIC≥8-10。此类抗菌药物推荐日剂量单次给药。3时间依赖性且抗菌作用时间较长:此类抗菌药物为时间依赖性抗菌药物,但具有较长时间的PAE,且PAE与血药浓度有关,表现出一定的“浓度依赖性”,如替加环素、万古霉素等,其抗菌活性主要取决于AUC/MIC,此类抗菌药物可通过延长输注时间或增加单次给药剂量来提高疗效。
根据抗菌药物的理化性质,抗菌药物可分为脂溶性和水溶性两大类。水溶性抗菌药物如ß-内酰胺类、氨基糖苷类、糖肽类等,主要分布在血液循环中,Vd相对较小,主要通过肾脏排泄。而氟喹诺酮类、利奈唑胺类、大环内酯类、伏立康唑类、两性霉素B及其脂质体等脂溶性抗菌药物,Vd较大,主要分布在棕色脂肪组织,而血液循环中分布较少,这类药物主要在肝脏代谢。
(三)影响重症患者PK/PD的因素
重症患者由于一系列病理生理学变化,如毛细血管渗漏、液体复苏、血管活性药物、肝肾功能不全、低蛋白血症等,以及脏器支持手段如体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)、连续性肾脏替代治疗(continuous renal replacement theraphy,CRRT)、呼吸机等的使用,抗菌药物的PK常发生巨大的变化,且随着患者病理生理学的改变出现动态波动,因此了解重症患者PK/PD变化对于抗菌药物合理用药有着重要作用。
1. 重症患者Vd变化
重症患者抗菌药物Vd变化主要考虑对水溶性抗菌药物的影响,脂溶性抗菌药物主要分布在组织器官中,一般Vd变化不大。毛细血管渗漏、液体复苏、低白蛋白血症、ECMO及CRRT回路的影响等均可导致抗菌药物Vd增大,进而导致血浆有效浓度不足,影响抗菌药物疗效。既往的一些研究也证实了抗菌药物在重症感染患者当中Vd的增大[39]。
2. 重症患者药物血浆蛋白结合率(protein binding,PB)变化
抗菌药物的分布主要取决于PB和Vd,40%~50%脓毒症患者合并低蛋白血症,低蛋白血症常影响PB较高的抗菌药物疗效[40]。低蛋白血症对PB较低的抗菌药物影响不大,而对于PB较高的抗菌药物,低蛋白血症时游离药物浓度明显升高,经肝肾清除增加,以及更大的分布在组织当中,Vd增大,血浆有效浓度不足,从而导致疗效不佳。
3. 肾脏清除率的变化
(1)肾脏清除增强(Augmented Renal Clearance,ARC):ARC定义为肌酐清除率(creatinine clearance,CrCL)>130 ml/min,可见于18%~40%的脓毒症患者。ARC与治疗浓度相关,常导致治疗失败及耐药,这主要影响水溶性、经肾脏排泄的抗菌药物。先前有研究表明脓毒性休克患者肌酐CL从83.9 mL/min增加至174.0 mL/min,哌拉西林CL增加了79.5%,靶组织药物浓度显著降低[41]。也有研究表明在治疗性药物浓度监测(therapeutic drug monitoring,TDM)的指导下大约19%的患者出现哌拉西林/他唑巴坦浓度暴露不足,而这些患者均存在ARC[42]。
(2)肾功能不全:重症患者常合并肾功能不全,部分患者存在基础慢性肾脏病,有报道表明脓毒症患者常合并急性肾损伤(acute kidney injury,AKI),发病率高达40%~50%[43]。AKI导致肾小球滤过率下降,大部分经肾排泄的抗菌药物,如氨基糖苷类、糖肽类等清除减少,引起血药浓度升高以及代谢产物蓄积,增加药物毒性以及不良反应,需要根据肾小球滤过率调整给药方案。而对于经肝脏代谢排泄的抗菌药物,如替加环素、大环内酯类等,肾功能不全时此类药物的排泄变化不大,无需调整给药方案。
(3)肾脏替代治疗:约20%的脓毒症患者需要接受肾脏替代治疗(renal replacement theraphy,RRT)。水溶性、PB较低、经肾脏排泄、相对分子质量较小的抗菌药物在RRT时清除较多,需要调整给药剂量,而脂溶性抗菌药物一般不受RRT影响,不需要调整给药剂量及频次。RRT过程中随着肾功能的恢复,总体的肌酐CL无法估算,使得抗菌药物的剂量调整显得更为复杂,而此时TDM指导下抗菌药物剂量调整显得尤为重要。总的来说,接受CRRT的患者有治疗浓度暴露的风险,TDM可能是合理给药的理想选择。
4. 肝功能不全
重症患者常合并肝功能不全,肝功能对PK的影响取决于药物的化学性质、血浆蛋白质结合率和摄取率等。肝功能不全对于经肾脏排泄的抗菌药物影响不大,而对于主要经肝脏排泄以及脂溶性药物,如头孢哌酮、卡泊芬净等,由于胆汁排泄、肝血流量、肝脏代谢酶、低蛋白血症等影响,抗菌药物清除排泄明显减少,易导致药物蓄积产生毒性反应,需要调整药物剂量及给药方式[44]。
5. 心力衰竭及心源性休克
急性心力衰竭(acute heart failure,AHF)和心源性休克通过血流动力学影响其他器官灌注,通常情况下这类患者心排量(cardiac output,CO)下降,导致组织低灌注,引起肝肾等其他脏器功能不全,从而影响抗菌药物的清除率,导致药物半衰期变化。另一方面,AHF和心源性休克患者通常存在液体过负荷,表现为肺水肿、脏器淤血、外周水肿及第三间隙积液等,这些均可导致抗菌药物Vd增大,尤其是水溶性、低PB抗菌药物,需要进行药物剂量调整。
6. 脏器支持手段
(1)ECMO:ECMO由于管路预充、体外循环的建立,常导致抗菌药物PK发生变化,尤其是水溶性、低PB抗菌药物,Vd往往会明显增大,常规剂量往往不能达到有效血药浓度。同时,由于ECMO回路对药物的吸附作用,主要与膜材和药物本身的性质有关,这对脂溶性、高PB抗菌药物影响较大,如抗真菌药棘白菌素类、伏立康唑等,而对水溶性药物吸附较少。管路的吸附作用使得有效血药浓度下降,需要调整给药剂量。
(2)治疗性血浆置换(therapeutic plasma exchange,TPE):TPE对于抗菌药物的PK影响主要与抗菌药物自身特性以及TPE的进程相关。TPE期间,对Vd较小、PB较高的抗菌药物清除较多。同时TPE的持续时间、置换总量和置换频次均可影响抗菌药物的清除总量。置换时间越长,置换频次越多,置换总量越大,药物清除越多。另外,开始给药的时间与TPE开始时间的间隔也影响药物的清除,间隔越短,药物在体内尚未完全分布到血管外组织就被清除出体外,药物浓度明显降低。
7. MIC值的增加
随着耐药菌的增加,ICU中病原体的MIC值趋于逐渐升高。MIC的增加降低了达到抗菌PK/PD目标的可能性,因此目前常规的给药方案很可能会导致临床治疗失败。我们可以通过延长输注时间,增加给药剂量等方式来达到目标PK/PD靶值。因此在耐药菌检出率高的机构、长期使用广谱抗菌剂的患者可能需要高于标准剂量的抗菌药物剂量。
(四)抗菌药物给药剂量的调整
抗菌药物的给药主要分为负荷剂量及维持剂量。
负荷剂量取决于Vd。对于水溶性、PB较高、Vd较小的抗菌药物,重症患者Vd常明显增大,需要增加负荷剂量。同时,CRRT期间水溶性抗菌药物清除增多,也需要增加负荷剂量。对于脂溶性抗菌药物,脓毒症对其Vd影响不大,一般不需要增加负荷剂量,但在ECMO治疗期间,由于管路吸附,常规剂量往往达不到治疗浓度,需要增加负荷剂量。高PB抗菌药物也需要调整负荷剂量,如替加环素PB高达71%~89%,脓毒症患者替加环素的Vd明显增大,往往需要增加负荷剂量才能达到预期疗效。
维持剂量取决于CL。对于时间依赖性抗菌药物,抗菌活性主要取决于%fT>MIC,原则是改变给药剂量而不改变给药频次,必要时可适当增加给药频次,延长输注时间;而浓度依赖性抗菌药物抗菌效果取决于Cmax,原则是不改变给药剂量而改变给药间隔,先计算T1/2(T1/2=0.693×Vd/CL),根据T1/2推算给药间隔[45]。但是并非所有抗菌药物都需要调整维持剂量,主要取决于抗菌药物的药物特性、代谢途径以及器官功能状态。脓毒症对脂溶性药物的Vd影响较小,无需调整药物剂量;低蛋白血症对低PB药物影响较小,无需调整药物剂量;肝功能不全时,经肾代谢的抗菌药物无需调整剂量;而肾功能不全时,经肝代谢抗菌药物无需调整剂量。ECMO治疗期间,脂溶性抗菌药物需要增加维持剂量;TPE期间,高PB、水溶性抗菌药物需要增加维持剂量,同时与TPE间隔至少3 h给药;CRRT期间,水溶性抗菌药物清除较多,也需要增加维持剂量来保证足够的血药浓度。
(五)ICU抗菌药物PK/PD目标靶值
%fT>MIC是预测时间依赖性抗菌药物生物学疗效PK/PD目标靶值的指标。研究证明要取得良好的抗菌效果,碳青霉烯类的%fT>MIC期望值应达到40%~50%,而最近的研究表明100%T>MIC 甚至100%T>4-8×MIC的PK/PD靶值更适用于重症患者[46]。在一项包含8种β-内酰胺类抗菌药物的大型多中心研究中发现,与50%fT>MIC相比,100%fT>MIC与改善ICU脓毒症患者的临床结局相关(OR=1.56,95% CI [1.15~2.13] vs.1.02[1.01~1.04],p<0.03)[47]。ICU中β-内酰胺类抗菌药物50%fT>MIC只保障最低杀菌效果,实现临床疗效的最小靶值必须100%fT>MIC ,最大限度地提高危重症患者的细菌学和临床效应是100%T>4-8×MIC,同时避免筛选出耐药菌[48, 49]。
浓度依赖性抗菌药物的抗菌活性主要取决于Cmax/MIC或AUC0~24/MIC,一般要求PK/PD目标靶值(Cmax/MIC≥8-10)。
依据PK/PD目标靶值对ICU使用抗菌药物(常规剂量和用法)针对目标菌株的效果进行临床评估。Kothekar等[50]的研究表明,对脓毒症患者输注美罗培南1 g、1次/8 h (延长输注3 h),在第1天和第3天分别有33.3%和39.1%的患者未能达到目标靶值(100%fT> 4 µg/mL>40%)(见表1)。近期有研究显示,对脓毒性休克患者给予阿米卡星25 mg/kg静脉输注,76%的患者达到了Cmax/MIC>8的目标值,而给予15 mg/kg阿米卡星的患者仅有40%达到了目标值(见图1)[51]。达托霉素的Cmax/MIC和AUC 0~24/MIC目标要求至少分别为60和666,常规推荐4~6 mg/kg,1次/日。Urakami等[52]的研究显示,达托霉素对耐甲氧西林金黄色葡萄球菌(methicillin resistant staphylococcus aureus,MRSA)的MIC值无论为1.0 mg/L还是0.5mg/L,给予4~6 mg/kg的治疗量时均有较多患者未能达到目标靶值。而给予10 mg/kg达托霉素治疗MRSA实现目标靶值均为100%(见图2)。为保证临床疗效、减少细菌耐药,ICU医生需要床旁工具来调整给药方案,实现重症感染的PK/PD优化。
表1 美罗培南1000 mg,1次/8h,延长输注3h达标情况
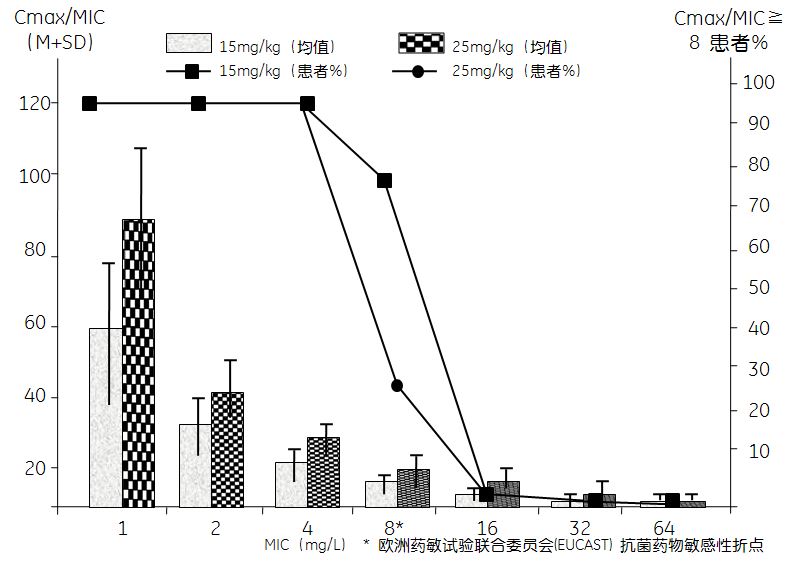
图1 阿米卡星25mg / kg剂量组和15mg / kg剂量组PK/PD达标情况

图2 不同剂量达托霉素方案的目标达成概率(PTA)
(六)重症患者基于PK/PD 模型的蒙特卡洛模拟(Monte Carlo Simulation,MCS)
MCS是一种统计分析方法,对单一或混合因素进行模拟,求解概率问题方法。是基于人工创造一个随机事件或“实验”(通常是通过计算机 )的分析方法,当运行到指定的次数,可以获得任何特定目标的概率。1998年,美国抗菌药物研究专家 Dr.Drusano GL首先将MCS引入了抗菌药物领域,用于确定合适给药剂量;确定临床相关的敏感性折点;确定不同给药方案的临床意义(如改变给药间隔,改变输液时间等);比较不同抗菌药物对某一细菌的杀菌效果等[53]。
MCS需要的数据包括PK(Vd、CL、PB等)和PD(MIC等)。由于患者的PK参数很难获得,因此通常采用健康志愿者的PK。MCS的结果一般表达为对特定MIC的目标获得概率(probability of target attainment PTA)或对MIC群体达到某一目标累积反应分数(cumulative fraction of response CFR),PTA和 CFR均是概率数。MCS通过比较 PTA或 CFR的大小,能达到最高 PTA或 CFR(>90%)的抗菌药物给药方案可能是抗菌药物经验治疗的最佳选择,因为它能提供最大可能的杀菌效果[54]。
MCS通常采用的是 Crystal Ball Software软件,具体步骤是:
1. 目标细菌的MIC值;
2. 给药方案和健康志愿者PK参数,包括Cmax、AUC0~24、Vd、T1/2、CL等;
3. PK/PD模型:对致病菌的杀菌作用PK/PD参数主要取决于%fT>MIC、Cmax/MIC或AUC0~24/MIC;
4. MCS:采用Crystal Ball Software软件进行10000次MCS,计算每种给药方案-病原菌-健康志愿者(患者)组合的PK/PD模型的估计值。获得模拟给药方案-病原微生物(ICU满意的临床疗效靶值/有效预防ICU细菌耐药的靶值)的CFR或PTA值。
按静脉滴注一室模型,时间依赖型抗菌药物的PK/PD 模型参数%fT>MIC 计算公式如下: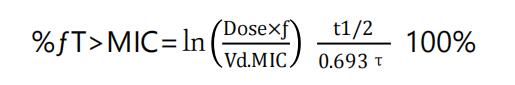
其中,Dose 为给药剂量;f 为游离药物分数 ( f=1-PB);Vd 为表观分布容积;t1/2 为生物半衰期;τ为给药间隔。
浓度依赖型抗菌药物PK/PD 模型参数AUC/MIC 的计算如下:
AUC24 h = Dose /CL, AUC /MIC=(Dose /CL)/MIC
其中, Dose是24 h 给药剂量( mg ); CL是血浆清除率( L. h-1 ) ; MIC是最低抑菌浓度( mg. L-1 ) 。
Sun等[55]通过10000人次的MCS抗菌药物(美罗培南、亚胺培南-西司他丁、头孢他啶、头孢吡肟、哌拉西林/他唑巴坦和环丙沙星)经验性治疗三个医院获得性肺炎模型常见病原体的流行情况(见表2),然后进行药效学分析。目标病原体的MIC值来源于2003 年美国 MYSTIC 数据库。杀菌目标定义为碳青霉烯类的 40% T>MIC,其他β-内酰胺类为50% T>MIC,以及环丙沙星的AUC/MIC为125。使用两种PK/PD模型进行敏感性分析,以确定针对目标病原体不同给药方案目标实现的估算。最终结论:美罗培南、亚胺培南、头孢吡肟、头孢他啶(1次/ 8 、h 2 g)和哌拉西林/他唑巴坦在没有MRSA感染的情况下用于经验性治疗医院获得性肺炎时,获得足够药效学的可能性很高。 1次/ 8 h、 1 g头孢他啶和环丙沙星的PTA较低,经验治疗时需考虑联合用药(见表3)。
表2 三个院内获得性肺炎模型最常见病原体的流行情况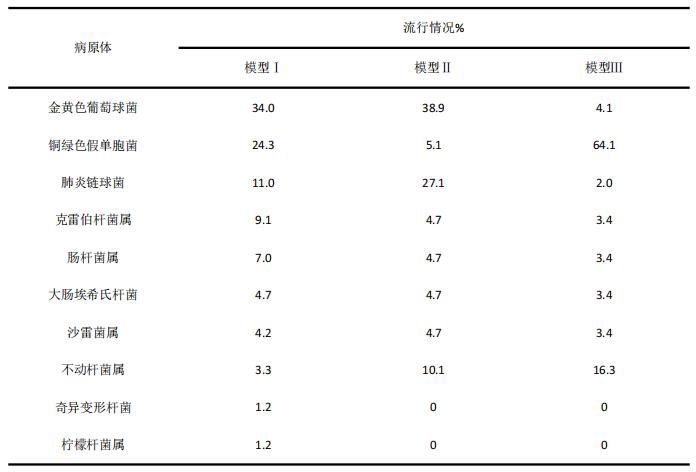
表3 MCS抗菌药物(美罗培南、亚胺培南-西司他丁、头孢他啶、头孢吡肟、哌拉西林/他唑巴坦和环丙沙星)PTA(95%置信区间)

(七)TDM指导个体化给药
基于PK/PD模型的MCS为重症感染选取最佳方案提供了床旁工具,但抗菌药物精准方案还有赖于TDM。在通过体外药敏试验明确病原菌的MIC的情况下,TDM是通过监测血药浓度的变化并结合PK/PD目标靶值进行给药方案的调整。基于TDM的抗菌药物给药方案的调整显著提高了治疗效率,减少了抗菌药物耐药的发生,并降低了脓毒症患者的死亡率。传统上,TDM仅用于治疗窗较窄的药物(例如氨基糖苷类和万古霉素)和具有复杂药代动力学的药物(例如伏立康唑)等抗菌药物的血药浓度监测。而最近一项基于TDM的研究表明,由于急危病人抗菌药物药代动力学发生了显著的变化,在ICU内常规开展抗菌药物TDM对患者是有益的。欧洲重症医学会感染分会和欧洲临床微生物学和传染病学会联合发布的一项立场性文件提出对于β内酰胺类抗菌药物和氨基糖苷类药物应常规开展TDM,而在重症患者当中,利奈唑胺、替考拉宁和万古霉素也需要开展TDM使得给药剂量更加合理。但目前受限于开展TDM的设备,专业的TDM分析人员以及各个医疗机构的经济水平等因素,大部分国内医院不能常规开展抗菌药物TDM,或者仅能对极个别种类抗菌药物进行血药浓度监测,同时TDM具有一定的延后性,很难做到及时反馈、及时调整。因此,未来床边实时动态的TDM监测以及丰富可开展TDM的抗菌药物种类是发挥TDM最大作用的未来发展趋势。
(八)更加精确的靶组织浓度监测
目前的TDM主要集中在血药浓度,而更加精确的TDM应该集中在感染部位的组织浓度,如在肺部感染患者中应该关注肺上皮细胞液的抗菌药物药物浓度,颅内感染更应该集中于脑脊液中的药物浓度监测。当然这也要求我们有更多的给药方式来使得局部药物浓度达标而不增加全身的副作用,先前的研究表明通过雾化吸入多粘菌素,肺上皮衬里液(ELF)中的多粘菌素浓度(9.53~1137 mg/L)显著高于静脉给药后(1.48~28.9 m/L),同时雾化给药后血浆中多粘菌素的浓度(0.15~0.73 mg/L)低于静脉给药后的浓度(0.1~4.7 mg/L)。而对于鞘内注射抗菌药物,这在临床上有着很广泛的应用,但是如何确定合适的注射剂量也是一个临床难题,局部脑脊液的药物浓度监测也是未来发展的趋势。总体来说,局部药物浓度监测肯定是未来发展的趋势,这对于提高靶组织疗效,减少全身副作用具有重要意义。
简而言之,重症患者抗菌药物PK/PD影响因素较多,同时由于不同患者存在异质性,通过PK/PD理论来优化重症患者给药只能在同一个病理生理状态实现同质化给药,在多脏器功能衰竭的情况下很难实现个体化给药。而MCS通过计算PTA和CFR可以实现重症患者理论上最佳的给药方案,但目前存在的问题主要是目前的数据主要来源于健康志愿者,很少有患者的PK/PD参数,这一定程度上限制了MCS的效能(给药方案-病原菌-健康志愿者组合的模拟)。而TDM有望成为今后个体化给药的优选方法,TDM可以通过实时监测血药浓度变化来动态调整药物剂量和给药方式,从而实现个体化给药,更可能达到目标PK/PD靶值。而在抗菌药物精准治疗的未来,局部给药和局部靶组织浓度监测在抗感染治疗中显得更为重要,是我们未来努力的方向。
四 初始抗感染治疗疗效的评估,包括降阶梯或停用的决定
(一)抗菌药物降阶梯
抗菌药物降阶梯策略是在提供有效的抗菌药物治疗的同时最大程度地减少不必要的广谱抗菌药物暴露,从而减少耐药性的发展。实际上,一旦获得药敏结果,就包括了重新评估抗菌治疗。
抗菌药物降阶梯策略目前困境:
1.尚无关于降阶梯策略的明确共识,并且降阶梯的定义不一(例如,更改为更窄抗菌谱或对微生物群的生态影响较小的药物,或停止抗菌药物的组合),缺乏高质量的研究以及没有证据表明降阶梯策略对抗菌素耐药性的影响[56];
2. 降阶梯仅适用于40-50%的细菌感染住院患者,ICU医师在治疗培养阴性脓毒症和/或MDROs携带者的时候也不愿缩小抗菌药物覆盖范围[56];
3. 现有的证据无法证明降阶梯治疗的益处;缺乏有关降阶梯对抗菌药物消费和耐药性产生影响的临床数据[56]。虽然这一策略与某些类抗菌药物的减少使用有关,但没有研究表明它可以减少总体抗菌药物的消耗量,甚至观察到抗菌药物暴露量的增加。
未来,提高ICU医师的信心和对降阶梯的依从性已成为减少抗菌药物使用的基础。鉴于这些不确定性,仍需进一步的研究完善抗菌药物降阶梯治疗策略的理论依据。
(二)抗菌药物有效时间和耐药时间
ICU抗菌药物治疗持续时间应考虑到不同的变量,如疾病的严重程度和临床治疗反应、感染的部位和类型、是否进行了充分的病源控制,以及抗菌谱与PK/PD是否得到优化等。目前的指南建议大多数ICU感染的“疗程”为5-7天,短期抗菌药物治疗已被证明在许多感染中是有效和安全的,包括社区获得性肺炎、呼吸机相关性肺炎、尿路感染、复杂性腹腔内感染,甚至某些类型的脓毒症[57]。除非存在不良的预后指标(如初始临床治疗失败或源头控制失败)。尽管如此,抗菌药物治疗的持续时间往往超过了许多常见感染治疗所需的时间。基于PCT动力学缩短抗菌药物持续时间被证明是安全的,包括脓毒症患者。
减少抗菌药物暴露仍然是抗菌药物管理的关键优先事项。Teshome等人[58]证明,每多接触一天头孢吡肟或哌拉西林/他唑巴坦,铜绿假单胞菌出现多重耐药的风险就增加8%。更值得关注的是,重症患者暴露于抗假单胞菌β-内酰胺类药物,相关的耐药风险的增加似乎并没有表现出“上限效应”,实际上随着累积持续时间的增加而增加。
对初始疗法进行系统的重新评估,以尝试通过抗菌药物降阶梯和缩短治疗时间来最大程度地减少对生态系统的附带损害。
结束语
ICU中关于最佳抗菌药物的日常决策花费了大量的时间和精力,结果仍不佳。最近的一项关于临床决策支持系统影响的系统性回顾和Meta分析表明,系统辅助后,实施恰当的抗菌药物治疗的可能性增加了两倍,还与死亡率的降低(18%)和抗菌药物总使用量、住院时间、治疗时间和费用的减少有关[59]。基于人工智能的临床决策支持系统可以简化抗菌药物的决策,但对耐药性的影响还有待确定。
细菌性脓毒症不佳的预后和当前MDROs的流行都强烈需要推进ICU的抗菌药物管理。今后的研究仍然有必要明确解决这四方面的问题,尤其是快速诊断工具、在获得药敏结果或培养阴性之前的脓毒症患者最佳给药方案、单药治疗还是联合用药、TDM指导个体化治疗、降阶梯策略对细菌耐药的影响等等。ICU耐药菌管理和抗菌药物合理使用我们一直在路上,且任重道远。
参考文献
[1] El-Sokkary R, Uysal S, Erdem H, et al. Profiles of multidrug-resistant organisms among patients with bacteremia in intensive care units: an international ID-IRI survey[J]. Eur J Clin Microbiol Infect Dis, 2021,40(11):2323-2334.
[2] Logan L K, Weinstein R A. The Epidemiology of Carbapenem-Resistant Enterobacteriaceae: The Impact and Evolution of a Global Menace[J]. J Infect Dis, 2017,215(suppl_1):S28-S36.
[3] Gandra S, Tseng K K, Arora A, et al. The Mortality Burden of Multidrug-resistant Pathogens in India: A Retrospective, Observational Study[J]. Clin Infect Dis, 2019,69(4):563-570.
[4] Versporten A, Zarb P, Caniaux I, et al. Antimicrobial consumption and resistance in adult hospital inpatients in 53 countries: results of an internet-based global point prevalence survey[J]. Lancet Glob Health, 2018,6(6):e619-e629.
[5] Bitterman R, Hussein K, Leibovici L, et al. Systematic review of antibiotic consumption in acute care hospitals[J]. Clin Microbiol Infect, 2016,22(6):561-567.
[6] Timsit J F, Bassetti M, Cremer O, et al. Rationalizing antimicrobial therapy in the ICU: a narrative review[J]. Intensive Care Med, 2019,45(2):172-189.
[7] Denny K J, De Waele J, Laupland K B, et al. When not to start antibiotics: avoiding antibiotic overuse in the intensive care unit[J]. Clin Microbiol Infect, 2020,26(1):35-40.
[8] Laupland K B, Zahar J R, Adrie C, et al. Determinants of temperature abnormalities and influence on outcome of critical illness[J]. Crit Care Med, 2012,40(1):145-151.
[9] Lam S W, Bauer S R, Fowler R, et al. Systematic Review and Meta-Analysis of Procalcitonin-Guidance Versus Usual Care for Antimicrobial Management in Critically Ill Patients: Focus on Subgroups Based on Antibiotic Initiation, Cessation, or Mixed Strategies[J]. Crit Care Med, 2018,46(5):684-690.
[10] Schuetz P, Wirz Y, Sager R, et al. Effect of procalcitonin-guided antibiotic treatment on mortality in acute respiratory infections: a patient level meta-analysis[J]. Lancet Infect Dis, 2018,18(1):95-107.
[11] Li Y, Guo J, Yang H, et al. Comparison of culture-negative and culture-positive sepsis or septic shock: a systematic review and meta-analysis[J]. Crit Care, 2021,25(1):167.
[12] Bloos F, Sachse S, Kortgen A, et al. Evaluation of a polymerase chain reaction assay for pathogen detection in septic patients under routine condition: an observational study[J]. PLoS One, 2012,7(9):e46003.
[13] van Someren G F, Juffermans N P, Bos L, et al. Respiratory Viruses in Invasively Ventilated Critically Ill Patients-A Prospective Multicenter Observational Study[J]. Crit Care Med, 2018,46(1):29-36.
[14] Pandey M, May A, Tan L, et al. Comparative incidence of early and late bloodstream and respiratory tract co-infection in patients admitted to ICU with COVID-19 pneumonia versus Influenza A or B pneumonia versus no viral pneumonia: wales multicentre ICU cohort study[J]. Crit Care, 2022,26(1):158.
[15] Ruppe E, Woerther P L, Barbier F. Mechanisms of antimicrobial resistance in Gram-negative bacilli[J]. Ann Intensive Care, 2015,5(1):61.
[16] Woerther P L, Lepeule R, Burdet C, et al. Carbapenems and alternative beta-lactams for the treatment of infections due to extended-spectrum beta-lactamase-producing Enterobacteriaceae: What impact on intestinal colonisation resistance?[J]. Int J Antimicrob Agents, 2018,52(6):762-770.
[17] Williams J M, Greenslade J H, McKenzie J V, et al. Systemic Inflammatory Response Syndrome, Quick Sequential Organ Function Assessment, and Organ Dysfunction: Insights From a Prospective Database of ED Patients With Infection[J]. Chest, 2017,151(3):586-596.
[18] Layios N, Lambermont B, Canivet J L, et al. Procalcitonin usefulness for the initiation of antibiotic treatment in intensive care unit patients[J]. Crit Care Med, 2012,40(8):2304-2309.
[19] Parlato M, Philippart F, Rouquette A, et al. Circulating biomarkers may be unable to detect infection at the early phase of sepsis in ICU patients: the CAPTAIN prospective multicenter cohort study[J]. Intensive Care Med, 2018,44(7):1061-1070.
[20] Mearelli F, Fiotti N, Giansante C, et al. Derivation and Validation of a Biomarker-Based Clinical Algorithm to Rule Out Sepsis From Noninfectious Systemic Inflammatory Response Syndrome at Emergency Department Admission: A Multicenter Prospective Study[J]. Crit Care Med, 2018,46(9):1421-1429.
[21] van de Groep K, Bos M P, Savelkoul P, et al. Development and first evaluation of a novel multiplex real-time PCR on whole blood samples for rapid pathogen identification in critically ill patients with sepsis[J]. Eur J Clin Microbiol Infect Dis, 2018,37(7):1333-1344.
[22] Pendleton K M, Erb-Downward J R, Bao Y, et al. Rapid Pathogen Identification in Bacterial Pneumonia Using Real-Time Metagenomics[J]. Am J Respir Crit Care Med, 2017,196(12):1610-1612.
[23] Martinez M L, Ferrer R, Torrents E, et al. Impact of Source Control in Patients With Severe Sepsis and Septic Shock[J]. Crit Care Med, 2017,45(1):11-19.
[24] Klein K P, Cremer O L, van Vught L A, et al. Likelihood of infection in patients with presumed sepsis at the time of intensive care unit admission: a cohort study[J]. Crit Care, 2015,19:319.
[25] Hranjec T, Rosenberger L H, Swenson B, et al. Aggressive versus conservative initiation of antimicrobial treatment in critically ill surgical patients with suspected intensive-care-unit-acquired infection: a quasi-experimental, before and after observational cohort study[J]. Lancet Infect Dis, 2012,12(10):774-780.
[26] Rhee C, Kadri S S, Dekker J P, et al. Prevalence of Antibiotic-Resistant Pathogens in Culture-Proven Sepsis and Outcomes Associated With Inadequate and Broad-Spectrum Empiric Antibiotic Use[J]. JAMA Netw Open, 2020,3(4):e202899.
[27] Webb B J, Sorensen J, Jephson A, et al. Broad-spectrum antibiotic use and poor outcomes in community-onset pneumonia: a cohort study[J]. Eur Respir J, 2019,54(1).
[28] Brink A J, Richards G A. The role of multidrug and extensive-drug resistant Gam-negative bacteria in skin and soft tissue infections[J]. Curr Opin Infect Dis, 2020,33(2):93-100.
[29] Puzniak L, DePestel D D, Srinivasan A, et al. A Combination Antibiogram Evaluation for Pseudomonas aeruginosa in Respiratory and Blood Sources from Intensive Care Unit (ICU) and Non-ICU Settings in U.S. Hospitals[J]. Antimicrob Agents Chemother, 2019,63(4).
[30] Burillo A, Munoz P, Bouza E. Risk stratification for multidrug-resistant Gram-negative infections in ICU patients[J]. Curr Opin Infect Dis, 2019,32(6):626-637.
[31] Kalil A C, Sandkovsky U, Florescu D F. Severe infections in critically ill solid organ transplant recipients[J]. Clin Microbiol Infect, 2018,24(12):1257-1263.
[32] Schnell D, Azoulay E, Benoit D, et al. Management of neutropenic patients in the intensive care unit (NEWBORNS EXCLUDED) recommendations from an expert panel from the French Intensive Care Society (SRLF) with the French Group for Pediatric Intensive Care Emergencies (GFRUP), the French Society of Anesthesia and Intensive Care (SFAR), the French Society of Hematology (SFH), the French Society for Hospital Hygiene (SF2H), and the French Infectious Diseases Society (SPILF)[J]. Ann Intensive Care, 2016,6(1):90.
[33] Singh J A, Cameron C, Noorbaloochi S, et al. Risk of serious infection in biological treatment of patients with rheumatoid arthritis: a systematic review and meta-analysis[J]. Lancet, 2015,386(9990):258-265.
[34] Ryan K, Karve S, Peeters P, et al. The impact of initial antibiotic treatment failure: Real-world insights in healthcare-associated or nosocomial pneumonia[J]. J Infect, 2018,77(1):9-17.
[35] Raman G, Avendano E E, Chan J, et al. Risk factors for hospitalized patients with resistant or multidrug-resistant Pseudomonas aeruginosa infections: a systematic review and meta-analysis[J]. Antimicrob Resist Infect Control, 2018,7:79.
[36] Zahar J R, Blot S, Nordmann P, et al. Screening for Intestinal Carriage of Extended-spectrum Beta-lactamase-producing Enterobacteriaceae in Critically Ill Patients: Expected Benefits and Evidence-based Controversies[J]. Clin Infect Dis, 2019,68(12):2125-2130.
[37] Kalil A C, Metersky M L, Klompas M, et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society[J]. Clin Infect Dis, 2016,63(5):e61-e111.
[38] Mao W, Lu D, Zhou J, et al. Chinese ICU physicians' knowledge of antibiotic pharmacokinetics/pharmacodynamics (PK/PD): a cross-sectional survey[J]. BMC Med Educ, 2022,22(1):173.
[39] Jaruratanasirikul S, Boonpeng A, Nawakitrangsan M, et al. NONMEM population pharmacokinetics and Monte Carlo dosing simulations of imipenem in critically ill patients with life-threatening severe infections during support with or without extracorporeal membrane oxygenation in an intensive care unit[J]. Pharmacotherapy, 2021,41(7):572-597.
[40] Ulldemolins M, Roberts J A, Rello J, et al. The effects of hypoalbuminaemia on optimizing antibacterial dosing in critically ill patients[J]. Clin Pharmacokinet, 2011,50(2):99-110.
[41] Andersen M G, Thorsted A, Storgaard M, et al. Population Pharmacokinetics of Piperacillin in Sepsis Patients: Should Alternative Dosing Strategies Be Considered?[J]. Antimicrob Agents Chemother, 2018,62(5).
[42] Carrie C, Legeron R, Petit L, et al. Higher than standard dosing regimen are needed to achieve optimal antibiotic exposure in critically ill patients with augmented renal clearance receiving piperacillin-tazobactam administered by continuous infusion[J]. J Crit Care, 2018,48:66-71.
[43] Fujii M, Karumai T, Yamamoto R, et al. Pharmacokinetic and pharmacodynamic considerations in antimicrobial therapy for sepsis[J]. Expert Opin Drug Metab Toxicol, 2020,16(5):415-430.
[44] Bupsilondingen F V, Gonzalez D, Tucker A N, et al. Relevance of Liver Failure for Anti-Infective Agents: From Pharmacokinetic Alterations to Dosage Adjustments[J]. Ther Adv Infect Dis, 2014,2(1):17-42.
[45] Stewart S D, Allen S. Antibiotic use in critical illness[J]. J Vet Emerg Crit Care (San Antonio), 2019,29(3):227-238.
[46] Oliveira M S, Machado A S, Mendes E T, et al. Pharmacokinetic and Pharmacodynamic Characteristics of Vancomycin and Meropenem in Critically Ill Patients Receiving Sustained Low-efficiency Dialysis[J]. Clin Ther, 2020,42(4):625-633.
[47] Roberts J A, Paul S K, Akova M, et al. DALI: defining antibiotic levels in intensive care unit patients: are current beta-lactam antibiotic doses sufficient for critically ill patients?[J]. Clin Infect Dis, 2014,58(8):1072-1083.
[48] Gatti M, Pea F. Pharmacokinetic/pharmacodynamic target attainment in critically ill renal patients on antimicrobial usage: focus on novel beta-lactams and beta lactams/beta-lactamase inhibitors[J]. Expert Rev Clin Pharmacol, 2021,14(5):583-599.
[49] Guilhaumou R, Benaboud S, Bennis Y, et al. Optimization of the treatment with beta-lactam antibiotics in critically ill patients-guidelines from the French Society of Pharmacology and Therapeutics (Societe Francaise de Pharmacologie et Therapeutique-SFPT) and the French Society of Anaesthesia and Intensive Care Medicine (Societe Francaise d'Anesthesie et Reanimation-SFAR)[J]. Crit Care, 2019,23(1):104.
[50] Kothekar A T, Divatia J V, Myatra S N, et al. Clinical pharmacokinetics of 3-h extended infusion of meropenem in adult patients with severe sepsis and septic shock: implications for empirical therapy against Gram-negative bacteria[J]. Ann Intensive Care, 2020,10(1):4.
[51] De Winter S, Wauters J, Meersseman W, et al. Higher versus standard amikacin single dose in emergency department patients with severe sepsis and septic shock: a randomised controlled trial[J]. Int J Antimicrob Agents, 2018,51(4):562-570.
[52] Urakami T, Hamada Y, Oka Y, et al. Clinical pharmacokinetic and pharmacodynamic analysis of daptomycin and the necessity of high-dose regimen in Japanese adult patients[J]. J Infect Chemother, 2019,25(6):437-443.
[53] Ambrose P G, Grasela D M. The use of Monte Carlo simulation to examine pharmacodynamic variance of drugs: fluoroquinolone pharmacodynamics against Streptococcus pneumoniae[J]. Diagn Microbiol Infect Dis, 2000,38(3):151-157.
[54] Mouton J W, Dudley M N, Cars O, et al. Standardization of pharmacokinetic/pharmacodynamic (PK/PD) terminology for anti-infective drugs: an update[J]. J Antimicrob Chemother, 2005,55(5):601-607.
[55] Sun H K, Kuti J L, Nicolau D P. Pharmacodynamics of antimicrobials for the empirical treatment of nosocomial pneumonia: a report from the OPTAMA Program[J]. Crit Care Med, 2005,33(10):2222-2227.
[56] Tabah A, Cotta M O, Garnacho-Montero J, et al. A Systematic Review of the Definitions, Determinants, and Clinical Outcomes of Antimicrobial De-escalation in the Intensive Care Unit[J]. Clin Infect Dis, 2016,62(8):1009-1017.
[57] Hanretty A M, Gallagher J C. Shortened Courses of Antibiotics for Bacterial Infections: A Systematic Review of Randomized Controlled Trials[J]. Pharmacotherapy, 2018,38(6):674-687.
[58] Teshome B F, Vouri S M, Hampton N, et al. Duration of Exposure to Antipseudomonal beta-Lactam Antibiotics in the Critically Ill and Development of New Resistance[J]. Pharmacotherapy, 2019,39(3):261-270.
[59] Laka M, Milazzo A, Merlin T. Can evidence-based decision support tools transform antibiotic management? A systematic review and meta-analyses[J]. J Antimicrob Chemother, 2020,75(5):1099-1111.

严静教授
主任医师、教授、博士研究生导师。
现任:浙江医院党委书记,并任中华医学会重症医学分会副主任委员;中国老年医学学会重症医学专业委员会会长;浙江省医学会重症医学分会主任委员;浙江省医学会老年医学分会前任主任委员;浙江省康复医学会心脏康复专业委员会、老年病专业委员会主任委员;浙江省ICU质控中心主任;浙江省科技创新团队(重症医学)负责人。《中华老年病研究电子杂志》、《心脑血管病防治》总编辑。
来源:人民卫生出版社《临床知识》约稿
作者:严静教授,浙江医院
编辑:环球医学资讯余霞霞
- 评价此内容
- 我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

