【遏制细菌耐药白皮书】康焰教授:重症感染的体外生命支持技术下抗菌药物的调整策略
四川大学华西医院重症医学科
康焰 张中伟 汪守平 徐菲菲
重症感染—脓毒症和脓毒性休克是重大的国际公共卫生问题,其治疗花费高,医疗资源消耗大,严重影响人类的生活质量,已经对人类健康造成巨大威胁。尽管在抗感染治疗和器官功能支持技术方面取得了一定的进展,病死率仍高。至今,重症感染—脓毒症和脓毒性休克依然是临床医学的一大挑战,仍需要深入研究。
对于重症患者而言,无论感染本身的严重程度如何,只要存在远隔器官功能损害,即可被认为是重症感染。其中,心肺肝肾是重症感染-脓毒症患者极易受损的靶器官,患者往往存在休克、高心排量状态、呼吸衰竭、肝肾功能障碍、分布容积增加等,随着医疗技术的发展,体外生命支持技术在重症患者器官功能支持中的应用种类日益增多及成熟。但患者自身病理生理状况及体外生命支持技术循环管路等因素均可影响重症感染患者的抗菌药物药代动力学(Pharmacokinetic,PK)参数,导致抗感染治疗失败或药物不良反应增加等不良后果。
本小节对重症感染的ECMO与CRRT支持期间抗菌药物的药代动力学特征等进行分析小结,以期为临床用药提供参考。人工肝技术因其每次上机时间短,故对抗菌药物的影响相对较小,本书中不做讨论。
一、重症感染在体外膜肺氧合下的抗菌药物调整策略
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)作为严重心肺衰竭的支持手段,近年来其应用数量逐年攀升,已较广泛的应用于急危重症医学领域。重症感染-脓毒症休克曾被认为是ECMO治疗的禁忌证。随着对重症感染病理生理机制的认识深入及ECMO技术逐渐成熟,当重症感染合并严重的急性呼吸窘迫综合征(ADRS)和/或严重心源性休克时均可考虑使用ECMO治疗。
对于重症感染患者而言,抗菌药物的使用是治疗的基础,也是重症感染-脓毒症唯一确定性的药物治疗方法。重症感染患者本身的病理生理状态复杂,往往存在呼吸循环不稳定、低蛋白血症、肝肾功能障碍、全身炎症反应综合征等极端的生理紊乱,导致药代动力学改变从而影响抗菌药物的暴露,ECMO支持治疗的介入进一步使整个药代动力学过程复杂化。
对需要ECMO支持治疗的重症感染患者,药代动力学受到药物的物理化学特性、生理状态及ECMO整个管路的影响。
(一)生理改变对抗菌药物药代动力学影响的特点
当危重症患者血清白蛋白水平降低时,游离型药物浓度升高,由于毛细血管通透性增加,血管内液渗漏到组织间隙使得血管外容量增加,更多的药物渗漏到组织间隙中,使得表观分布容积升高,血管内有效药物浓度降低,同时肝脏、肾脏对游离药物的清除加快;而危重症患者早期积极液体复苏后液体平衡改变,导致第三间隔液体积聚,表观分布容积升高,可进一步导致亲水性药物的血浆浓度下降;当危重症患者合并肝功能损伤时,肝脏的代谢和清除下降,可导致抗菌药物清除障碍,从而导致血药浓度升高;另外,当合并急性肾损伤时,肾排泄药物清除下降,且也会导致液体积聚,使得表观分布容积升高,导致血药浓度升高,但是当处于急性肾损伤多尿期时,肾脏清除率增强,使得肾排泄药物清除加快,从而血药浓度下降;对于接受体外器官功能支持,如肾脏替代疗法(RRT)、ECMO等的患者,均可呈现出表观分布容积升高、亲水性药物清除加快、亲脂性药物的封存增加,从而使得抗菌药物血药浓度的降低。
(二)ECMO对抗菌药物药代动力学的影响机制
ECMO由驱动泵、氧合器、插管和管道、变温装置及监测系统组成,不管是采用涂层技术的管道、采用中空纤维膜的氧合器、离心泵、插管还是预冲液均能够通过增加药物的表观分布容积、吸附药物、降低药物清除等机制影响抗菌药物的药代动力学,使重症感染患者抗菌药物使用中的药代动力学更为复杂,优化使用更为困难。
ECMO主要有VV-ECMO和VA-ECMO两种形式。VV-ECMO的主要适应症是急性呼吸衰竭,基本原理是使用离心泵从右心房抽出血液,通过氧合器进行气体交换,然后含氧的血液通过回血管返回右心系统,以增加全身的氧供给,其与自身循环呈串联关系;VA-ECMO的主要适应症是难治性循环衰竭,基本原理是使用离心泵从右心房抽出血液,通过氧合器进行气体交换,然后含氧的血液通过大动脉返回体循环,以维持全身的灌注,其循环与自身循环呈并联关系,存在合作与博弈的关系。VA-ECMO和VV-ECMO患者之间抗菌药物的药代动力学参数基本相似。
1.ECMO环路对抗菌药物的吸附
ECMO环路中的各组成部分具有较大的表面积,其中聚氯乙烯的插管及管道是最主要的因素构件。依据使用时间可造成抗菌药物吸附量的不同,加之药物的物理化学性质不同(亲脂性和蛋白结合率),可能导致体内药物浓度不同程度的降低。体外ECMO实验表明,头孢曲松、卡泊芬净等高蛋白结合率以及伏立康唑等亲脂性抗菌药物在ECMO环路中丢失量大,临床应用时应注意调整抗菌药物剂量,有条件时监测药物浓度。
2.影响药物的清除
ECMO下的高动力状态可能会上调肾脏清除能力;但也有研究表明,超过30%接受ECMO支持的患者可能出现肾功能不全,且VA-ECMO的非搏动性血流可改变组织的灌注,降低肾小球滤过率,从而降低经肾脏代谢抗菌药物的清除。所以对此类患者应注意肾脏清除率的改变对亲水性抗菌药物的药代动力学参数的影响。
3.增加抗菌药物的表观分布容积
ECMO环路的预充液及液体复苏等增加了患者循环血量,导致血液稀释。ECMO炎症反应造成的毛细血管渗漏和水肿、ECMO期间的血流动力学改变,均可能增加抗菌药物表观分布容积。
(三)ECMO期间部分抗菌药物的PK改变及给药建议
ECMO治疗期间,药物表观分布容积增加,随之药物清除过程也发生变化。但这一方面的研究数据尚不够充分,建议使用治疗药物监测(Therapeutic drug monitoring,TDM)来指导抗菌药物应用。以下是临床一部分常见抗菌药物在ECMO使用期间的治疗用量推荐。
1.碳青霉烯类
亚胺培南主要经肾脏清除,为亲水性、蛋白结合率低(20%)的时间依赖性抗菌药物。建议ECMO患者采用高于普通患者的亚胺培南剂量,推荐剂量为750~1000 mg,q6h。美罗培南主要也经肾脏清除,是亲水性、蛋白结合率低(2%)的时间依赖性抗菌药物,建议使用标准剂量即可,若肌酐清除率增加或需要更积极的治疗目标时,可适度增加给药剂量。
2.糖肽类
万古霉素是中度蛋白结合率的亲水性药物,ECMO回路对万古霉素的吸附效应较小,建议成人ECMO患者,万古霉素初始剂量为30 mg/kg,后续治疗可根据TDM进行剂量调整,对于肾功能不全患者应调整剂量,避免药物蓄积。利奈唑胺是中等亲脂性、低蛋白结合率(31%)的时间依赖性抗菌药物,建议ECMO患者应提高利奈唑胺的剂量,尤其是在MIC>1 mg/L的病原菌感染时,并依据TDM调整剂量和用法。
3.派拉西林/他唑巴坦
ECMO回路对该药PK无明显影响,用药方案参考重症患者的治疗策略。
4.阿米卡星
阿米卡星主要经肾脏清除,是低蛋白结合率(≤10%)的亲水性浓度依赖性抗菌药物,其有效治疗目标峰浓度(Cmax)为60~80 mg/L。有研究建议根据ECMO患者的体重指数及24小时内液体平衡情况给药。
5.替加环素
替加环素约59%通过胆汁/粪便排泄消除,33%经尿液排泄,是弱亲脂性、高蛋白结合率(71%~89%)的时间依赖性抗菌药物,有研究提示ECMO对替加环素的药代动力学无显著影响,但仍需进一步研究证实。
6.多黏菌素
有研究显示多黏菌素在ECMO前后的血药谷浓度和峰浓度无明显差异,不需要调整剂量。
7.喹诺酮类
有研究建议ECMO患者参照重症患者氟喹诺酮类药物方案进行给药,不需要药物剂量。
8.大环内酯类
目前的研究表明ECMO期间阿奇霉素按常规用药剂量给药,其余数据暂缺。
9.抗真菌药物
伏立康唑主要通过肝脏代谢清除,具有极强的亲脂性,容易被ECMO回路吸附,建议ECMO早期应提高伏立康唑剂量,并进行TDM以保证疗效、减少药品不良反应。另外,ECMO对成人患者卡泊芬净的影响尚不明确,需进一步研究。其余抗真菌药物在ECMO期间尚需要进一步研究。
上述的大部分研究为病例报告和小样本队列研究,还需要更多的大样本临床研究来进一步确定重症感染并接受ECMO支持的患者中抗菌药物的剂量方案,以降低治疗失败的风险和减少耐药菌的发生。建议有条件应尽可能使用TDM,结合患者的实际情况来调整给药方案,以提高抗菌药物的临床效果,减少不良反应的发生。
二、肾脏替代治疗技术
在ICU医疗单元中,连续性肾脏替代治疗(Continuous renal replacement therapy,CRRT)是一项十分常见的而重要的技术。全世界每年约有30%的重症患者经历过CRRT治疗。
CRRT是针对肾功能不全进行的肾脏部分替代或者全替代治疗。在ICU中,重症感染患者往往合并急性肾损伤(Acute kidney injury,AKI)。在总体患者人群中,AKI的发病率约为5%,在术后发生脓毒症人群中可能高达67%。ICU患者当中导致AKI的最主要原因是重症感染引发的脓毒性休克,约占AKI总发病率的50%。AKI可引起酸碱平衡紊乱,水电解质失衡等严重的病理生理过程,需要CRRT进行支持治疗,而且重症感染和AKI二者皆是导致高死亡率的独立危险因素。
但另一方面,针对重症感染本身,CRRT可发挥其肾外治疗的作用,即减轻全身性炎症反应程度。目前已知,严重感染致脓毒性休克的发生与休克的三个始动环节即血容量减少、血管床容量增加、心泵功能障碍均有关,感染灶中的病原微生物及其释放的各种毒素均可刺激单核-巨噬细胞、中性粒细胞、肥大细胞、内皮细胞等,表达释放大量的炎症介质,引起全身炎症反应综合征(Systemic inflammatory response syndrome,SIRS),是促进休克发生发展的重要始动因素。其中某些细胞因子和血管活性物质可增加毛细血管通透性,使大量血浆外渗,导致血容量减少,或引起血管扩张,使血管床容量增加,导致有效循环血量的相对不足。此外,细菌毒素及炎症介质可直接损伤心肌细胞,造成心泵功能障碍。在血液透析过程中,使用相应的炎症介质吸附柱,以及内毒素吸附等措施,有助于减少全身炎症介质荷载,抑制SIRS病理生理过程。
(一)血液净化设备及模式特性
CRRT的血液净化设备是进行血液净化治疗的核心硬件。其基本构造包括血液净化器、泵、管路、压力监测、平衡监测、加热装置、安全监测及显示操作装置等几个部分,其中最核心的部分是血液净化器。通过不同的材质及结构设计,血液净化器可对血液成分进行透析、滤过、吸附等处理,实现清除水分或致病性溶质的治疗目的。目前,血液净化器可根据对溶质清除原理分类为膜式血液净化器和吸附器两大类。
膜式血液净化器是指主要利用对流或弥散原理对溶质进行清除的血液净化器。根据膜生产原料可分为三类,①未修饰的纤维素膜,主要包括铜仿膜、尼龙铜胺膜,这类膜生物相容性差,无吸附作用,中分子物质的清除能力差,长期应用易产生并发症,已逐渐被淘汰。②修饰性/再生纤维素膜,主要包括血仿膜、三醋酸纤维素膜。血仿膜较铜仿膜生物相容性好,清除小分子毒素的能力增加,而三醋酸纤维膜具有更好的清除中分子毒素的能力。③合成膜,主要包括聚砜膜、聚酰胺膜、聚醚砜膜、聚碳酸酯膜、聚丙烯腈膜、聚甲基丙烯酸甲酯膜,这类膜对中等分子量物质的去除能力强,生物相容性好,同时有优良的耐菌、耐有机溶剂等特性,目前在临床上的应用越来越广泛。各种膜材特性见下表1:
表1 膜式血液净化器常用的膜材料及主要特性
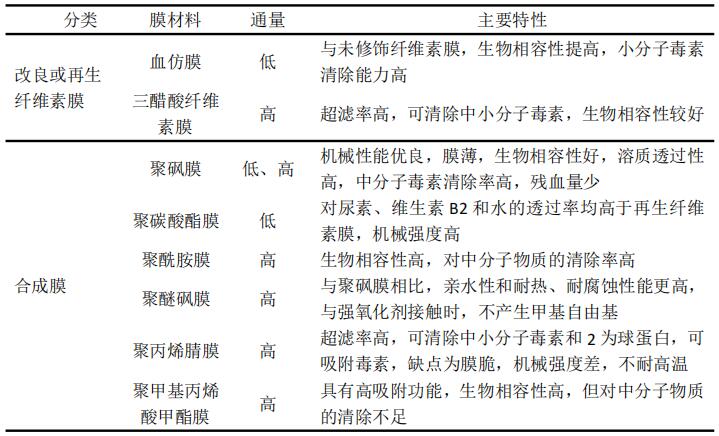
吸附器是指采用吸附材料,主要通过吸附原理进行溶质清除的血液净化器。吸附器根据其制造原料及功能分为以下几类:①离子交换树脂,在临床上主要用于高胆红素血症的吸附治疗;②活性炭吸附剂,现已广泛应用于吸附各种内源性和外源性的致病物质,如肌酐、尿酸、酚类、脂肪酸、中分子物质、胆红素、镇静药物、农药等。③吸附树脂,主要用于吸附胆红素和某些特定药物(比如巴比妥类、甲苯喹唑酮、格鲁米特、安宁、茶碱、地高辛、对硫磷和对氧磷等)。④免疫吸附剂,是在吸附材料表面固定上抗原、抗体或补体后形成的一种特异性医用吸附剂。
血液净化技术除了设备特性各异,还根据不同的毒素清除机制分成了不同的技术方向。主要包括血液透析(hemodialysis,HD),血液滤过(hemofiltration,HF),血液透析滤过(hemodiafiltration,HDF)及血液吸附(plasma adsorption,PA)等技术。不同的技术清除的血浆溶质各不同相同。
血液透析采用弥散和对流原理清除血液中代谢废物、有害物质和过多水分,是终末期肾脏病患者最常用的肾脏替代治疗方法之一,也可用于治疗药物或毒物中毒等,主要清除诸如尿素、肌酐、尿酸等小分子尿毒症毒素。血液滤过通过模仿正常人肾小球滤过和肾小管重吸收原理,以对流方式清除体内过多的水分和尿毒症毒素。与血液透析相比,血液滤过具有对血流动力学影响小,中分子物质清除率高等优点。血液透析滤过是血液透析和血液滤过的结合,具有两种治疗模式的优点,可通过弥散和对流两种机制清除溶质,在单位时间内比单独的血液透析或血液滤过清除更多的中小分子物质。血浆吸附是血液引出后先进入血浆分离器,应用膜式分离技术,将血液的有形成分(血细胞、血小板)和血浆分开,血浆再进入吸附柱进行吸附、清除血浆中特定物质,吸附后血浆与分离的有形成分再回输至体内。血浆吸附根据吸附剂的特性主要分为两大类,一类是分子筛吸附,即利用分子筛原理通过吸附剂携带的电荷和孔隙,非特异性地吸附电荷和分子大小与之相对应的物质,吸附材料包括活性炭、树脂、碳化树脂和阳离子型吸附剂等。另一类是免疫吸附(immunoadsorption),即利用高度特异性的抗原、抗体或某些有特定物理化学亲和力的物质(配基)结合在吸附材料(载体)上,制成吸附柱,利用其特异性吸附性能,选择性清除血液中内源性中大分子致病物质(配体)的一种血液净化治疗方法。免疫吸附通过吸附作用直接清除血液循环中致病性抗体、循环免疫复合物和炎症因子等中大分子致病物质,并可改善机体免疫状态。与血浆置换比较,无需补充置换液。
由于不同的血液净化设备、不同的净化模式各具特色,其选择性清除的物质也不同,对体内抗菌药物等药物的影响也各有特异性。
(二)重症感染患者CRRT时对药物代谢动力学的影响
重症感染患者本身的病理生理改变会导致机体药物代谢过程的差异,而同时合并肾功能不全使用血液净化技术的患者,其机体的药代动力学特性又受到不同血液净化技术的影响。
在重症感染的过程中,炎性反应可导致毛细血管通透性增高,血浆大分子如血浆蛋白渗出,导致大量液体的转移和向第三间隙的丢失,引起心排量、肌酐清除率下降。显著的血液再分布会导致急性肾衰竭及肝衰竭,从而造成依赖肝肾代谢的抗菌药物等药物的代谢异常。另外,液体的分布异常也可能会引起一些靶器官抗菌药物分布容积的降低。不仅如此,感染性休克时大量液体的复苏则会引起许多水溶性抗菌药物分布容积的增加。总之,临床最常见的药代动力学参数的改变主要由于细胞外容量扩张而引起的水溶性药物分布容积的增加,蛋白结合率的改变,以及肾或肝衰竭导致的系统清除率的降低。因此抗菌药物治疗方案亦须相应调整,以提高其抗感染的效果。
CRRT对抗菌药物的影响主要是因为CRRT对药物的清除作用,而清除程度取决于CRRT膜、模式及药物本身特性、药代动力学特点等因素,其中影响最大的是滤器。滤器膜的通透性、孔径、表面积、吸附力与抗感染药物清除率呈正相关。CRRT过程中,药物清除作用的机制主要是对流或弥散,其程度与药物相对分子质量的大小有关,相对分子质量小的药物更容易通过半透膜被滤过和清除;绝大部分抗菌药物相对分子质量都小于500,即便是一些大分子抗菌药物,在高通量透析器或血滤器进行CRRT时,也容易被清除。透析液流速相对较慢,药物分子也有足够时间进行跨膜渗透。滤过膜的物理特异性对不同的药物产生不同的滤过作用。纤维素膜和铜仿膜通透性较低,氨基糖苷类抗菌药物和肿瘤坏死因子等药物易被吸附。聚丙烯腈膜吸附力较强,对氨基糖苷类和喹诺酮类(左氧氟沙星)有很强的吸附能力。目前,高通量滤器在CRRT中的应用日益广泛,膜的特性对于药物清除的影响相对固定,但抗菌药物剂量的调整仍需根据不同滤器的吸附、滤过能力来进行调增。
CRRT模式对抗菌药物的清除也有一定的影响,对流方式(CVVH)主要通过对流原理清除各种溶质、药物,是最常用的CRRT模式。弥散方式也可产生同样的作用。此二者可通过计算机模拟的方式对药物的清除率进行计算。
另外,药物本身特性也能影响到CRRT的清除作用。首先,亲水性的抗菌药物主要以药物原型或代谢产物经肾脏排出,CRRT对其清除作用较为明显;其次,药物表观分布容积(Vd)亦可影响CRRT清除作用,药物的Vd与CRRT清除呈反比:任何药物,只要Vd>O.8L/kg,CRRT对其清除效率大幅降低,通常并不需要追加药物剂量;而对于Vd<0.6L/kg,则容易被CRRT清除,大多数此类药物需要在CRRT期间调大剂量或者追加补充剂量;再次,药物的血浆蛋白结合率结合率越高,越不易被CRRT清除。血PH值、游离脂防酸浓度、血胆红素浓度等因素也可能产生一定的影响。此外,带负电荷的药物容易被清除,而带正电荷的药物则较难清除,比如庆大霉素,虽然分子质量很小,但是因其带正电荷而不易被CRRT清除。
(三)CRRT期间抗菌药物治疗调整策略
血液净化技术日新月异,新的抗菌药物也不断问世,血液净化治疗对药代动力学的影响及药物剂量调整也面临挑战。尽管有一些这方面的研究,但总体还很局限,还有相当多的药物未得以覆盖。对近年相关临床研究和药物剂量调整的推荐罗列如下(表2)。但这些推荐有自身不可避免的缺点,有时会对临床实践造成一些干扰。比如,这些推荐都是基于传统的透析或滤过膜,超滤液流速和血液流速的值都比较小,而且药代动力学参数大部分都是从健康人或慢性肾脏病的患者而非重症患者中获得;并且相当一部分数据都是基于样本数量有限的临床研究,缺乏大样本临床数据的验证。
表2 常用抗菌药物药动学参数及CRRT时剂量的调整
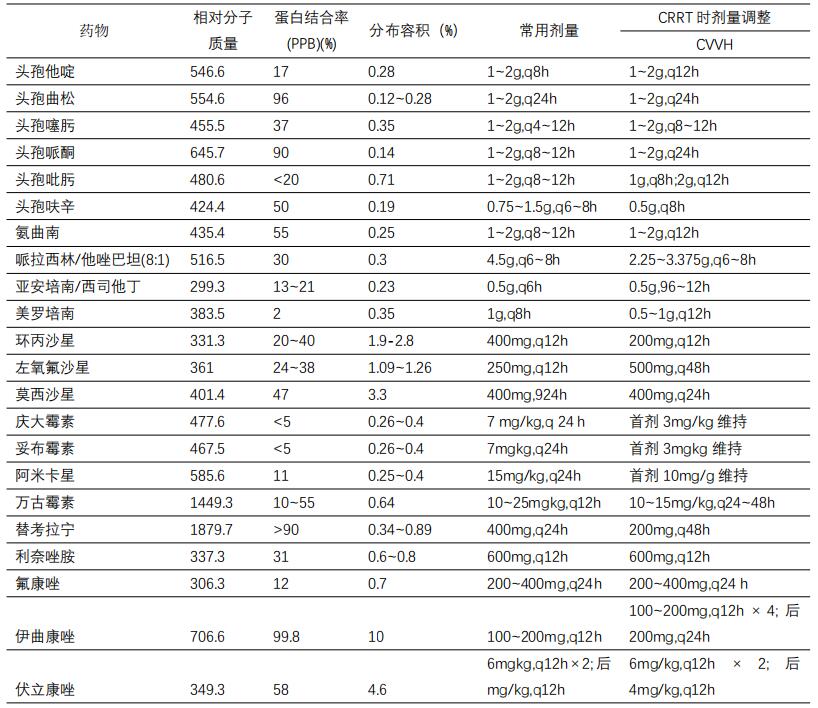
如前所述,重症感染患者CRRT中药物清除的程度同时受疾病本身状态、药物自身特性和CRRT不同技术等多个因素影响。这些参数在临床过程中往往处于动态变化之中,所以,为不同的抗菌药物制定一个包含所有可变参数的剂量指南几乎是不可能的。根据患者的具体情况,制定个体化的治疗方案及进行抗菌药物的调整尚有赖于正确的临床判断。
参考文献:
1.中国医药教育协会感染疾病专业委员会. 抗菌药物药代动力学/药效学理论临床应用专家共识. 中华结核和呼吸杂志,2018,41 (6): 409-446.
2.Fujii M, Karumai T, Yamamoto R,et al.pharmacokinetic and pharmacodynamic consideration in antimicrobial therapy for sepsis.Expert Opin Drug Metab Toxicol.2020;16(5):415-430.
3.Dzierba AL, Abrams D, Brodie D. Medicating patients during extracorporealmembrane oxygenation:the evidence is building. Crit Care,2017,21(1):66.
4.BougléA,Dujardin O, Lepère V,et al.PHARMECMO:therapeutic drug monitoring and adequacy ofcurrent dosing regimens of antibiotics in patients on extracorporeal lifesupport .Anaesth CritCare Pain Med,2019,38(5):493-497.
5.Chen WQ, Zhang D, Lian WW, et al. Imipenem population pharmacokinetics:therapeutic drug monitoring data collected in critically ill patients with orwithout extracorporeal membrane oxygenation. Antimicrob Agents Chemother, 2020, 64(6): 00385-20.
6.Abdul-Aziz,et al.Antibiotic dosing during extracorporeal membrane oxygenation: does the systemmatter? Current Opinion in Anaesthesiology: 2020,33 (1),71-82.
7.Shekar K, Abdul-Aziz MH, Cheng V, et al.Antimicrobial exposures in critically ill patients receiving extracorporeal membrane oxygenation.Am J Respir Crit Care Med. 2022;10.1164/rccm. 202207-1393OC.
8.Hoste, E.A., et al., Acute renal failure in patients with sepsis in a surgical ICU: predictive factors, incidence, comorbidity, and outcome. J Am Soc Nephrol, 2003. 14(4): p. 1022-30.
9.Bagshaw, S.M., C. George, and R. Bellomo, Early acute kidney injury and sepsis: a multicentre evaluation. Crit Care, 2008. 12(2): p. R47.
10.White, L.E., et al., Acute kidney injury is surprisingly common and a powerful predictor of mortality in surgical sepsis. J Trauma Acute Care Surg, 2013. 75(3): p. 432-8.
11.Godin, M., P. Murray, and R.L. Mehta, Clinical approach to the patient with AKI and sepsis. Semin Nephrol, 2015. 35(1): p. 12-22.
12.陈晓辉, 血液净化在ICU中的应用. 2012: 血液净化在ICU中的应用.

康焰教授
教授,主任医师,重症医学博士生导师;四川大学华西医院重症医学科主任
现任中华医学会重症医学分会副主任委员
中国医师协会重症医学医师分会常委
四川省医学会重症医学专业委员会主任委员
四川省医师协会重症医师专科委员会候任主任委员
四川省重症医学质量控制中心主任
为四川省委/省政府授予的 “四川省学术和技术带头人”、“四川省卫生健康首席专家”、“四川省卫生健康领军人才”、四川省卫生厅学术技术带头人、“四川省有突出贡献专家”。
所获荣誉:2008年荣获“四川省五一劳动奖章”、“四川省抗震救灾先进个人”、“四川大学优秀共产党员”;2009年荣获“玉树抗震救灾先进个人”;2020年荣获党中央、国务院、中央军委授予的“全国抗击新冠肺炎疫情先进个人”、“全国优秀共产学员”以及“全国卫生系统新冠肺炎疫情防控工作先进个人”。中共四川省第十二次党员代表大会代表、中共四川省第十二届委员会候补委员。
学术方向:主要从事重症医学临床、科研及教学工作。研究方向为重症患者脏器功能监测与支持、重症信息化平台建设,重症医学质量控制。着重于MODS、机械通气、重症感染、临床营养、镇痛-镇静及重症临床信息系统、重症质控管理平台、重症远程管理及重症数据库建设与运用等基础与临床研究。参与主持及编写了《实用重症医学》、《麻醉与危重医学》、《ICU监测与治疗技术》等多部专著及《中国重症患者转运指南》、《重症加强治疗病房病人镇痛和镇静治疗指南》、《中国重症加强治疗病房建设与管理指南》等专业指南。主持开发了《四川省重症医学质量控制系统》、《重症医学临床信息系统》等。承担国家自然科学基金课题、国家科技部重大专项、四川省卫生厅课题、四川省科技支撑项目及北京市科委重点课题等。获发明专利三项。曾获 “中华医学科技二等奖”和“四川省科技进步一等奖” ,团队荣获“亚洲医院管理金奖”。
共发表SCI、MEDLINE论文100余篇。担任《中华医学杂志(英文版)》、《中华内科学杂志》、《中国危重病急救医学》、《中国呼吸与危重监护杂志》、《Critical Care Medicine (Chinese Edition)》、《Journals of Infectious Disease Society of America (Chinese Edition)》等编委。
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

