龚凤英教授:内分泌激素检测技术之免疫分析法
免疫分析法是利用抗原和抗体特异性结合产生免疫反应的原理,对待测抗原或者抗体进行定性、定位、半定量和定量的技术(图1)。该技术对于内分泌疾病的基础研究和内分泌疾病的预测、早期诊断、鉴别诊断以及疗效评估等发挥越来越重要的作用[1~3]。
根据标记物性质的不同,可将免疫分析法分为放射性核素和非放射性核素标记两大类。前者包括RIA和免疫放射分析(immunoradiometric assay,IRMA),后者主要有酶免疫分析(enzyme immnunoassay,EIA)、荧光免疫分析(fluoroimmunoassay,FIA)和化学发光免疫分析(chemiluminescence immune assay,CIA)。根据检测原理的不同,可以将免疫分析分为竞争性结合分析法(比如RIA)和非竞争结合分析法(比如IRMA)。EIA、FIA、CIA既有竞争性结合分析法,也有非竞争结合分析法[1~3]。
RIA、IRMA、EIA、FIA、CIA均属于将标记物的灵敏度和抗原与抗体的特异性相结合的超微量分析技术。RIA和IRMA最常用的标记物为125I或3H放射性核素,EIA、FIA和CIA则分别用酶、荧光素和化学发光剂作为标记物。抗原(antigen,Ag)或抗体(antibody,Ab)被标记物标记为标记抗原(Ag*)或标记抗体(Ab*)后,既不影响抗原或抗体免疫反应的特性,也不改变标记物本身的活性,但却可明显提高测定的灵敏度。例如:RIA和IRMA免疫反应终点的判断是γ计数器(测125I)或液体闪烁谱仪(测3H,简称β计数器)探测游离(free,F)或结合(bond,B)的标记抗原或抗体的放射性,单位是每分钟计数次数(count times per minute,cpm)。最常用的放射性核素标记物为125I或3H,其比活度即每毫原子的衰变数分别为2000Ci/m和2.9Ci/m原子。通过用计数器计数放射性核素标记物质的放射性比活度,则能准确定量标记物的含量[1~3]。
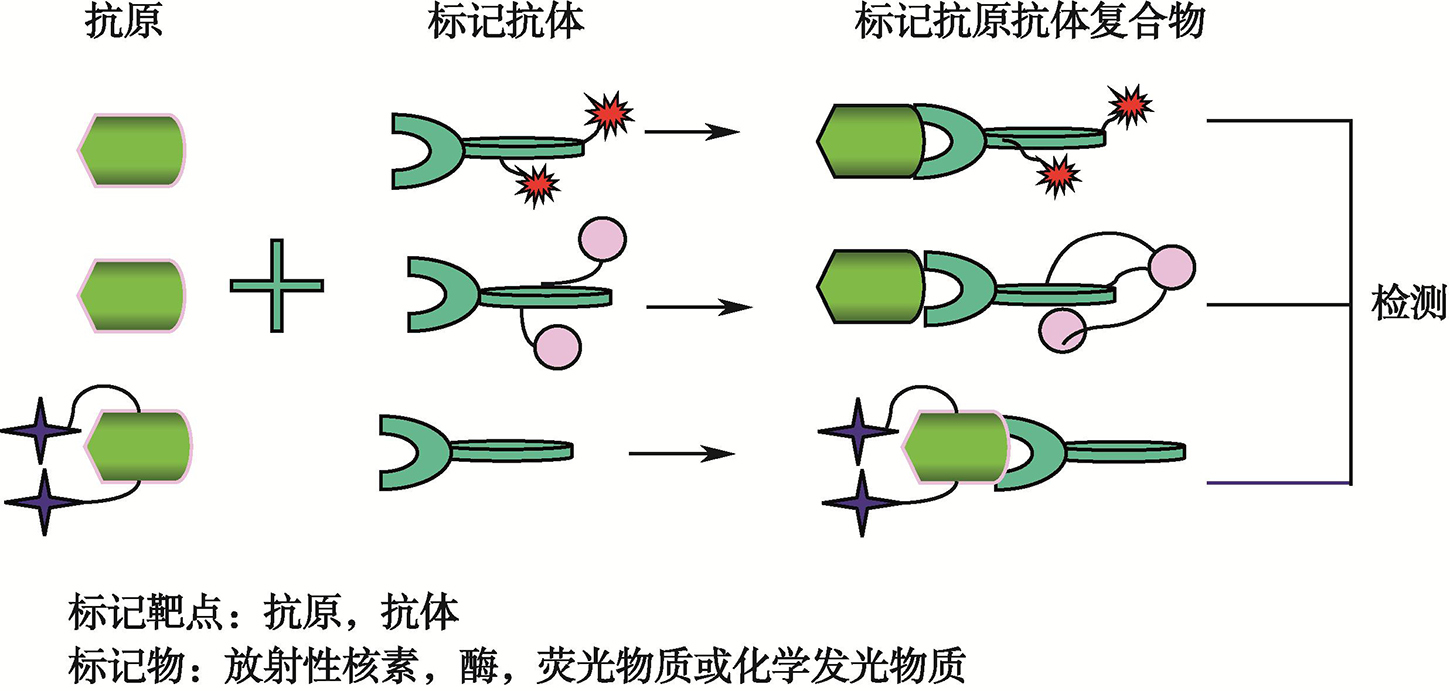
图1 激素免疫测定技术原理示意图
用酶标记的抗原或抗体进行EIA,则在免疫反应完成后,加入相应的无色底物,待酶催化呈色后,再用分光光度计测定光密度进行准确定量的一种分析方法。由于酶是能催化化学反应的特殊蛋白质,能使反应加速,并具有高度专一性。因此,呈色反应不但显示酶的存在,而且高度放大了酶量的变化,可以极为灵敏地反映B或者F酶标记抗原或抗体的变化,使EIA的灵敏度达到或者超过RIA。
化学发光免疫分析(CIA或者CLIA)是继酶免疫分析法之后发展起来的一种重要的非放射性免疫检测方法。既有化学发光分析的高灵敏性,又有免疫反应的高度特异性,方法简单、快速,是目前在内分泌激素检测领域中占有主导地位的检测方法[1~3]。
本文将从竞争性结合和非竞争结合分析法的角度,扼要介绍RIA、IRMA及其他放射结合分析的基本原理,其次,以EIA为重点介绍酶免疫分析方法,最后介绍目前在临床上广泛应用的CIA。
一、放射免疫及其他放射结合分析
1960年美国学者Yalow和英国学者Ekins分别正式发表了血浆胰岛素RIA和甲状腺素竞争性蛋白结合分析法(competitive protein binding assay,CPBA)。1970年,Lefkowite报道了ACTH放射受体分析法(radio receptor assay,RRA)。这些方法都是利用过量被测物及其放射性核素标记物相互竞争有限量的特异性抗体(RIA)或者结合蛋白(CPBA和RRA)的原理测定被测物的含量,操作步骤大同小异;因此,有人将之统称为饱和免疫分析法[4~6]。
(一)放射免疫分析
Yalow等人在1960年正式发表RIA是激素等物质超微量分析史上的一次革命性突破,曾经极大地推动了内分泌学等生命科学的发展,因而同神经内分泌的创始人Guillemin和Schally于1977年共同获得了诺贝尔生理学或医学奖。现将该方法的理论前提、基本原理和主要操作步骤简要介绍如下[7~9]。
1.理论前提
RIA的理论前提有三点:①放射性核素标记抗原(Ag*)和标准或被测Ag(统称非标记Ag)与相应的特异性Ab有相同的亲和力和结合位点;②Ag*和Ab的量是固定的,而且Ab的总有效结合位点多于Ag*的数目。当无Ag存在时,Ab只能结合15%~50%的Ag*(简称B0%);③Ag*、Ag和Ab有足够的时间共处于一个反应系统中,使Ag同Ag*相互竞争与Ab结合的反应最终达到动态平衡[7~9]。
2.基本原理
RIA的基本原理是过量的Ag*和Ag相互竞争同有限量Ab结合。在未加入Ag时,Ag*和有限量Ab形成的Ag*-Ab复合物的反应遵循质量作用定律,因而反应物Ag*和Ab与产物Ag*-Ab产物保持着动态平衡关系(图2)。加入非标记Ag后,Ag即与Ag*相互竞争同Ab结合,形成的Ag-Ab和Ag*-Ab产物与反应物Ag*、Ag及Ab的反应仍然遵循质量作用定律,保持着动态平衡关系。Ag的加入使Ag*-Ab(即B)的形成减少、未结合的Ag*(即游离的Ag*,简称F)增加。B、F、B/F或B/B0的量与非标记的Ag的量存在函数关系,随着Ag的增加,B、B/F或B/B0相应减少,而F则相应增加。因此,当反应达到平衡时,将B和F分离,测定B或F的放射性(cpm),除以加入的总放射性得到B%和F%。以B%或B/B0%作为纵坐标(Y轴),以不同剂量的Ag标准作为横坐标(X轴),绘制标准曲线(又称剂量反应曲线,图3),未知样本B或F值测得后,即可从此曲线查到被测物的含量[7~9]。
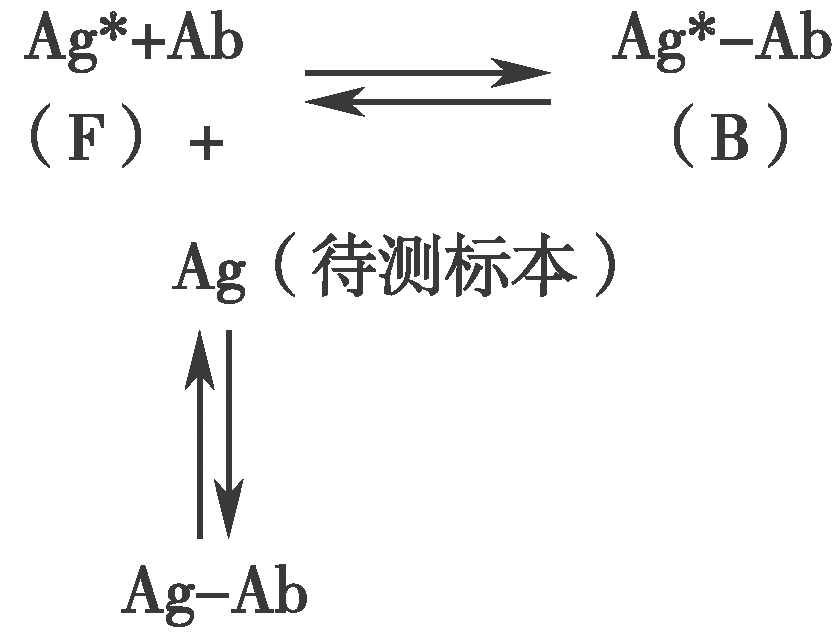
图2 竞争性放射免疫分析的基本原理
Ag*标记抗原;Ag待测抗原;Ab特异抗体
Ag*-Ab标记抗原抗体复合物
Ag-Ab非标记抗原抗体复合物
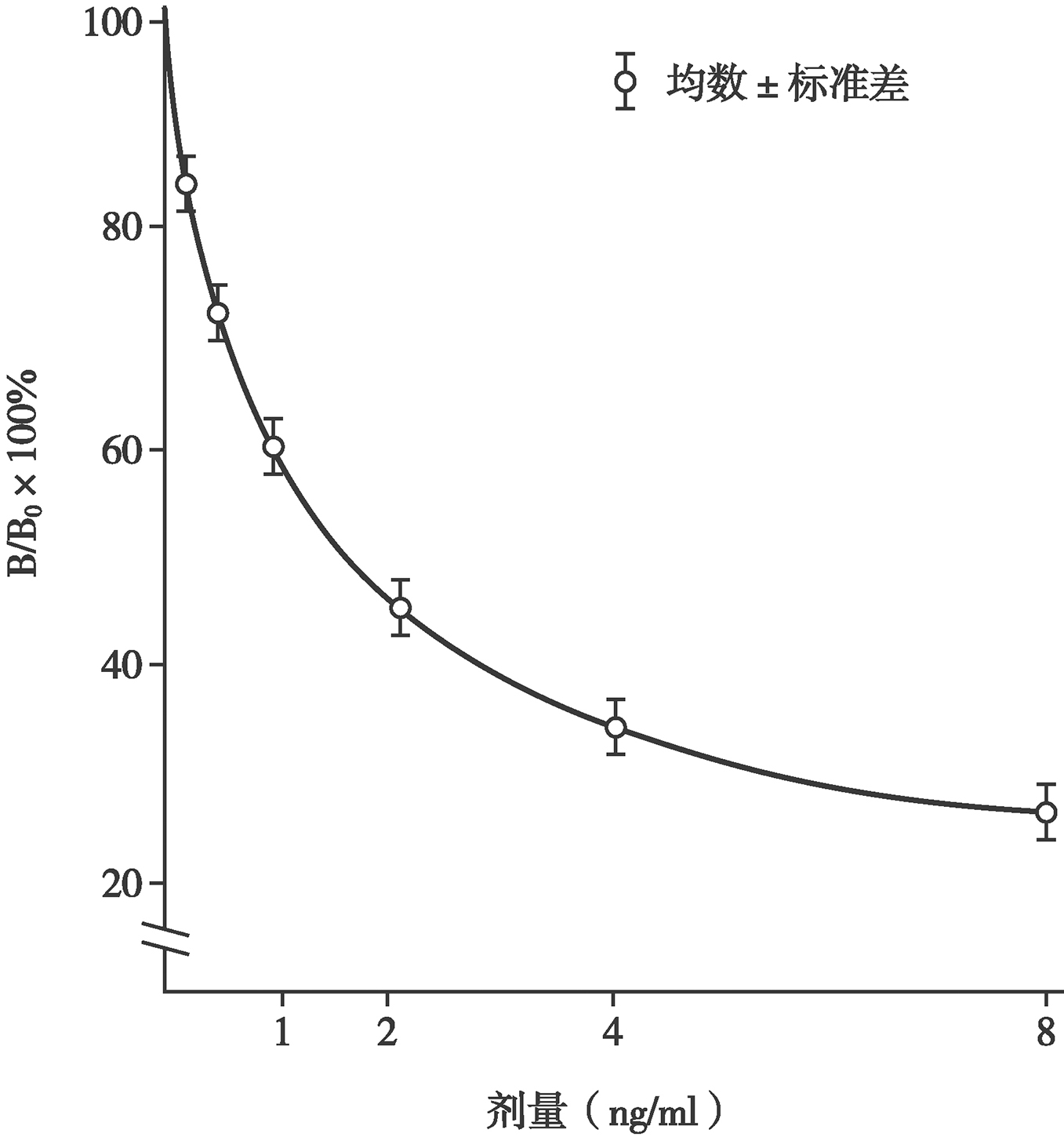
图3 竞争性免疫分析标准(剂量反应)曲线
3.主要步骤
RIA有四个主要步骤:①竞争性结合反应;②B和F的分离;③测放射性;④绘制标准曲线和计算被测物的含量。先设置总计数(T)管、本底计数(包括自然本底和仪器噪音,C)管、非特异性结合(nonspecific binding,NSB)管、零标准即最大结合(B0)管、系列梯度的标准(ST)管以及被测样品(B或Sm)管,再按表1中的“+”加样。在4℃或37℃保温足够长时间,令过量Ag和Ag*互相竞争同有限量Ab结合,当反应达到平衡时即可进行B/F的分离[7~9]。
RIA多数情况下是采取平衡竞争结合系统,即将Ag*与Ag同时加入到反应管中,二者在平衡状态下与抗体竞争结合位点。当灵敏度达不到要求时,可考虑应用非平衡竞争结合系统,即先加入Ag与Ab保温,且务必使反应达到平衡,然后再加入Ag*,且勿使反应达到平衡(即时间较短的保温)就终止反应,进行B/F分离[7~10]。
表1 RIA各管的加样

用第二抗体法(羊抗兔或兔抗鼠)、聚乙二醇(PEG)沉淀法或葡萄糖碳末吸附法分离B和F,均需离心,较繁琐和费时;而固相化抗体或抗原(即所谓的固相RIA)分离技术则不需离心,具有简单、方便和快速等优点,已广泛应用于RIA、IRMA及其他非放射性核素标记的免疫分析。将抗体或抗原固定在固相支持物上是免疫固相分析的关键[7~9]。
用选定的方法分离B和F,并用计数器测T、NSB、B0和标准被测样品管的cpm后,即可以标准品的剂量为X轴,B%、B/F%或B/B0%为Y轴绘制“乙字形”标准曲线(图3),亦可将B/B0%值转换为logit值,使曲线变为直线。根据被测样品管的B,即可从标准曲线读出被测物的含量(图3)。近代的计数器均配有电脑软件,按规定的先后顺序放置T、NSB、B0浓度由低到高的系列梯度标准管及编码的被测样品管,输入操作指令后,即可自动计数并打印出标准曲线及其有关参数和被测样品的含量[7~9]。
(二)竞争性蛋白质结合分析法
竞争性蛋白质结合分析法(CPBA)是利用血浆中天然存在的结合球蛋白作为特异性结合试剂,替代抗体进行激素检测的分析方法。血浆中天然存在的结合球蛋白有甲状腺素结合球蛋白(thyroid binding globulin,TBG)、皮质类固醇结合球蛋白(corticosteroid binding globulin,CBG)和性激素结合球蛋白(sex hormone binding globulin,SHBG),它们分别对甲状腺激素、皮质类固醇激素和性激素有较高的亲和力和结合特异性,均可以替代抗体作为特异性结合试剂,用于甲状腺激素、氢化可的松和睾酮的超微量分析。1973年,北京协和医院内分泌科利用孕马血清中CBG建立皮质类固醇激素的CPBA测定方法。因为马的CBG与皮质醇的结合最为特异,与皮质酮、可的松和去氢皮质酮的交叉反应仅分别为16%、10%和2%,而与泼尼松、泼尼松龙、地塞米松、黄体酮和17α-羟孕酮等均无明显交叉反应,因此,该方法的特异性明显高于RIA[10]。
(三)放射受体分析
由于上述RIA是基于抗原和抗体特异性相结合的原理建立的免疫测定方法,也就是说,凡是能与抗体相结合的分子,不论其有无生物活性或者生物活性高还是低,都能被检测出来。所以,其测定结果反映的是被测定分子的免疫活性而不是生物活性。生物活性物质(统称为配体,L)要发挥其生物学效应首先必须与特异性受体(R)结合,R具有高度特异性,只能同有生物活性的L结合。因此,利用被测物与特异性受体相结合的原理建立起来的放射受体分析法(RRA),可以特异性地反应被测物质的生物活性。所以,RRA的测定结果能准确地反映生物机体的功能状态[11,12]。
放射受体分析(RRA)测定的基本原理是基于过量的被测物(L)和被测物的放射性标记物(*L)相互竞争与有限量的特异性受体(R)结合,同RIA相似,属于饱和竞争性结合分析法。
有四个主要步骤:①竞争性结合反应;②B和F的分离;③测放射性;④绘制标准曲线和计算被测物的含量。
与RIA测定类似,RRA测定也需要设置总计数(T)管、总结合管(B0)、非特异性结合管(NSB)、标准曲线系列(ST)和被测样品管(Sm)。加样的方法类似表1。在适合的温度下温育使受体和配体的结合反应达到平衡后,选择适当的方法进行B/F的分离,通过测定B的放射活性(cpm)计算特异性结合百分率(B%)。从已经制定的标准曲线上,读出被测样品中配体的含量[11~12]。
与RIA测定不同,进行RRA测定所需要的试剂有受体和标记配体。受体主要有全细胞受体、膜受体、可溶性受体和胞内受体。不同的受体制备的方法不同。全细胞受体就是含有特异性受体的单细胞悬液,从被测物作用的靶器官或组织获得单细胞悬液的方法有机械分离和化学分离两种方法。使用全细胞受体制品的优点是配体和受体的结合最接近整体的情况,非特异结合较低。主要缺点包括单细胞血液不易保存,冰浴保存不超过30分钟;在生理温度下,全细胞中配体和受体的结合会因内化而被降解,使结果解释复杂化;单细胞易凝集成团,从而影响配体与细胞团中间细胞受体的反应。膜受体是指配体的受体在细胞膜上,比如肽类、蛋白质类和儿茶酚胺等配体。将细胞打碎即可分离出含受体的膜碎片。膜受体制品的优点是受体活性较稳定,在−20℃可以保存半年以上,在生理温度下进行配体与受体的结合反应而不存在配体-受体复合物内化降解的问题。其缺点是膜受体和全细胞受体与配体的结合条件可能不同,因此亲和力也可能不一样。可溶性受体通常是将非离子性清洁剂如Triton-X使细胞或者组织溶解,去除不溶物,收集含可溶性受体的上清液。其优点是同样是不存在用全细胞受体研究时出现的配体-受体复合物内化降解的问题;同时可将受体进行浓缩,适用于从受体水平低的细胞中获得足够数量的受体;便于各种温育调节的控制。主要缺点是用这种受体制品进行RRA时,非特异性结合可高达25%,原因是受体制品中存在蛋白酶,使配体和受体降解从而影响二者的结合特性。可以加入蛋白酶抑制剂防止此种降解作用。胞内受体指的是甲状腺激素和甾体激素的受体,存在于细胞质和细胞核中,必须将细胞膜和核膜打碎才能分离获得受体。常用的方法是高速超声组织或者打碎机匀浆组织[11~12]。
二、免疫放射分析
RIA的基本原理是根据放射性核素标记抗原和被测抗原相互竞争与有限量抗体的抗原决定簇(以下简称单位点)结合,当结合反应达到平衡时,将游离(F)及与抗体结合(B)的抗原分开,然后测量B或F的放射性,并从标准曲线上读出被测抗原的含量。根据上述原理,未达到一定的灵敏度,须限制抗体和标记抗原用量,使测定范围变窄并降低其精密度。根据抗原和抗体之间的反应动力学,过量抗原与有限量的抗体反应需较长时间才能达到平衡(有时要长达72小时),因而无法及时得出结果。此外,在测定中必须进行B/F的分离,操作较为烦琐,因此,早在1986年就有人建议用双位点、非竞争性结合和过量抗体的IRMA代替RIA。但因IRMA需用大量经过纯化的抗体,而经典免疫动物法所能得到的抗血清数量有限,以致本法一直未能推广。淋巴细胞杂交瘤技术可由微量不纯抗原或某片段制备大量针对单一抗原决定簇的抗体—单克隆抗体(以下简称单抗),不但解决了IRMA的抗体供应问题,还可充分发挥IRMA的优点。从20世纪80年代起,IRMA广泛应用于激素、受体、免疫球蛋白、铁蛋白、乙肝表面抗原和肿瘤细胞表面相关抗原等测定。选择一对各自与被测抗原分子上的不同位点(以下简称双位点)结合、彼此完全互不干扰的单抗,其中一种作为固相抗体,非特异性地吸附在聚苯乙烯等塑料载体表面,以便特异性捕捉被测样品中的抗原(Ag);另一种用放射性核素标记,作为对被测Ag进行特异性定量的指示剂。将固相抗体(抗体1)、被测样品及标记抗体(*抗体2)同时混合,经5分钟至2小时的保温后,洗去未与Ag结合的多余*抗体2,用γ计数器测固相载体上抗体1-Ag-*抗体2的放射活性,即可从标准曲线上得知被测Ag的含量(图4、图5)。相对于被测抗原,固相抗体和被测抗体均为过量,而且可同时与被测抗原结合。同单位点RIA相比,双位点或夹心IRMA具有如下优点:①操作更为简便快捷,可在10分钟至3小时出结果;②灵敏度高10倍;③可测范围大6倍;④更为特异,可通过不同配对的抗体检测不同分子形式的激素等。但是,甾体激素、小于20个氨基酸的小肽和其他小分子物质,由于很难获得两个不同结合位点的共同抗体,因此不适用于IRMA进行测定[13]。

图4 免疫放射分析(IRMA)的基本原理
IRMA可用于:①两种或两组(每组可有多种)不同单抗;②一种(组)为单抗,另一种(组)为常规抗血清;③两种(组)不同常规抗血清(例如:分别为兔和羊抗人促甲状腺素)。其先决条件是:①两种(组)抗体分别与被测抗原分子上不同位点结合,彼此互不干扰;②其中一种(组)必须是高度特异的;③可用125I等放射性核素标记;④可牢固地吸附在固相载体表面;⑤数量足够,性质稳定,适用于批量纯化等。此外,为降低非特异性结合和空间位阻,有人主张用Fab’或F(ab’)2代替整分子抗体[13]。
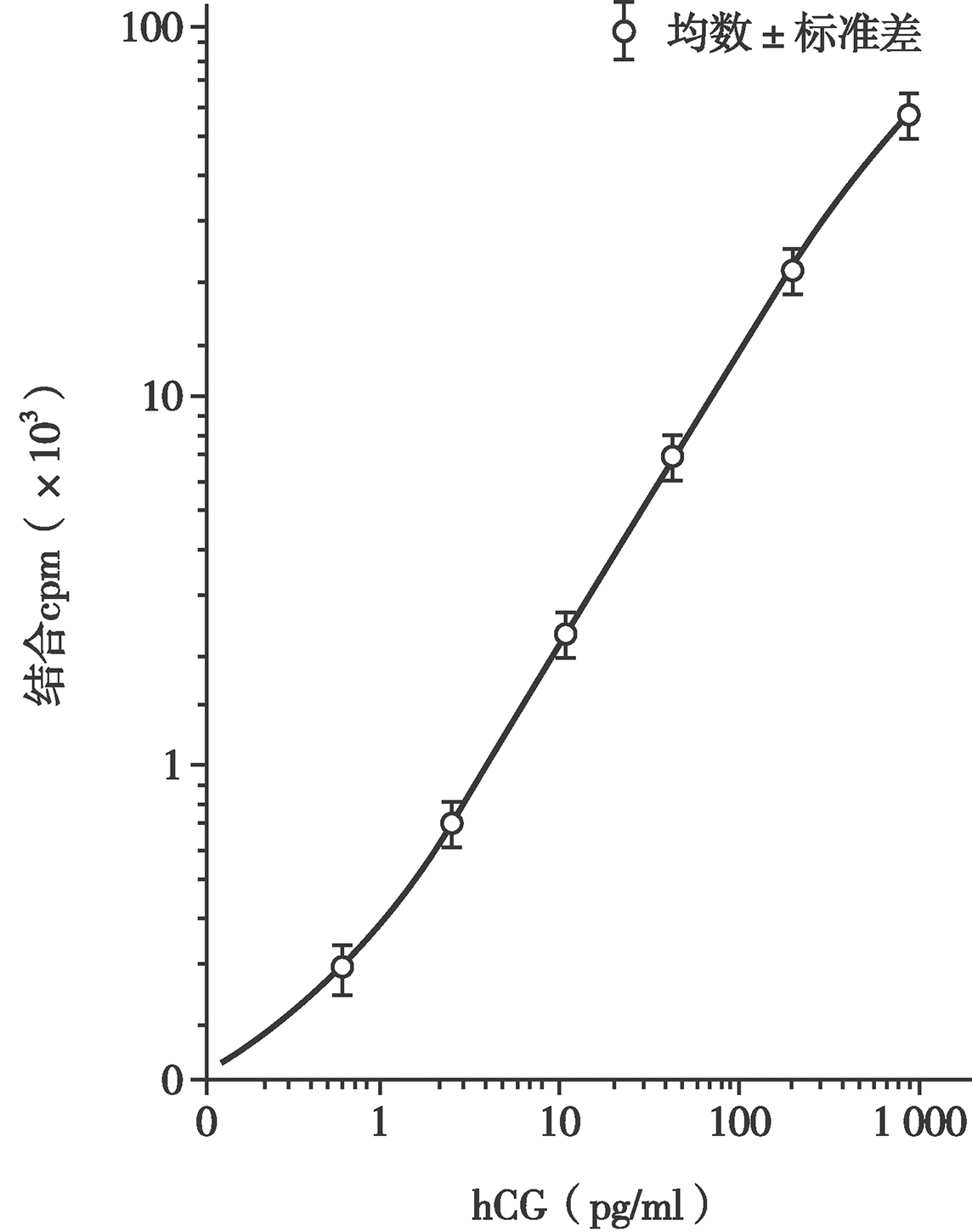
图5 hCG免疫放射分析(IRMA)标准(剂量反应)曲线
三、酶免疫技术
放射免疫(RIA)、免疫反射(IRMA)和放射受体(RRA)等应用放射性核素标记物免疫分析技术的相继问世和推广普及,极大地推动了医学生物学的发展。然而,RIA、IRMA和RRA都有其共同的不足之处:①放射性核素对人体有害,需采取防护措施和防止污染环境;②标记抗原或抗体不论是自己制备或购自厂商,其批间差异较大;③常用的125I标记物的半衰期短,一般只能使用2个月;④测量仪器昂贵等。为避免上述弊端,人们一直在研究开发非放射性核素的免疫分析技术。1971年Engvall和Penlmann及Vanweemen和Schuurs两组学者分别用酶代替放射性同位素制备了酶标记试剂,创立了酶免疫分析技术(EIA)。1975年问世的杂交瘤技术可大量生产抗不同抗原决定簇的单克隆抗体,大大促进EIA的发展,明显提高了EIA的灵敏度和特异性,推动了新一代EIA的设计。现在EIA已发展成形式各异、各有其优点和用途的定位、定量、半定量和超微量分析技术。同RIA、IRMA相比较,EIA除可避免放射性同位素伤害以外,最重要的优点是酶标记物的有效期长,在无菌或防腐的条件下,4℃或冻干室温下保存期可超过一年。后来在EIA中引进放大系统,使测定的灵敏度超过RIA,达到10~19mol/L。在医学和生物学中,EIA的应用越来越广泛,数以千计的EIA诊断药盒已投放市场,取得了极为显著的社会效益。酶是能催化化学反应的特殊蛋白质,其催化效力超过所有人造催化剂。酶一般可使反应加速108~1010倍。酶还具有高度专一的特性,每一种酶只能催化一种或一组密切相关的反应。EIA是将酶催化放大作用和抗原与抗体免疫反应的特异性相结合的一种微量分析技术。酶标记抗体或抗原后,既不影响抗体或抗原的免疫反应的特异性,也不改变酶本身的活性。在EIA系统中,免疫反应进行以后,使酶催化相应的底物水解呈色,再用肉眼观察有无颜色及颜色的深浅进行定性和半定量分析、用光镜或电子显微镜进行组织和细胞及亚细胞定位或用分光光度计测其光密度进行定量分析。呈色反应显示酶的存在,放大了酶量的变化,反应出某种状态(结合或游离)的酶标抗体或抗原量的变化[14]。
酶免疫分析(EIA)一般根据测定过程中是否需要将结合的酶标记物和游离的酶标记物分离而分为均相和非均相两大类。均相测定中由于免疫反应后有酶活性的改变,所以不需将游离和结合的酶标记物分开。非均相则要求分离游离和结合的酶标记物[14]。
(一)均相EIA
在均相EIA中有两种主要的生物物理现象:①与一般免疫检测方法相同,抗体(Ab)可识别并同其相应的抗原(Ag)特异性结合;②酶标抗原(Ag*)同Ab结合后形成Ab-Ag*可使酶的活性增强或减弱;③Ag可同Ag*互相竞争与有限量的抗体结合。因此,不需对反应系统中的Ab-Ag*与Ag*进行分离,直接测定酶活性的变化即可推算出被测样品中Ag的含量。具有上述特点的均相EIA又派生出多种各具特点的分析模式,包括酶增强免疫分析技术、辅基标记免疫分析法(prothetic group labeling immunoassay,PGLIA)、克隆酶供体免疫分析(cloned enzyme donor immunoassay,CEDIA)、底物标记荧光物质免疫分析法(substrate labeling fluorescent immunoassay,SLFIA)等[15]。
酶增强免疫分析技术(enzyme multiplied immunoassay technique,EMIT)是最广泛应用的均相EIA系统,属竞争性结合分析法。在EMIT中,酶标记抗原与抗体结合后,酶活性被抑制,游离的酶标记抗原(具有酶活性)增加。所以,反应液中酶活性随着抗原浓度增加而增加,被称之为酶增强免疫分析技术(EMIT)。最常用的酶是葡萄糖-6-磷酸脱氢酶和溶菌酶。另一种EMIT是酶活性随着抗原浓度的升高而降低,比如:苹果酸脱氢酶(malic dehydrogenase,MDH)标记甲状腺素(thyroxine,T4)后,MDH的立体结构发生了改变,导致酶活性被抑制。但是,T4和T4抗体结合后,可恢复MDH的酶活性。所以,非标记的待测T4和MDH标记的T4互相竞争,同有限量的T4抗体结合,非标记的待测T4浓度越高,意味着标记T4与抗体的结合越少,酶活性越低。
均相EIA由于不需要分离结合和游离的标记抗原,故可以减少因物理分离而引起的误差,其灵敏度为10~9mol/L,主要用于小分子半抗原如药物和小分子激素的测定。它主要缺点是由于没有物理分离结合和游离的标记抗原的步骤,样品中非特异的干扰物质如内源性酶、酶抑制剂及有交叉反应的抗原等容易影响结果。此外,由于均相EIA采用的是竞争性结合的原理,其测定的灵敏度不如非均相的非竞争性的EIA高。
(二)非均相EIA
非均相EIA在免疫反应结束后,需要分离游离和结合的酶标记物,然后才能进行测定,可以分为竞争性和非竞争性两大类。
竞争性非均相EIA包括酶标抗原的EIA和酶标抗体的EIA。酶标抗原的EIA的检测原理和操作步骤与经典的RIA相似,不同的是用酶替代了放射性核素标记抗原,以及将抗体吸附在固相载体上。酶标抗体的EIA是用酶标记抗体作为示踪剂,使标记和未标记的抗体互相竞争同有限量的固相抗原结合,固相抗原结合酶标抗体的量同被测抗体的浓度成反比。测定固相抗原结合的酶标记抗体酶的活性,可以对被测抗体进行定量。可用于测定多种不同的抗体,也可以检测半抗原和药物。其灵敏度与RIA相当。
非竞争性非均相EIA,又称为酶联免疫吸附分析法(enzyme linked immunosorbent assay,ELISA),其特点是:①使用过量的试剂,被测抗原(或抗体)同酶标记抗体(或抗原)及固相抗体(或抗原)的结合反应属非竞争性,酶标记物的结合量与被测物的浓度成正比;②均使用固相分离技术(固相抗体或抗原),不但易于分离结合和游离的酶标记物,而且在测定的每一阶段均易于洗涤,减少了各种物质的干扰;③多数ELISA使用两种抗体,一种固相抗体,一种酶标抗体,被测抗原可同时与两种抗体结合,夹在两种抗体之间,故ELISA又称为夹心EIA[16]。
1.定位酶免疫技术
定位酶免疫技术是应用酶标记的抗体或抗原作为示踪剂,在组织或者细胞上进行抗原-抗体反应及酶底物的呈色反应,通过显微镜观察,在组织、细胞、亚细胞及分子水平对抗原或抗体进行定位或半定量分析。
2.酶免疫分析中的放大系统
在EIA中由于引进了放大系统,使测定的灵敏度有了较大的提高。最常见的是引进生物素-亲和素放大系统的ELISA方法。亲和素对生物素有很高的亲和力。一旦结合,则很难解离。生物素-亲和素系统有高度的稳定性。在ELISA中,使抗体和酶等蛋白质生物素化,即一个蛋白质分子可以结合多个生物素分子。这些生物素化的蛋白质分子一方面保留原来的免疫反应性或酶活性;同时,由于生物素的导入而成为多价,可与多个亲和素分子结合,产生多级放大效应。ELISA和免疫组织化学中应用生物素-亲和素系统,可明显提高分析的灵敏度。从链霉菌培养滤液提纯的链菌亲和素(streptavidin)与亲和素有相似的生物学特征,也可与生物素结合,显著降低非特异吸附,进一步提高检测的灵敏度。
四、荧光免疫分析
荧光免疫测定分析技术(FIA)是将荧光素标记在抗体或者蛋白质抗原上作为示踪物,然后按照免疫学原理,与相应的抗原或抗体结合,检测抗原或者抗体的量。荧光免疫分析技术大多使用荧光素标记抗体,也称为荧光抗体技术。常用的荧光素有异硫氰基荧光素(FITC)。该技术的缺点是存在试剂、血清成分、试管等的本底荧光的干扰和激发光源散发光的问题。于是,人们又研发了采用镧系元素螯合物作为示踪物的荧光免疫测定方法,称为时间分辨荧光免疫分析法(TRFIA)。标记物是镧系元素,如铕、钐等。镧系元素螯合物的荧光有两个特点;激发光谱和发射光谱相差大,发射光谱窄,具有长的荧光寿命。这些特点有效地消除了非特异本底荧光的干扰,提高了荧光信号检测的特异性[1~3]。
五、化学发光免疫分析
化学发光是通过化学反应产生的发光现象,通常是由于氧化反应产生的结果。氧化反应使发光物质分子处于激发状态,当这些分子恢复到基态时,以光的形式释放能量,因此测量发射光的强度可以对某种状态的发光物质进行定量。20世纪60年代即有人以发光物质为示踪剂,利用化学发光测定水样品中细胞的数量,方法灵敏、方便,但特异性较差。1977年开始将化学发光分析与免疫反应结合起来建立了化学发光免疫分析法(chemical labeling immunoassay,CLIA)。CLIA既有化学发光分析的高灵敏性,又有免疫反应的高度特异性,方法简单、快速,对某些物质的检出极限可达10~19mol/L。这是继酶免疫分析法以后发展起来的一种重要的非放射性免疫检测方法[1~3]。
发光剂在化学反应(一般为氧化反应)过程中吸收能量,使本身或某些产物分子处于激发状态,当激发分子恢复到基态时以放射光子形式释放能量,这个过程称为化学发光。化学发光不同于荧光,不需要外来光源激发便能发光。CLIA利用发光剂作为示踪物,在免疫反应以后,标志出某种状态(结合或游离)的免疫反应物的量。发光剂在CLIA的作用如同RIA中的放射性核素、FIA和EIA中的荧光素和酶的作用一样。由于在CLIA中产生化学发光需要发光剂和催化氧化反应的酶,所以CLIA有两类标记的结合物。一类是把化学发光剂标记在抗原或抗体上,免疫反应完成后,加入氧化剂和催化剂(包括氧化酶、H2O2等),产生化学发光,进行终点测量。另一类是将催化氧化反应的酶标记在抗原或抗体上,免疫反应后,加入发光剂和H2O2,产生化学发光,进行终点测量。这类CLIA的实质是酶免疫分析法与化学发光的结合,用化学发光剂代替常规的酶底物,所以又称酶免疫化学发光分析法。常用的氧化酶有辣根过氧化物酶(HRP)和葡萄糖氧化酶及碱性磷酸酶等[1~3]。
常用的化学发光剂有鲁米诺及其衍生物、吖啶酯和草酸酯等,可标记在抗原或抗体上。CLIA的基础是免疫反应,其测定程序与EIA相似,不同的只是标记物和最后的定量方法。CLIA的测定体系像EIA一样可分为均相和非均相两大类。非均相CLA又可分为液相和固相两大亚类,固相的CLIA又有竞争和非竞争、夹心和不夹心等多种形式。
六、抗原、抗体、标准品和标记化合物
(一)抗原
抗原根据有无免疫原性,可分为完全抗原和半抗原两大类。具有免疫原性(抗原性)、可诱发机体特异性免疫应答产生抗体和免疫反应性(反应原性),即能同抗体特异性结合的物质,成为完全抗原。分子量大于2000道尔顿(D)的物质,如:促甲状腺激素(thyroid stimulating hormone,TSH)、HGH、激素受体、甲状腺过氧化物酶以及激素或者受体的自身抗体等均属完全抗原。分子量小于2000D的物质,如:睾酮、甲状腺激素和cAMP等具有免疫反应性,可以同相应的抗体特异性结合,但不具备免疫原性。必须与大分物质如牛血清白蛋白等载体结合后,才能诱发机体产生抗体,称为半抗原。有些分子量大于2000D、免疫原性较弱的多肽或激素,比如胰岛素(分子量5180D)等生物活性物质,也必须与大分子载体连接或者吸附在碳末、乳胶、赖氨酸、羧甲基纤维素或聚甲基丙烯酸甲酯等吸附或者聚合剂上,才能通过提高其免疫原性而得到高质量的抗体。
抗原的特异性是由抗原分子表面的抗原决定簇(结合位点、表位)决定的。这些决定簇实质上是特殊的化学基团,能够通过其空间构型与相应的抗体或淋巴细胞表面的抗原受体特异性结合,这种结合类似于钥匙和锁的匹配。完全抗原的表面有许多抗原决定簇,可分别与不同的抗体或抗原受体结合腔(锁)结合[1~6]。
(二)抗体
在抗原诱导下于B淋巴细胞内合成后分泌到体液中,能与相应的抗原特异性结合并具有激活补体等生物功能的免疫球蛋白(Ig)称为抗体,但并不是所有的Ig都是抗体。
抗体根据重链(H)恒定区(C)分子结构的不同可以分为IgG、IgA、IgM、IgD和IgE。按照与抗原结合后能否出现可见反应,分为完全抗体和不完全抗体。前者包括血清学诊断中常用的凝集素抗体和沉淀素抗体等,后者包括阻抑抗体。阻抑抗体能与抗原结合而不出现可见反应,但能阻止抗原再与完全抗体结合。IgM为完全抗体,IgG为不完全抗体。按获得方式不同,抗体可分为:①天然抗体(自然获得);②获得性抗体(经感染、预防接种或者用胰岛素等蛋白质激素治疗产生的抗体);③自身抗体(在病理情况下,针对自身组织、血液成分等产生的抗体,比如甲状腺过氧化物酶抗体等);④制备抗体(包括单克隆抗体和多克隆)和基因工程抗体。在进行免疫分析时,不论是用单克隆抗体、多克隆抗体还是基因工程产生的抗体都需要对其特异性、亲和性、滴度和稳定性进行鉴定[1~6]。
(三)标记化合物
为了检测及放大抗原和抗体、配体与结合球蛋白或者受体之间的反应结果,绝大多数免疫分析、CPBA或RRA均需用放射性同位素、酶、荧光素或者化学发光剂作为标记物标记抗原、配体或抗体。标记的抗原、配体或者抗体统称为标记化合物,酶标记的抗原或者抗体又称为酶结合物。标记化合物的质量即比活性、免疫反应性(或生物活性)和稳定性同免疫分析、CPBA和RRA的灵敏度和重复性等有很大关系。因此,每一批新的或者保存一段时间以后的标记化合物均需进行质量鉴定,合格后方可继续使用。抗原、配体或者抗体的纯度越高,标记的效果就越好。制备的抗体均需经过亲和层析提纯后才能用于制备标记化合物。3H和125I是最常用的放射性核素标记物,用于RIA、CPBA、RRA和IRMA等免疫测定。由于氢是多种化合物的组成成分,所以3H不明显改变被标记物的分子结构和生物活性。3H半衰期13年,放射活性保留时间长。但是,一般实验室不能制备3H标记的化合物,而且其比放射性低。所以3H一般只用于小分子和甾体类化合物的标记。125I半衰期60天。标记方法简单,大多数实验室可以自己标记,而且比放射性高,因此是常用的放射性核素。酶结合物是EIA的关键试剂,最常用的酶有辣根过氧化物酶(HRP)、葡萄糖氧化酶、碱性磷酸酶、β-D-半乳糖苷酶、葡萄糖-6-磷酸脱氢酶和苹果酸脱氢酶等[1~6]。
(四)标准品
化学结构及结合特性与被测物相同、用于配制标准试剂制作剂量反应(标准)曲线,以用于待测样品中被测物质的定性、半定量和定量的物质称为标准品,其纯度应在95%以上。作为本实验的标准品必须用国家标准或者国际标准核查和比较,证明为同质性并确定其含量,方可应用于临床检测。理论上,标准品和被测物要在完全相同的条件下进行反应。比如测定人血清中某激素的水平,标准品最好用不含该激素的人血清将标准品按倍比梯度稀释5~8个不同的标准浓度。但是由于人血清难以获得,而且价格昂贵,不易去除被测物质。含蛋白质的缓冲体系如牛血清白蛋白(BSA),在证实其稀释效果和去激素的人血清无明显差异后,也可以作为标准品的稀释液。此外,如果激素存在明显的种属差异,也可以用其他种属的血清替代人血清去做标准品稀释。一般标准品中需要加防腐剂。类固醇或者甲状腺素标准品可在4℃保存,而多肽类或蛋白质激素的标准则适宜在−20℃或−40℃冻存,并切忌反复冻融。标准品的计量单位应采用国家剂量单位表示,例如:摩尔每升(mol/L)、毫摩尔每升(mmol/L)。对有国际标准品的品种,一般采用国际单位IU/L或者mIU/L等表示[1~6]。
参考文献
1.史轶蘩.协和内分泌代谢学[M].北京:科学出版社,1999.
2.陈宝荣,朱惠娟.内分泌及代谢性疾病(实用临床检验诊断学丛书)[M].北京:北京科学技术出版社,2014.
3.陆召麟等.内分泌内科学[M].北京:人民卫生出版社,2009.
4.SHLOMO M,KENNETH S. P,P. REED L,et al. Kronenberg. Williams Textbook of Endocrinology[M].12th ed. Philadelphia:Saunders,2012.
5.ZHANG L,ELIAS J E,CHARLES GD B,et al. Handbook of Clinical Pediatric Endocrinology[M]. 2nd ed. Hoboken:John Wiley & Sons,2012.
6.MURRAY R.D.,MELMED S. The Pituitary[M]. Hoboken:John Wiley & Sons,2006.
7.邓洁英,史轶繁,关炳江,等.人血清生长激素的放射免疫测定及其临床应用[J].医学研究通讯,1983,(1):20-22.
8.高素敏,邓洁英,史轶蘩.生长介素的放射免疫测定及初步临床应用[J].中华内分泌代谢杂志,1988,(4):419-425.
9.邓洁英,高素敏,史轶蘩.人血清泌乳素的放射免疫分析法 [J].中华核医学杂志,1990,10(2):115-116.
10.吴从愿.血浆17-羟孕酮竞争性蛋白结合分析法[J].中华医学检验杂志,1981,4(2):84-88.
11.邓洁英,高素敏,何瑞娟,等.血清人生长激素的放射受体测定法[J].中国医学科学院学报,1989,11(5):326
12.周学瀛,刘怀成,孟迅吾,等.不需高效液相层析的1,25-双羟维生素D的放射受体测定法[J].中华内分泌代谢杂志,1989,5(2):103-106.
13.姬金凤,吴从愿.人血清生长激素免疫放射分析法的建立及初步临床应用[J].中华核医学与分子影像杂志,1992,12(4):232-233.
14.ANDERSEN L,DINESEN B,JøRGENSEN PN,et al. Enzyme immunoassay for intact human insulin in serum or plasma[J].Clin Chem,1993,39(4):578-582.
15.L’HERMITE-BALERIAUX M,COPINSCHI G,VAN CAUTER E.Growth hormone assays:early to latest test generations compared[J]. Clin Chem,1996,42(11):1789-1795.
16.KHOSRAVI M J,DIAMANDI A,MISTRY J,et al. Noncompetitive ELISA for human serum insulin-like growth factor-I[J].Clin Chem,1996,42(8 Pt 1):1147.
知识来源
人卫知识数字服务体系
作者:龚凤英教授,中国医学科学院北京协和医院内分泌科
专家简介
龚凤英,医学博士,北京协和医院内分泌科研究员、教授、博士生导师。
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号



 会员登录
会员登录

