程歆琦教授:甲状腺相关激素的测定
与甲状腺癌相关的实验室指标主要包括:①甲状腺滤泡分泌的甲状腺素(thyroxine,T4)和三碘甲腺原氨酸(3,5,3’-triiodothyronine,T3)以及垂体分泌的促甲状腺激素(thyroid stimulating hormone,TSH),主要用于分化型甲状腺癌(differentiated thyroid carcinoma,DTC)患者手术后激素替代治疗时甲状腺功能的监测;②肿瘤相关的标志物,包括甲状腺球蛋白(thyroglobulin,Tg)、甲状腺球蛋白抗体(thyroglobulin antibodies,TgAb)、降钙素(calcitonin,CT)和癌胚抗原(carcinoembryonic antigen,CEA),主要用于甲状腺癌患者的治疗监测和预后判断;③其他指标,包括碘代谢和钙磷代谢的相关指标,主要用于甲状腺癌患者的管理。甲状腺癌患者需要定期检测上述实验室指标,以进行终生的定期治疗监测,以帮助及时发现肿瘤的复发或转移,并根据这些结果合理调整治疗方案。因此临床医师了解上述实验室指标的检测和相关影响因素,对于结果的解读具有重要的意义。
一、甲状腺激素
甲状腺激素包括甲状腺素(T4)和三碘甲腺原氨酸(T3),两者均为酪氨酸含碘衍生物。血浆中99%以上的T3和T4均与血浆蛋白可逆结合,主要的结合蛋白是甲状腺素结合球蛋白(thyroxine-binding globulin,TBG),少部分与白蛋白、前白蛋白(甲状腺素转运蛋白)结合。其余没有和血浆蛋白结合的分别为游离甲状腺素(free thyroxine,FT4)和游离三碘甲腺原氨酸(free 3,5,3’-triiodothyronine,FT3),游离和血浆蛋白结合的 T4、T3之和分别为总甲状腺素(total thyroxine,TT4)、总三碘甲腺原氨酸(total 3,5,3’-triiodothyronine,TT3)。FT4和 FT3分别占TT4和TT3的0.02%~0.05%和0.1%~0.3%,在体内的含量极低,但是仅有FT4和FT3能够进入靶细胞发挥作用,且不受TBG浓度的影响,因此FT4和FT3水平更能真实反映甲状腺功能状态,具有更重要的临床参考价值。
(一)甲状腺激素测定的方法学
目前甲状腺激素检测的主流方法为化学发光法,根据标志物的不同可以分为化学发光免疫分析法(chemiluminescent immunoassay,CLIA)和电化学发光免疫分析法(electrochemiluminescence immunoassay,ECLIA)。CLIA和ECLIA的方法具有灵敏度高、检测范围广、自动化程度高、检测速度快等优势,但由于是基于抗原抗体反应的原理,存在较多的干扰因素,同时不同检测系统使用的抗体来源、针对的抗原表位、包被方式、发光原理等不尽相同,检测结果之间的可比性也不理想。对于治疗监测中的患者,建议使用来自同一实验室的相同检测系统进行监测为宜。
液相色谱串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)方法是基于质荷比的原理检测T3和T4,可以消除各种检测干扰,LC-MS/MS检测TT3和TT4相对比较容易,但是TT3和TT4临床意义有限,FT3和FT4的检测更加重要。但是国内目前还没有应用LC-MS/MS法检测FT3和FT4的方法,一方面是因为LC-MS/MS的设备成本昂贵,手工操作复杂难以自动化,另一方面是因为标本前处理过程中,萃取FT3和FT4时不容易保持FT3、FT4与结合T3、结合T4的动态平衡而影响FT3和FT4测定的准确性。
目前在美国也仅有少数几家实验室如梅奥医学中心(Mayo Clinic)和美国独立实验室Quest可以提供LC-MS/MS检测FT3和FT4的方法,这两个实验室同时提供ECLIA的方法,只有在医师怀疑结果可能受到干扰难以解释时,才申请LC-MS/MS方法检测FT3和FT4。国内外绝大多数医疗机构还是使用基于抗原抗体反应的CLIA和ECLIA方法检测FT3和FT4。
甲状腺激素不同单位之间的换算关系:FT4:ng/dl×12.87=pmol/L;FT3:pg/ml×1.536 =pmol/L;TT4:μg/dl×12.87=nmol/L;TT3:ng/ml×1.536=nmol/L。
(二)甲状腺激素测定标本的选择和保存
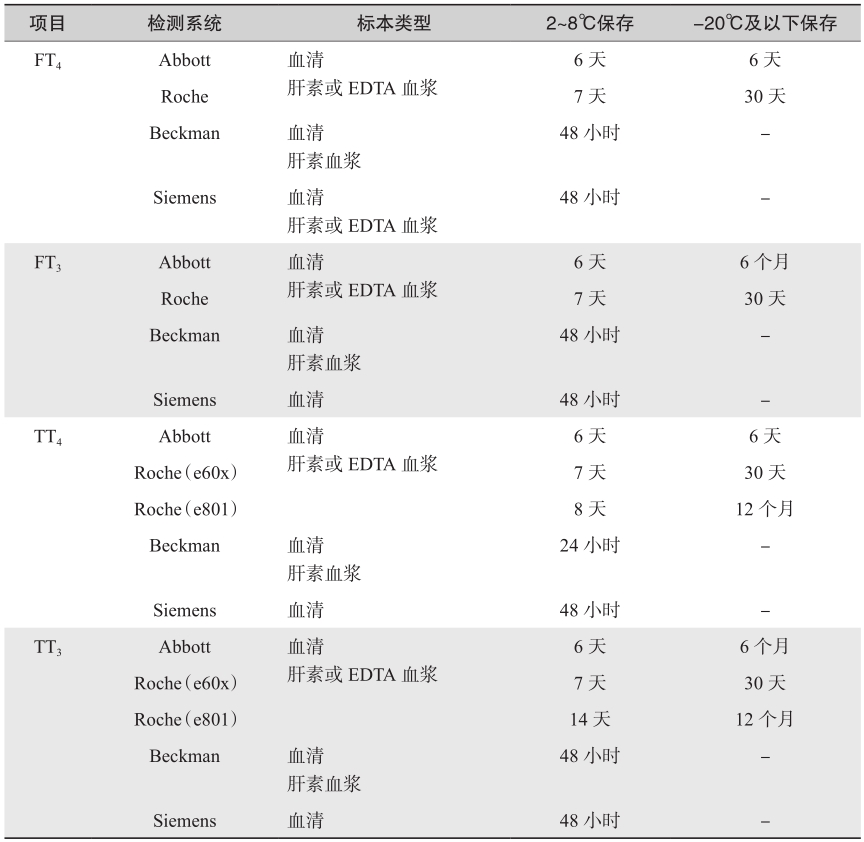
不同检测系统推荐使用的标本类型和标本保存时间不尽相同,通常情况下血清为比较通用的标本类型。表1列出了目前使用较多的不同进口品牌试剂说明书中推荐使用的标本类型和2~8℃、-20℃及以下的标本保存时间供参考。其他检测系统所推荐使用的标本类型和标本保存条件可以参考实验室所使用的检测系统的试剂说明书。
(三)影响甲状腺激素结果的生理因素
1.TBG对于TT 3和TT 4的影响
血清中99%以上的T3和T4与血浆蛋白结合,TBG为最主要的结合蛋白,可以影响TT3和TT4的水平。当血清TBG升高时,TT4和TT3也升高,当血清TBG下降时,TT4和TT3也下降。
血清TBG非特异性升高时多伴有TT3和TT4升高,但FT3和FT4无明显变化,患者一般没有甲状腺功能亢进的表现。主要见于妊娠、口服避孕药、大剂量雌激素治疗、家族性TBG增多症、肝硬化、多发性骨髓瘤等。
表1 甲状腺激素测定使用的标本类型和标本保存条件
血清TBG非特异性降低时多伴有TT3和TT4下降,但FT3和FT4无明显变化,患者一般没有甲状腺功能减退的表现。主要见于大剂量雄激素或糖皮质激素治疗、家族性TBG降低症、肾病综合征、肢端肥大症、失蛋白性肠道疾病等。
此外,TBG缺陷会严重影响TT3和TT4的水平。TBG的缺陷分为TBG过量(患病率1/25 000)和完全或部分TBG的缺陷(患病率分别为1/15 000和1/4 000)。TBG缺陷是X染色体连锁遗传病,在男性患者中完全表达。TBG缺陷使血清中的TT3和TT4的浓度发生改变,但游离甲状腺激素浓度保持不变,因此不会引起甲状腺疾病。
2.性别和年龄
性别对于甲状腺激素的影响,不同的研究结果不一致。但总体来说,男性和女性甲状腺激素水平差异不大,成人男性和女性可以使用相同的甲状腺激素参考区间。
从幼儿期到成人,FT3和FT4的水平均随着年龄的增长而下降。Mayo Clinic对于儿童和青少年均使用了与成年人不同的FT4、TT3和TT4参考区间,具体见表2。同时,Roche、Siemens也提供了儿童和青少年人群的FT3和FT4参考区间。
表2 Mayo Clinic儿童和青少年FT4、TT3和TT4参考区间*
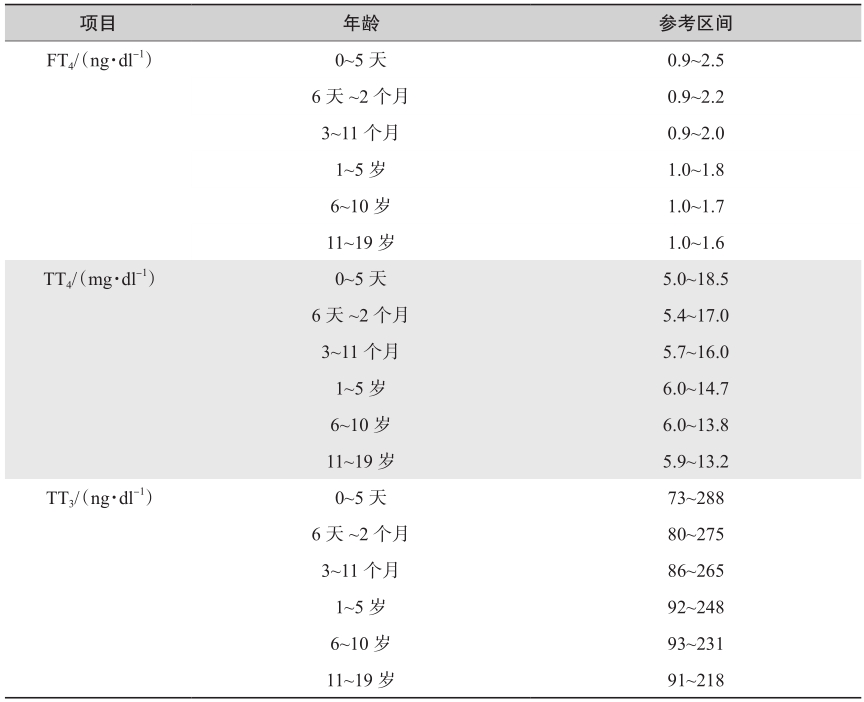
注:*检测方法为电化学发光免疫分析方法。
3.进食
进食对甲状腺激素结果的影响不大,通常情况下,采血测定甲状腺激素及TSH时,不需要空腹。
4.激素替代治疗
通常首剂给药后5个半衰期,药物在体内的浓度可达到稳态浓度,按照左甲状腺素平均半衰期7天计算,体内左甲状腺素达到稳态浓度需要35天,因此检测甲状腺激素时应考虑此因素,建议在首剂给药35天后采血。而一旦调整药物治疗的剂量,则需要再经过35天才能达到新的稳态浓度。另外,甲状腺功能亢进的患者,左甲状腺素的半衰期会缩短至3~4天;甲状腺功能减退时,左甲状腺素的半衰期会延长至9~10天。医师在进行激素替代治疗后选择采血时间和解读相关的结果时,均需要考虑开始治疗、调整治疗剂量的时间以及患者的甲状腺功能状态。
达到稳态浓度后,药物在体内的浓度将在谷浓度和峰浓度之间波动,一般在服药前为谷浓度,口服左甲状腺素5小时后达峰值,通常在服药前采血测定FT4和TT4。而TT3、FT3和TSH则不受服药时间的影响,但如果是与FT4和TT4一起采血测定,则需要在口服药物之前采血。
5.季节
甲状腺激素的分泌是否呈现季节性节律尚存在争议。有研究表明夏季TT3和FT4平均水平显著低于冬季水平,而TT4和FT3水平则几乎不受季节影响。
6.药物
一些药物可影响T3或T4及其结合蛋白之间的平衡,导致游离甲状腺激素浓度的改变。这些药物包括阿司匹林、呋塞米、卡马西平、苯巴比妥、苯妥英、非甾体抗炎药、苯丁酮和肝素等。对健康志愿者和甲状腺功能减退的患者给予肝素后,FT4浓度可在2~15分钟后快速增加,最高可增加5倍。在最后一次使用肝素治疗至少10小时后采血测定甲状腺激素,可以减少相应的影响。
还有些药物可以改变TBG的浓度,如他莫昔芬、雷洛昔芬、雌激素、氟尿嘧啶、氯贝丁酯、美沙酮和米托坦会增加TBG的血清浓度,相反,烟碱酸、天冬酰胺酶、慢性糖皮质激素治疗和雄激素/合成类固醇会抑制TBG的合成。在这种情况下,通常只是改变TT3和TT4的水平,而游离甲状腺激素不受影响。
因此,当甲状腺功能的检测结果不符时,对患者服药史的评估至关重要。
(四)影响甲状腺激素测定的常见干扰因素
甲状腺激素测定的常见干扰因素包括甲状腺激素自身抗体(thyroid hormone autoantibodies,THAAb)、嗜异性抗体、类风湿因子、生物素等。当甲状腺激素不同项目之间或者甲状腺激素各项目与TSH之间的关系无法解释或者甲状腺激素的测定结果与临床不符合或者不同检测系统检测结果相差甚远时,应及时与检验医师联系,以进一步确认是否存在干扰并设法排除。
1.甲状腺激素自身抗体
THAAb是指针对T3和/或T4的一类自身抗体,通常是多克隆的IgG型,在自身免疫性疾病的患者中比较常见。THAAb增多可明显干扰FT3和FT4的测定,也可干扰TT3和TT4的测定,导致临床对患者的误诊误治。THAAb出现在表观健康的人群中的比例小于1.8%,但自身免疫性甲状腺疾病患者中的检出率可高达40%。
在使用多种免疫学方法测定甲状腺激素时,试剂中的标记示踪剂和血清中的甲状腺激素在捕获抗体的标记位点上竞争结合,然而THAAb也可能参与到这一免疫反应中,造成甲状腺激素测定结果假性增高或者降低。但是,并非存在THAAb就一定会干扰检测,多数情况下样本中存在THAAb似乎不会影响甲状腺激素的测定,抗体效价、特异性、亲和性以及检测系统等可能都是决定能否显著影响测定结果的因素。
当甲状腺激素的结果与临床表现不符时,应当怀疑THAAb的存在,检验医师可通过更换检测系统、PEG沉淀、使用LC-MS/MS方法等进一步确认。通常情况下,THAAb并不干扰TSH的测定,此时TSH的结果能够更为可靠地反映甲状腺功能状态。
2.嗜异性抗体
嗜异性抗体是针对特定动物免疫球蛋白或针对各种动物物种的免疫球蛋白的抗体,具体取决于表位和物种间免疫球蛋白的交叉反应性。嗜异性抗体引起的干扰可能导致一种或多种检测系统出现假性降低或假性升高的结果,这取决于反应过程中干扰位点,但通常情况下造成假性升高的情况更加普遍。
正常人产生嗜异性抗体的概率较低,为0.2%~15%。使用单克隆抗体药物治疗的患者、与动物密切接触、注射了含动物免疫球蛋白的疫苗、自身免疫性疾病的患者容易产生嗜异性抗体。可通过嗜异性抗体阻断剂、连续稀释测定和更换不同检测系统重复测定等不同方法搜集干扰的证据。
与TSH相比,FT3和FT4免疫学方法不太容易受到嗜异性抗体的干扰。
3.生物素
生物素(也称维生素H,维生素B7或维生素B8),易溶于水,是能通过肠道细菌来合成脱酸酶的辅因子,也可以从食物中直接获取。成人摄入量一般为30~35μg/d。最近,高剂量生物素(100~300mg/d)已经成功应用于进行性多发性硬化症的试验研究和随机、双盲和安慰剂对照的研究中。生物素可用于罕见的代谢紊乱失调的患者(例如生物素酶缺乏症和丙酸血症中需要10~40mg/d),也可用于脱发的膳食补充剂或者改善指甲和皮肤的纹理( ≤ 20mg/d)。
生物素-链霉亲和素相互作用已经广泛应用于多种双抗体夹心和竞争法的免疫学方法检测。2017年,法国超过50%的实验室使用基于链霉亲和素/生物素的免疫法测定TSH、FT3和FT4。正常饮食摄入生物素的量不会引起检测干扰,据报道干扰剂量在1.5~300mg/d变化。
在竞争法分析测定FT3和FT4时,如果血清中生物素浓度过高,可以与生物素化的抗原抗体复合物竞争结合链霉亲和素包被的磁性颗粒,导致检测信号值错误降低,FT3和FT4的结果假性升高(检测信号值与FT3和FT4的浓度呈反比)。必须注意的是生物素的干扰与检测系统直接相关,即使是使用了生物素-链霉亲和素的检测系统,是否受到干扰及干扰的程序均不相同。
正常情况下,生物素进入体内的半衰期约2小时,大多数人在4~5小时从体内清除。因此口服生物素或含生物素的多元维生素制剂的患者,建议在口服相关制剂12小时后采血。但对于使用大剂量生物素的患者,可能需要停止服用生物素两天以上再进行抽血测定。
二、促甲状腺激素
TSH是腺垂体合成和分泌的糖蛋白,由2种亚基组成。其中β亚基携带TSH特异的免疫学和生物学信息,其α链携带种属特异性信息,与LH、FSH和hCG的α链上具有相同的氨基酸顺序。TSH是下丘脑-垂体-甲状腺调节系统的重要调节激素,主要用于调节甲状腺功能,促进T3和T4的合成和分泌,同时,TSH自身的合成与分泌过程受到T3和T4浓度的负反馈机制调控。
(一)TSH测定的方法学
目前TSH检测的主要方法为化学发光法,根据标志物的不同可以分为 CLIA和ECLIA。目前各检测系统TSH的功能灵敏度均可以达到 < 0.01mU/L,可以满足低水平TSH的检测需求。
同一患者的样本使用不同检测系统测定TSH时,结果存在一定的差异,因此不同检测系统的参考区间也不尽相同。特别是对于非常低的TSH值,如对于低于参考区间下限的TSH结果,不同检测系统间的差异较大。研究结果表明,在低TSH浓度下,不同检测系统之间差异很难用仅基于数学重新校准程序的协调程序来减少。
目前国内外也有TSH相关的即时检验(point-of-care testing,POCT)产品,但是超敏感方法罕见,相应产品的功能灵敏度/定量下限是否能达到临床对于低浓度TSH水平的检测需要还不是很明确。
(二)TSH测定标本的选择和保存
一般情况下,血清和肝素或EDTA抗凝的血浆均可用于TSH检测,以血清较为常用。
不同检测方法声称的标本保存时间不同,通常情况下,分离后的血清或者血浆样本在2~8℃可以保存7天,在-20℃或以下冻存可以保存6个月。具体可以参考实验室使用的检测系统试剂说明书标示的标本稳定性说明。
(三)影响TSH结果的生理因素
1.TSH在人体内的昼夜变化规律
成人血清中的TSH具有明显的昼夜变化节律性。血清中TSH通常在凌晨后达到顶峰,然后开始逐渐下降,至下午3时左右达到最低值,之后开始缓慢升高,于晚上9时开始快速上升至凌晨后再次达到峰值。国内外研究中纳入的男性和女性TSH水平分别为(1.54±0.11)mU/L和(1.36±0.13)mU/L,男性和女性一天内TSH的变化分别为(0.60±0.07)mU/L和(0.51±0.06)mU/L,变化幅度分别为39.0%和37.5%。
目前,TSH的参考区间多来自于采集表观健康人早晨至上午10时之间的静脉血标本测定的TSH结果统计而来。研究显示,上午8时和10时采血测定TSH,结果有明显下降。研究中,从早晨8时到上午10时,受试者TSH水平由2.74(1.69~3.75)mU/L下降至2.07(1.31~3.15)mU/L,下降幅度达到 24.5%。
因此,使用TSH监测患者甲状腺激素替代治疗效果时,应尽量嘱患者清晨8时左右采血,避免10时以后特别是午饭后采血检测TSH。总之,在分析TSH结果时,需要关注采血时间对结果的影响。
2.进食
进食对TSH结果的影响不大,通常情况下,采血测定TSH时,不需要空腹。
3.激素替代治疗
左甲状腺素的半衰期及其对口服治疗开始后激素浓度变化的影响,以及TSH的采血时间见本章前面有关激素替代治疗部分。
4.性别和年龄
TSH随着年龄的增长而增加,特别60岁以上老年人群,可能是65岁以上老年人的正常代偿现象。性别对TSH水平的影响,不同的研究结果不尽相同。但总体来说,性别和年龄对TSH的影响有限,相对于昼夜变化节律对于TSH的影响,性别和年龄的影响可忽略。
5.季节
TSH的分泌是否呈现季节性节律尚存在争议。有研究表明6~8月(夏季),受试者体内的TSH分泌水平明显降低。而春秋两季,受试者体内的TSH水平分泌最高。TSH受季节变化影响,与环境温度和机体的适应能力有关,需要考虑不同地区不同季节的环境温度和变化特点、是否供暖以及生活习惯等因素。
6.药物
一些药物可通过调节下丘脑-垂体-甲状腺轴或通过下游对甲状腺激素转运或代谢产生影响,导致甲状腺功能和状态的改变。静脉输注多巴胺或口服多巴胺激动剂可通过激活垂体甲状腺轴上的D2受体来抑制TSH的分泌。糖皮质激素介导的对下丘脑TRH合成和释放的抑制导致垂体TSH分泌减少。生长抑素类似物(如奥曲肽和兰瑞肽)可通过对垂体甲状腺轴的直接抑制作用来抑制垂体TSH的分泌。二甲双胍会降低糖尿病患者的TSH水平。
7.TSH的个体间变异
TSH的个体间变异即表观健康个体之间TSH水平的差异约为32%,说明基于表观健康人群的参考区间比较宽泛,因此将患者当前的TSH水平与既往历史水平比较,相比和参考区间比较将更有意义。一般认为TSH水平的变化超过0.7mU/L时,具有较明显的临床意义。
8.TSH与FT 4不一致的情况
多种情况时可能出现FT4结果与TSH不一致。通常情况下,TSH比甲状腺激素的变化更敏感,但是对于使用激素替代治疗的患者,当FT4的剂量发生变化时,TSH浓度需要几天甚至几个星期才能达到新的稳定状态,此时,FT4的水平是患者当前甲状腺激素状态的更可靠的指标。
(四)影响TSH测定的常见干扰因素
TSH测定的常见干扰因素包括巨TSH、嗜异性抗体、类风湿因子、生物素等,大多数干扰可使TSH结果假性升高,也有少数情况下使TSH结果假性降低。当TSH测定结果与临床不符合或者不同检测系统TSH结果相差甚远时,应及时与检验医师联系,以进一步确认是否存在干扰并设法排除。
1.巨TSH
巨TSH由单体TSH与自身免疫性抗TSH抗体复合而成,发生率为0.6%~1.6%。巨TSH分子量大,不容易通过肾脏清除,导致TSH水平假性增加。聚乙二醇(PEG)沉淀法可作为筛选或者排除巨TSH干扰的方法。不同检测系统受巨TSH干扰的程度不同,研究发现三种常用的分析系统(Roche、Siemens和Architect)对巨TSH的干扰识别能力是不同的,巨TSH对Architect平台的干扰最小,但仍有60%的巨TSH血清样本受到了干扰。
2.嗜异性抗体
嗜异性抗体的定义及其对免疫学方法检测的干扰,已经在甲状腺激素测定部分进行了阐述。相对于甲状腺激素,TSH的测定更容易受到嗜异性抗体的干扰。1981—2016年报道的嗜异性抗体干扰甲状腺相关激素测定的案例分析中,导致假性升高的大多数都是TSH项目。
确认或者怀疑患者存在嗜异性抗体时应该在临床病例中明确注明,因为这些引起TSH检测干扰的嗜异性抗体可能会在患者体内持续存在一段时间(如4~12个月甚至更长时间)。同时,异嗜性抗体可能通过胎盘,干扰新生儿甲状腺功能的检测。
3.类风湿因子
类风湿因子(rheumatoid factors,RF)是针对人IgG Fc段的自身抗体,但RF不仅可与人IgG结合,与其他种属(如兔、羊、鼠等)的Ig也存在交叉反应。RF与嗜异性抗体干扰TSH测定的机制相似,多使TSH测定结果假性升高,可以用筛选嗜异性抗体干扰的方法进行筛选或者排除。
4.生物素
基于链霉亲和素/生物素的免疫法容易受到大剂量口服生物素的干扰。在TSH双抗体夹心分析测定中,生物素浓度过高时,可以与生物素化的抗原抗体复合物竞争结合链霉亲和素包被的磁性颗粒,导致检测信号值错误降低、TSH水平的错误降低(检测信号值与TSH的浓度成正比)。正常情况下,生物素进入体内的半衰期约2小时,大多数人在4~5小时从体内清除。因此口服生物素或含生物素的多元维生素制剂的患者,建议在口服相关制剂后12小时后采血。但对于使用大剂量生物素的患者,可能需要停止服用生物素两天以上再进行抽血测定。
5.M蛋白
M蛋白即单克隆免疫球蛋白,常见于多发性骨髓瘤和巨球蛋白血症患者。研究报道,一例80岁骨髓增生异常综合征患者,在Abbott AxSYM上检测TSH水平较低,但患者的甲状腺功能正常,更换检测系统对同一样品进行分析测定,结果发现TSH的结果正常。这种干扰可能是因为患有IgG-κ型M蛋白与Abbott AxSYM分析中使用的抗体结合,在空间上阻断了TSH与该抗体的结合,导致假阴性结果的出现。另外一篇报道中,一例具有两条单克隆条带(IgG-λ型和IgM-κ型)的患者,在贝克曼DxI 800检测系统上TSH的测定结果为 > 100mIU/L,但并没有甲状腺功能异常的表现。更换Abbott检测系统进行测定,TSH的水平正常。
知识来源
人卫知识数字服务体系
作者:程歆琦教授,中国医学科学院北京协和医院
专家简介
程歆琦
主任医师 硕士生导师 检验科副主任
擅长:临床化学、定量免疫学检验、实验室管理以及内分泌疾病的实验室诊断。
教育及培训经历:
1993.08-1998.06,就读中国医科大学临床医学专业,医学学士
2002.08-2005.06,就读中国医学科学院北京协和医院,临床检验诊断学专业,医学硕士,导师宋耀虹教授
2018.08-2022.12,就读首都医科大学,临床检验诊断学专业,医学博士(同等学力),导师张国军教授
工作经历:
2005.07至今,入职北京协和医院检验科,历任住院医师、主治医师、副主任医师、主任医师
2008年8月至今,历任检验科生化免疫组组长、内分泌组组长、西院综合组组长
2021年7月至2022年8月,参加中组部第七批组团式医疗人才援藏,任西藏自治区人民医院检验科援藏主任
2023.09至今,北京协和医院检验科,副主任
社会工作:
1.现任《Practical Laboratory Medicine》杂志编委
2.现任《中华检验医学杂志》通讯编委
3.现任中国合格评定国家认可委员会ISO15189医学实验室认可评审员;
4.现任中国分析测试协会标记免疫分析专业委员会常委;
5.现任中国老年医学学会检验医学分会常委;
6.现任中国医学装备协会检验医学分会委员;
7.现任中国临床肿瘤学会(CSCO)甲状腺癌专家委员会委员;
8.现任中国生物化学与分子生物学会脂质与脂蛋白专业分会委员;
9.现任中国研究型医院学会甲状旁腺及骨代谢疾病专业委员会委员;
10.现任中国医师协会全国医师定期考核检验专业编辑委员会委员;
主持课题:
主持省部级以上科研课题3项,纵向课题多项,参与国家级、省部级课题多项。
科研成就:
Clin Chem、Clin Chem Lab MED、Clin Chim ACTA、Clin Biochem等杂志以第一作者和通讯作者(含共同)发表SCI文章34篇,累积影响因子144.86,最高影响因子12.167。
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号



 会员登录
会员登录

