骨髓增生异常综合征诊断与治疗中国专家共识(2014 年版)
骨髓增生异常综合征 (myelodysplastic syndromes,MDS) 是起源于造血干细胞的一组异质性髓系克隆性疾病,特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,高风险向急性髓系白血病 (AML) 转化。
为进一步提高我国 MDS 的诊治水平,中华医学会血液学分会在《骨髓增生异常综合征诊断与治疗专家共识(2012)》的基础上,结合近年来 MDS 领域的最新临床研究成果和国内的实际情况,达成以下共识。
一、诊断
1.诊断标准:MDS 诊断需满足两个必要条件和一个确定标准。
(1) 必要条件:①持续一系或多系血细胞减少:红细胞 (HGB<110 g/L)、中性粒细胞 [中性粒细胞绝对计数 (ANC)<1.5×109/L]、血小板 (PLT<100×109/L);②排除其他可以导致血细胞减少和发育异常的造血及非造血系统疾患。
(2) 确定标准:①发育异常:骨髓涂片中红细胞系、粒细胞系、巨核细胞系中发育异常细胞的比例≥10%;②环状铁粒幼红细胞占有核红细胞比例≥15%;③原始细胞:骨髓涂片中达 5%~19%;④MDS 常见染色体异常。
(3) 辅助标准:①流式细胞术检查结果显示骨髓细胞表型异常,提示红细胞系和(或)髓系存在单克隆细胞群;②遗传学分析提示存在明确的单克隆细胞群;③骨髓和(或)外周血中祖细胞的 CFU(±集簇)形成显著和持久减少。
当患者符合必要条件、未达确定标准(不典型的染色体异常、发育异常细胞 < 10%、原始细胞比例≤4% 等)、存在输血依赖的大细胞性贫血等常见 MDS 临床表现、临床表现高度疑似 MDS 时,应进行 MDS 辅助诊断标准的检测。符合者基本为伴有骨髓功能衰竭的克隆性髓系疾病,此类患者诊断为高度疑似 MDS。
若辅助检测未能够进行,或结果呈阴性,则对患者进行随访,或暂时归为意义未明的特发性血细胞减少症(idiopathic cytopenia of undetermined significance,ICUS)。部分 ICUS 可逐渐发展为典型 MDS,因此应严密监测,随访过程中如患者出现典型的细胞遗传学异常,即使仍然缺乏原始细胞增加及细胞发育异常的表现,应诊断为 MDS。
2.MDS 的鉴别诊断:MDS 的诊断依赖于骨髓细胞分析中所发现细胞发育异常的形态学表现、原始细胞比例升高和细胞遗传学异常。MDS 的诊断一定程度上仍然是排除性诊断,应首先排除其他可能导致反应性血细胞减少或细胞发育异常的因素或疾病,常见需要与 MDS 鉴别的因素或疾病包括:
①维生素 B12 和叶酸缺乏;
②接受细胞毒性药物、细胞因子治疗或接触有血液毒性的化学制品或生物制剂等;
③慢性病性贫血(感染、非感染性炎症或肿瘤)、慢性肝病、HIV 感染;
④自身免疫性血细胞减少、甲状腺功能减退或其他甲状腺疾病;
⑤重金属中毒、过度饮酒;
⑥其他可累及造血干细胞的疾病,如再生障碍性贫血、原发性骨髓纤维化(尤其需要与伴有纤维化的 MDS 相鉴别)、大颗粒淋巴细胞白血病 (LGL)、阵发性睡眠性血红蛋白尿症(PNH)、急性白血病[尤其是伴有血细胞发育异常的形态学特点的患者或急性髓系白血病(AML)-M7] 及其他先天性或遗传性血液病(如先天性红细胞生成异常性贫血、遗传性铁粒幼细胞性贫血、先天性角化不良、范可尼贫血、先天性中性粒细胞减少症和先天性纯红细胞再生障碍性贫血等)。
3.MDS 的诊断方法:MDS 诊断依赖于多种实验室检测技术的综合使用,其中骨髓细胞形态学和细胞遗传学检测技术是 MDS 诊断的核心。MDS 的主要诊断方法见表 1。

4.细胞形态学检测:MDS 患者外周血和骨髓的形态学异常分为两类:原始细胞比例增高和细胞发育异常。其中原始细胞可分为 2 型:I 型为无嗜天青颗粒的原始细胞;Ⅱ型为含有嗜天青颗粒但未出现核旁高尔基区的原始细胞,出现核旁高尔基区者则判断为早幼粒细胞。典型的 MDS 患者,发育异常细胞占相应系列细胞的比例≥10%。拟诊 MDS 患者均应进行骨髓铁染色计数环形铁粒幼红细胞,其定义为幼红细胞胞质内蓝色颗粒在 5 颗以上且围绕核周 1/3 以上者。
所有怀疑为 MDS 的患者均应接受骨髓病理活检,通常在髂后上棘取骨髓组织,长度不少于 1.5 cm。骨髓病理活检有助于排除其他可能导致血细胞减少的因素或疾病,并提供患者骨髓内细胞增生程度、巨核细胞数量、原始细胞群体、骨髓纤维化及肿瘤骨髓转移等重要信息。怀疑为 MDS 的患者建议进行 Gomori 银染色和原位免疫组化 (immunohisto-chemical,IHC),常用的检测标志包括 CD34、MPO、GPA、CD61、CD42、CD68、CD20 和 CD3.
5.细胞遗传学检测:所有怀疑 MDS 的患者均应进行染色体核型检测,通常需分析≥20 个骨髓细胞的中期分裂象,并按照《人类细胞遗传学国际命名体制 (ISCN)2013》进行核型描述。40%~60% 的 MDS 患者具有非随机的染色体异常,其中以 - 5/5 q-、- 7/7q-、+8、20q- 和 -Y 最为多见。
MDS 患者常见的染色体异常中,部分异常具有特异性诊断价值,包括 - 7/7q-、- 5/5q-、i(17q)/t (17p)、- 13/13q-、llq-、12p-/t (12p)、9q-、idic (X) (q13)、t(11;16) (q23;p13.3)、t (3; 21) (q26.2; q22.1)、t(1;3)(p36.3; q21.2)、t(2; 11)(p21;q23)、inv (3) (q21;q26.2) 和 t(6;9) (p23;q34)。
而 +8、20q- 和 -Y 亦可见于再生障碍性贫血及其他非克隆性血细胞减少疾病,部分伴有单纯 +8、20q- 或 -Y 的患者免疫抑制治疗有效,且长期随访未出现提示 MDS 的形态学依据。形态学未达到标准(一系或多系细胞发育异常比例 <10%)、但同时伴有持续性血细胞减少的患者,如检出具有 MDS 诊断价值的细胞遗传学异常,应诊断为 MDS 不能分类 (MDS-U)。
应用针对 MDS 常见异常的组套探针进行 FISH 检测,可提高部分 MDS 患者细胞遗传学异常检出率。因此,对疑似 MDS 者,骨髓干抽、无中期分裂相、分裂相质量差或可分析中期分裂相 <20 个时,可进行 FISH 检测,通常探针应包括:Sq31、CEP7、7q31、CEP8、20q、CEPY 和 p53。
6.流式细胞术检测:目前尚未发现 MDS 特异性的抗原标志或标志组合,但流式细胞术对于低危 MDS 与非克隆性血细胞减少症的鉴别诊断有应用价值。对于无典型形态、细胞遗传学证据、无法确诊 MDS 的患者,流式细胞术检测有≥3 个异常抗原标志,提示 MDS 的可能。
7.分子遗传学检测:单核苷酸多态性微阵列 (SNP-array) 等基因芯片技术可以在多数 MDS 患者中检测出 DNA 拷贝数异常和单亲二倍体,从而进一步提高 MDS 患者细胞遗传学异常的检出率。在有条件的单位,SNP-array 可作为常规核型分析的有益补充。
随着基因芯片、第二代基因测序等高通量技术的广泛应用,多数 MDS 患者中可检出体细胞性基因突变,常见突变包括 TET2、RUNX1、ASXL1、DNMT3A、EZH2、N-RAS/K-RAS、SF381 等。对常见基因突变进行检测对于 MDS 的诊断有潜在的应用价值。
二、分型建议
1.FAB 分型:1982 年 FAB 协作组提出以形态学为基础的 MDS 分型体系(表 2),主要根据 MDS 患者外周血和骨髓细胞发育异常的特征,特别是原始细胞比例、环形铁粒幼细胞比例、Auer 小体及外周血单核细胞数量,将 MDS 分为 5 型:难治性贫血 (refractory anemia,RA)、环形铁粒幼红细胞性难治性贫血(RA with ringed sideroblasts,RAS)、难治性贫血伴原始细胞增多 (RA with excess blasts,RAEB)、难治性贫血伴原始细胞增多转化型 (RAEB in transformation,RAEB-t)、慢性粒一单核细胞白血病 (chronic myelomonocytic leukemia,CMML)。

2.WHO (2008) 分型:1997 年 WHO 开始修订 MDS 的 FAB 分型方案。2008 年 WHO 推出了修订的 MDS 分型方案 (WH0 2008)(表 3)。目前,WH0 2008 分型已被广泛接受,MDS 患者均应按照 WH0 2008 分型方案进行诊断分类。
与 FAB 分型相比,主要包括以下变化:①将诊断 AML 的骨髓原始细胞比例阈值由 30% 降至 20%,将 RAEB-t 亚型并入 AML;②增加了难治性血细胞减少伴单系发育异常的亚型 (RCUD);③将 CMML 划分入 1 个新的髓系肿瘤类别 MDS/ 骨髓增殖性肿瘤(MPN);④增加 1 个以 5q- 为分类特征的亚类:伴有单纯 5q- 的 MDS;⑤将伴有多系发育异常的环形铁粒幼细胞(RCMD-RS) 归人 RCMD;⑥根据外周血和骨髓的原始细胞比例将 RAEB 分为 RAEB-1 和 RAEB-2。

三、预后分组
1.国际预后评分系统 (IPSS):IPSS 基于 FAB 分型,可评估患者的自然病程。危险度的分级根据以下 3 个因素确定:原始细胞百分比、血细胞减少的程度和骨髓的细胞遗传学特征(表 4)。
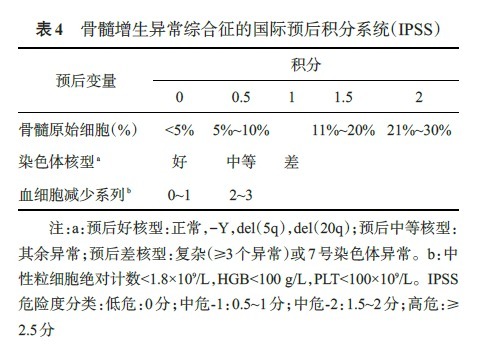
2.修订的 IPSS(IPSS-R):2012 年,MDS 预后国际工作组依据 5 个 MDS 数据库,共 7012 例 MDS 患者的研究结果,对 IPSS 预后评分系统进行了修订,对染色体核型、骨髓原始细胞数和血细胞减少程度进行了细化分组积分(表 5)。核型分析结果是 IPSS-R 分类最重要的参数,共分为 5 个级别。
3.基于 WHO 分类的预后评分系统 (WPSS):红细胞输注依赖及铁超负荷不仅导致器官损害,也可直接损害造血系统功能,从而可能影响 MDS 患者的自然病程。2011 年修订的 WPSS 预后评分系统将评分依据中的红细胞输注依赖改为血红蛋白水平。WPSS 作为一个时间连续性的评价系统,可在患者病程中的任何阶段对预后进行评估(表 6)。
四、治疗
MDS 患者自然病程和预后的差异性很大,治疗宜个体化。应根据 MDS 患者的预后分组,同时结合患者年龄、体能状况、治疗依从性等进行综合分析,选择治疗方案。MDS 患者可按预后分组系统分为两组:相对低危组(IPSS- 低危组、中危 -1 组,IPSS-R- 极低危组、低危组和中危组,WPSS- 极低危组、低危组和中危组)和相对高危组(IPSS- 中危 -2 组、高危组,IPSS-R- 中危组、高危组和极高危组,WPSS- 高危组和极高危组)。
IPSS-R- 中危组患者根据其他预后因素如发病年龄、体能状况、血清铁蛋白水平和 LDH 水平决定采取相对低危组或相对高危组方案,且对低危方案疗效不佳者亦可采用高危组治疗方案。低危组 MDS 患者的治疗目标是改善造血、提高生活质量(图 1),高危组 MDS 治疗目标是延缓疾病进展、延长生存期和治愈(图 2)。
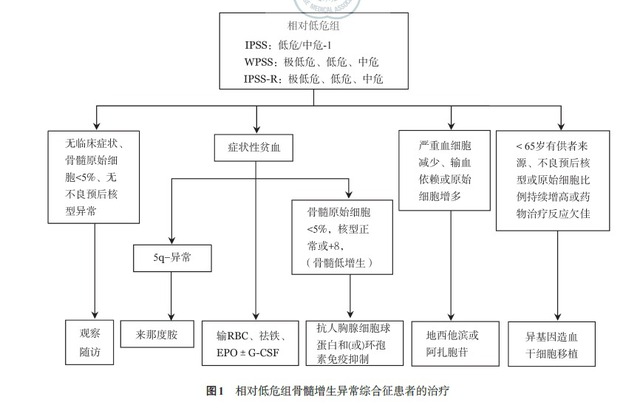
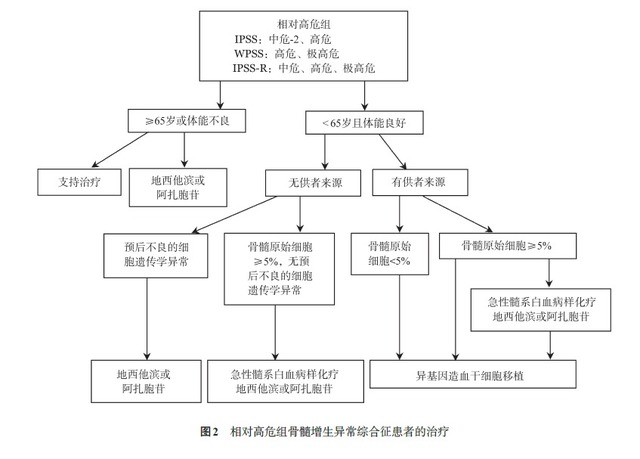
1.支持治疗:支持治疗最主要目标为提升患者生活质量。包括输血、EPO、G-CSF 或 GM-CSF 和祛铁治疗。
(1) 成分输血:一般在 HGB<60 g/L 或伴有明显贫血症状时可给予红细胞输注。患者为老年、机体代偿能力受限、需氧量增加时,可放宽输注指征。PLT<10x 109/L 或有活动性出血时,应给予血小板输注。
(2) 造血生长因子:G-CSF/GM-CSF 推荐用于中性粒细胞缺乏且伴有反复或持续性感染的 MDS 患者。
输血依赖的相对低危组 MDS 患者可采用 EPO±G-CSF 治疗,治疗前 EPO 水平 <500 U/L 和红细胞输注依赖较轻(每月 <4 U)的 MDS 患者 EPO 治疗反应率更高。
(3)祛铁治疗:接受输血治疗、特别是红细胞输注依赖患者,可出现铁超负荷,并导致输血依赖 MDS 患者的生存期缩短。此外,铁超负荷亦可导致接受异基因造血干细胞移植 (allo-HSCT) 的 MDS 患者生存率下降。
因此,对于红细胞输注依赖的患者应定期监测血清铁蛋白 (SF) 水平、累计输血量和器官功能(心、肝、胰腺),评价铁超负荷程度。祛铁治疗可有效降低 SF 水平及器官中的铁含量。SF>1000 ug/L 的 MDS 患者可接受祛铁治疗。常用的祛铁药物有去铁胺和地拉罗司等。
2.免疫调节治疗:常用的免疫调节药物包括沙利度胺 (thalidomide) 和来那度胺 (lenalidomide) 等。部分患者接受沙利度胺治疗后可改善红系造血,减轻或脱离输血依赖,然而患者常难以耐受长期应用沙利度胺治疗后出现的神经毒性等不良反应。对于伴有 5q- 的 IPSS- 低危或中危 1 组 MDS 患者,如存在输血依赖性贫血、且对细胞因子治疗效果不佳,可应用来那度胺治疗,部分患者可减轻或脱离输血依赖,并获得细胞遗传学缓解,生存期延长。
来那度胺的常用剂量为 10 mg/d x 21d,28d 为 1 个疗程。伴有 5q- 的 MDS 患者,如出现下列情况不建议应用来那度胺:骨髓原始细胞比例 >5%;复杂染色体异常;IPSS- 中危 2 或高危组;检出 p53 基因突变。
3.去甲基化药物:常用的去甲基化药物包括 5- 阿扎 -2- 脱氧胞苷(decitabine,地西他滨)和 5- 阿扎胞苷 (azacitidine,AZA)。去甲基化药物可应用于相对高危组 MDS 患者,与支持治疗组相比,去甲基化药物治疗组可降低患者向 AML 进展的风险、改善生存。
相对低危组 MDS 患者如出现严重血细胞减少和(或)输血依赖,也可应用去甲基化药物治疗,以改善血细胞减少、减轻或脱离输血依赖。
(1) 地西他滨:推荐剂量为 20 mg∙m-2∙d-1x5 d,28 d 为 1 个疗程。推荐 MDS 患者接受地西他滨治疗 4~6 个疗程后评价治疗反应,有效患者可持续使用。
(2)AZA: 推荐用法为 75 mg m-2∙d-1x7d,皮下注射或静脉输注,28d 为 1 疗程。接受 AZA 治疗的 MDS 患者,首次获得治疗反应的中位时间为 3 个疗程,约 90% 治疗有效的患者在 6 个疗程内获得治疗反应。因此,推荐 MDS 患者接受 AZA 治疗 6 个疗程后评价治疗反应,有效患者可持续使用。
4.化疗:相对高危组尤其是原始细胞比例增高的患者预后较差,化疗是其治疗方式之一,但标准 AML 诱导方案完全缓解率低、缓解时间短,且高龄患者常难以耐受,小剂量阿糖胞苷的缓解率亦仅有 30% 左右。预激方案为小剂量阿糖胞苷(10 mg/m2,每 12 h1 次,皮下注射,x14 d)基础上加用 G-CSF,并联合阿克拉霉素或高三尖杉酯碱或去甲氧柔红霉素。
预激方案在国内广泛应用于相对高危组 MDS 患者,治疗相对高危组 MDS 患者的完全缓解率可达 40%~60%,且老年或身体机能较差的患者对预激方案的耐受性优于常规 AML 化疗方案。
5.allo-HSCT:allo-HSCT 是目前唯一能根治 MDS 的方法,造血干细胞来源包括同胞全相合供者、非血缘供者和单倍型相合血缘供者。
allo-HSCT 的适应证:①年龄 <65 岁、相对高危组 MDS 患者;②年龄 <65 岁、伴有严重血细胞减少、经其他治疗无效的中低危患者。拟行 allo-HSCT 的患者,如骨髓原始细胞≥5%,在等待移植的过程中可应用化疗或联合去甲基化药物桥接 allo-HSCT,但不应该耽误移植的进行。
6.免疫抑制治疗 (IST):IST 即抗胸腺细胞球蛋白单药或联合环孢素治疗,可考虑用于具备下列条件的患者:≤60 岁的 IPSS 低危或中危 -1、骨髓原始细胞比例 <5% 或骨髓增生低下、正常核型或单纯 +8、存在输血依赖、HLA-DR15 或存在 PNH 克隆。
五、疗效和随访
MDS 国际工作组 (International Working Group,IWG) 于 2000 年提出国际统一疗效标准,2006 年又进一步修订,使不同临床治疗方案结果间具有可比性。MDS 的治疗反应包括以下四种类型:改变疾病的自然病程、细胞遗传学反应、血液学改善和改善生存质量(表 7)。

参加共识讨论的专家:苏州大学附属第一医院(阮长耿、吴德沛、孙爱宁、陈苏宁);北京大学人民医院(黄晓军、赖悦云);中国医学科学院血液病医院(肖志坚);上海交通大学医学院附属瑞金医院(李军民);华中科技大学附属协和医院(胡豫);天津医科大学总医院(邵宗鸿);浙江大学附属第一医院(金洁);山东大学齐鲁医院(侯明);上海第六人民医院(李晓);福建医科大学附属协和医院(胡建达);南京医科大学第一附属医院(李建勇);华中科技大学附属同济医院(周剑峰);四川大学华西医院(刘霆);兰州大学第二医院(张连生);河南省肿瘤医院(宋永平);山西医科大学第二医院(杨林花);大连医科大学附属第一医院(方美云);中山大学附属第一医院(李娟);广东省人民医院(杜欣);西安交通大学第一医院(张梅);吉林大学第一医院(李薇);广西医科大学附属第一医院(赖永榕);第三军医大学新桥医院(张曦);徐州医学院附属医院(徐开林);南京鼓楼医院(欧阳健)
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号



 会员登录
会员登录

