【肺癌报告2020】王志杰教授:免疫治疗剿杀肺癌原理的研究进展
【摘要】近年来,针对全身免疫系统的免疫治疗,尤其是免疫检查点抑制剂,使肺癌诊疗发生了革命性的变化,但免疫检查点抑制剂在临床应用中尚存在诸多问题和挑战,如获益人群有限、治疗相关的副作用及治疗耐药等。故为进一步优化免疫检查点抑制剂的治疗策略及扩展免疫检查点抑制剂治疗的适宜人群,了解免疫检查点抑制剂的作用机理及耐药机理至关重要。本文将重点围绕以上两个方面进行综述。
【关键词】肺癌;免疫检查点;免疫检查点抑制剂;作用机理;耐药机理
Research progress in immunotherapy mechanism of lung cancer
WangZhi-jie (Department of Oncology, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China)
【Abstract】In recent years, immunotherapy targeting the systemic immune system, especially checkpoint inhibitors, has revolutionized the diagnosis and treatment of lung cancer,however, there are still many problems and challenges in clinical application of immune checkpoint inhibitors,such as limited benefit population, treatment-related adverse effects and treatment resistance.Therefore, in order to further optimize the treatment strategy of immune checkpoint inhibitors and expand the appropriate population for immune checkpoint inhibitors, it is essential to understand the mechanism of action and drug resistance of immune checkpoint inhibitors.This article will focus on the above two aspects to summarize.
【Key words】Lung cancer;immune checkpoint; immune checkpoint inhibitors;mechanism of action; mechanism of resistance
众所周知,恶性肿瘤已成为我国乃至全球的重大公共卫生事件之一,对公众健康已构成了重大威胁,据世界卫生组织2018年全球恶性肿瘤发病死亡不完全统计数据,肺癌在全球恶性肿瘤中的发病率及死亡率均位列第一,分别占11.60%、18.40%[1]。由于肺癌是一种分子异质性疾病,了解其生物学特性对肺癌诊疗水平的提高至关重要,且随着肿瘤分子诊断技术日新月异的发展及不断进步,肺癌的诊疗模式已逐渐从经验性的单一放化疗转变为基于患者基因组特征的精细化的多学科综合诊疗模式[2, 3]。
纵观肺癌的诊疗发展历程,基于免疫检查点抑制剂(ICIs)的免疫治疗已经广泛应用于临床实践[4]。然而,单药使用获益人群仍十分有限,即便联合使用仍有相当一部分患者无法获益,且在有效应答的患者中大部分会发生继发耐药,故进一步优化免疫治疗策略仍是一个巨大挑战[5]。本文将简要概述免疫检查点及围绕ICIs治疗的作用机理及其耐药机制进行综述,旨在为优化ICIs的治疗方案及新的治疗靶点的探索提供一定思路。
一、肿瘤免疫编辑学说
在阐述ICIs的作用原理与耐药机制之前,了解肿瘤和机体免疫系统在肿瘤发生发展过程中的持续相互作用尤为重要[2]。根据肿瘤免疫编辑学说,人体免疫系统极其复杂,其对肿瘤来说犹如一把双刃剑,一方面,免疫系统具有免疫监视功能,其可识别和清除体内突变的肿瘤细胞,介导抗肿瘤免疫反应;而另一方面,免疫系统可通过重塑一些肿瘤细胞的生物学特性促进肿瘤发展[6]。
肿瘤与免疫系统的相互作用主要通过三个阶段进行,即“清除”、“平衡”和“逃逸”[6-8]。具体来说,在清除阶段,机体的先天性和适应性免疫系统将协同识别、监视并清除体内转化的绝大多数肿瘤细胞,但仍有少数存活下来的肿瘤亚克隆进入平衡阶段,在此阶段中,肿瘤细胞的免疫原性减弱,较难被机体的免疫系统识别并清除,但由于受到免疫系统牵制,肿瘤生长也极为有限,且弱免疫原性的肿瘤细胞可与免疫系统达到数十年甚至终生的动态平衡。然而,肿瘤细胞并非一成不变,其具有基因组不稳定性,加之在机体适应性免疫系统的持续施压下,一些免疫原性弱的肿瘤亚克隆将通过多种机制逃逸免疫系统攻击,且在免疫选择下不断克隆增殖,进一步发展为临床上可见的肿瘤[6, 9]。
毋庸置疑,肿瘤免疫编辑学说较全面地阐述了肿瘤细胞与机体免疫系统之间的相互作用,该学说亦是迄今为止唯一的肿瘤免疫逃逸系统性理论,对肿瘤免疫治疗具有举足轻重的指导意义[10]。基于对肿瘤免疫编辑学说的认识,近十年来,靶向免疫检查点的免疫疗法成为肺癌免疫治疗历史上的里程碑事件,且已成功应用于临床。值得一提的是,肿瘤免疫编辑学说不仅发生在肿瘤的自然发展过程中,在ICIs治疗过程中也存在动态变化[9, 10]。
二、免疫检查点
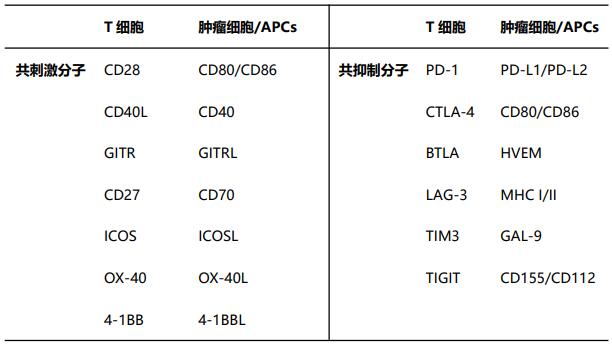
那么到底何为免疫检查点?其在机体免疫系统中又充当什么角色呢?实际上免疫检查点相当于机体免疫系统的“刹车”,是表达于免疫细胞上的表面受体,可通过一系列共刺激分子和共抑制分子调控T淋巴细胞的活化程度[11, 12]。表1回顾了影响T细胞活化的共刺激分子及共抑制分子。
由于T细胞产生免疫应答需要双重信号,第一信号来自于肿瘤细胞释放的抗原,其可被抗原提呈细胞(APCs)表面的主要组织相容性复合体分子(MHC)识别、加工,且APCs以MHC-抗原肽的形式与T细胞受体(TCR)特异性结合,在此过程中,CD4+T细胞释放的一些细胞因子也进一步促进了CD8+T细胞的启动,此过程通常发生在机体远处的淋巴组织中[13, 14];而T细胞活化的第二信号则由APCs表面的共刺激分子与T细胞表面相应配体的相互作用(如CD80/CD28和CD86/CD28)提供[15, 16]。T细胞接受双重信号后,其将完全活化、增殖、分化、迁移并浸润到肿瘤组织,从而在肿瘤部位发挥抗肿瘤作用[17]。
但另一方面,为了避免过度激活的T细胞损害机体正常细胞,T细胞表面也会上调某些免疫抑制性调节受体的表达,如细胞毒性T淋巴细胞相关抗原4(CTLA-4)和程序性死亡受体1(PD-1)等,这些抑制性调节受体与其相应的配体结合后将抑制T细胞增殖,进一步调节免疫应答的时间和幅度[18]。
综上,免疫检查点在调节机体的抗肿瘤作用及维持自身免疫耐受方面起着至关重要的作用[15, 19]。
表1 影响T细胞活化的共刺激分子及共抑制分子
三、免疫检查点抑制剂作用机理
基于对免疫检查点的认识,ICIs应运而生。由于肿瘤细胞可利用免疫检查点的抑制性信号通路逃逸T细胞的免疫应答[16],故ICIs的作用机理主要是通过干扰肿瘤细胞和T细胞之间的关键抑制蛋白/配体的相互作用,使T细胞重新激活并建立有效的抗肿瘤应答,从而调动机体的免疫系统攻击肿瘤细胞[13]。由此可见,ICIs并非直接杀死肿瘤细胞,而是利用宿主免疫系统来重新增强内源性抗肿瘤活性[14]。
迄今为止,ICIs已广泛应用于肺癌临床治疗中,其中最具发展前景的当属PD-1/PD-L1(程序性死亡受体配体1)抑制剂和CTLA-4抑制剂,如帕博利珠单抗(PD-1抑制剂)、纳武利尤单抗(PD-1抑制剂)、阿替利珠单抗(PD-L1抑制剂)、度伐利尤单抗(PD-L1抑制剂)、卡瑞利珠单抗(PD-1抑制剂)、信迪利单抗(PD-1抑制剂)、特瑞普利单抗(PD-1抑制剂)以及替雷利珠单抗(PD-1抑制剂)[20],但CTLA-4抑制剂在肺癌中的应用价值目前仍在进一步探索中[16]。下文将简要介绍PD-1和CTLA-4信号通路及其相关抑制剂的作用机理。
1.PD-1信号通路及PD-1/PD-L1抑制剂的作用机理
PD-1主要在活化及耗竭的T细胞上表达,但其也可表达于自然杀伤细胞(NK细胞)、B淋巴细胞、髓源性抑制细胞(MDSCs)等免疫细胞,PD-1的配体即PD-L1和PD-L2则通常在肿瘤细胞上表达[18, 19, 21]。如前文所述,在第一信号和第二信号同时存在时,完全活化的T细胞将发挥抗肿瘤作用,但长时间活化的T细胞表面将表达PD-1以维持机体自身免疫耐受,当PD-1与PD-L1/PD-L2结合后,PD-1通过招募SHP2(含SH2结构域的酪氨酸蛋白磷酸酶)导致CD28分子发生去磷酸化,进而抑制T细胞的活化[22]。
研究也表明在肿瘤发生发展过程中,当T细胞反复识别同源性肿瘤抗原后,活化后的T细胞将释放IFN-γ和其它细胞因子,而肿瘤细胞和肿瘤微环境(TME)中的其他细胞具有IFN-γ受体,IFN-γ受体可通过JAK1/2(Janus激酶1/2)发出信号,激活STAT(信号传导及转录激活因子)蛋白并使其发生磷酸化,随后STAT蛋白发生二聚化并启动一系列干扰素应答基因,包括干扰素调节因子1(IRF-1),其可与PD-L1的启动子结合并导致PD-L1在肿瘤细胞表面表达[23]。故当T细胞表面的PD-1与肿瘤细胞表面的PD-L1结合时,T细胞的活性将受到抑制,进而导致肿瘤细胞对T细胞免疫应答产生逃逸[24],且在TME中,当肿瘤浸润的T细胞(TILs)长时间接触肿瘤抗原后,TILs将发生耗竭,此时机体呈现PD-1高表达、抗肿瘤能力低的特点[25]。
PD1/PD-L1抑制剂则通过靶向PD1/PD-L1通路,特异性地阻断了T细胞表面的PD-1与肿瘤细胞表面的PD-L1结合,使T细胞的抑制状态得到解除,从而抑制了肿瘤的免疫逃逸[24, 26]。另PD-1也可在调节性T细胞(Tregs)上表达,故使用PD-1/PD-L1抑制剂可通过削弱Tregs的抑制作用而增加机体的抗肿瘤反应[24, 27]。此外,研究也表明阻断PD-1/PD-L1通路可在一定程度上逆转相关的代谢重编程,这在一定程度上也介导了T细胞的活化[28]。
2.CTLA-4信号通路及CTLA-4抑制剂的作用机理
CTLA-4的表达和功能与T细胞活化具有潜在联系,在静止的T细胞中其常位于细胞内,但在T细胞活化后其又移位至细胞表面,并在此竞争性地抑制T细胞表面的CD28分子与APCs上的CD80/CD86(B7)结合,进而减弱了TCR的信号强度,抑制了T细胞活性[15, 29],且与CD28相比,CTLA-4以更高的亲和力与B7结合[30, 31]。此外,CTLA-4还可通过诱导T细胞周期停滞来下调T细胞的活性[32]。
除以上机制外,表达CTLA-4的T细胞还可通过反式内吞作用降低APCs上B7的表达,减弱CD28信号通路的强度,如含CTLA-4组成性表达的Tregs可通过这种反式内吞作用介导树突状细胞(DC)上B7的下调,这是Treg细胞发挥抑制功能所必需的[30],且研究也表明缺失CTLA-4表达的Tregs可诱导T细胞的异常活化,导致自身免疫疾病的发生,故Tregs来源的CTLA-4与机体的免疫耐受也密切相关[28]。
因此,利用CTLA-4抑制剂阻断CTLA-4信号通路后,CD28将重新与B7结合,促进T细胞活化,且其还可抑制Tregs功能,这也可能是提高T细胞抗肿瘤活性的有效机制之一[16, 33]。然而,尽管CTLA-4和PD-1均被认为是肿瘤免疫逃逸的关键检查点,但CTLA-4在T细胞激活的初始阶段起作用,其主要是在免疫反应早期下调淋巴组织中的T细胞活化,而PD-1在T细胞、B细胞、NK细胞等其它免疫细胞上均有表达,其主要是抑制外周组织中T细胞的活性,故CTLA-4抑制剂和PD-1/PD-L1抑制剂的作用机制并不相同,这可能部分解释了两种治疗之间的疗效及副作用差异[29, 34]。此外,PD-1抑制剂联合CTLA-4抑制剂治疗晚期小细胞肺癌(NSCLC)患者的疗效优于单药治疗[35],但从机制上出发,尚不清楚这种增强的疗效是由各自单药治疗的分子机制整合而成,还是通过其它机制[28],故在未来仍需进一步明确ICIs联合治疗的潜在细胞和分子机制,这对优化未来的免疫治疗策略具有重要指导意义。
四、免疫检查点抑制剂耐药机理
尽管ICIs已显著改善了肺癌患者的生存,但遗憾的是,获益人群仍十分有限,且越来越多的临床证据均表明,相当一部分有效应答者在数月或数年后存在肿瘤复发的现象,并伴有致命的耐药性疾病[36]。故研究者将ICIs的耐药问题定义为现阶段肿瘤免疫治疗面临的十大关键挑战之一[37]。因此,为进一步扩大ICIs的临床应用范围,了解肿瘤免疫逃逸相关的细胞及分子驱动因素至关重要。
根据ICIs耐药发生时间的不同,ICIs耐药模式可细分为原发性耐药、适应性耐药及获得性耐药。顾名思义,原发性耐药指原发肿瘤对ICIs无任何应答,且肿瘤将迅速进展,适应性耐药则指肿瘤可被免疫系统识别,但它通过适应免疫攻击来保护自己。而获得性耐药指患者对ICIs治疗有一段时间的初始反应,但随后也不可避免地出现临床和/或影像学上的进展[38, 39]。此外,ICIs耐药机制也可分为肿瘤细胞内源性、外源性机制及宿主相关机制(详见表2)[40]。具体分述如下:
1.肿瘤细胞内源性耐药机制
(1)肿瘤抗原不足或抗原提呈机制下调
大量临床研究均证实肿瘤突变负荷(TMB)可潜在预测肺癌ICIs治疗的疗效[41-43],而TMB可诱导新抗原的产生,增强肿瘤免疫原性,进一步提高了T细胞的抗肿瘤作用。但当患者缺乏肿瘤抗原或体内TMB水平较低时,T细胞将无法完全活化,导致肿瘤细胞对ICIs产生耐药[38]。
另一方面,当机体存在肿瘤抗原,但由于抗原提呈机制的改变,如抗原处理相关转运体(TAP)、NLRC5蛋白、β2微球蛋白(B2M)或MHC分子的改变,将导致T细胞识别功能降低甚至消失,使肿瘤细胞发生免疫逃逸[38]。Gettinger等人的研究证实了敲除B2M可导致免疫功能强的荷瘤小鼠对PD-1抑制剂产生耐药[44],且在约40%的NSCLC患者中,HLA基因丢失与ICIs耐药有关[45]。此外,肿瘤细胞中的DNA表观遗传改变可导致免疫相关基因的表达发生变化,从而影响抗原的加工、递呈和免疫逃逸[38]。
(2)某些基因或信号通路驱动T细胞排斥
研究表明,当肿瘤细胞中的某些基因或通路得到表达或抑制后,TME中的免疫细胞浸润程度及其功能将受到抑制,此机制在原发性耐药或适应性耐药中均可出现[38]。目前已发现多种致癌或抑癌信号通路参与肿瘤逃逸,包括EGFR、MAPK、PIK3、LKB1、WNT/β连环蛋白、IFN-γ等信号通路[46]。
如ICIs在EGFR野生型NSCLC患者中的疗效优于EGFR突变NSCLC患者,这可能由于EGFR组成性的表达导致PD-L1表达(不依赖IFN-γ)和免疫抑制性细胞因子水平的升高[13, 47];而WNT/β连环蛋白信号通路的稳定表达则可抑制肿瘤中的T细胞浸润[48],对TCGA数据库中的多个癌种分析也表明,WNT/β连环蛋白信号通路的激活与非T细胞炎性基因表达特征有关[49];另据报道,MAPK信号通路除与MHC-I分子的表达降低有关,还可导致一些免疫抑制性细胞因子(如VEGF、IL-10和IL-6)的产生增加,一些临床前研究也表明添加MEK抑制剂可增加MHC-I分子的表达,进而逆转ICIs耐药[13];此外,在KRAS突变的NSCLC患者中,LKB1(一种肿瘤抑制因子)常处于失活状态,临床前研究表明KRAS-LKB1缺陷型肺癌对ICIs的敏感性低于KRAS-LKB1野生型肺癌[50, 51]。
IFN-γ信号通路在原发性、适应性及获得性耐药中也起着关键作用,当肿瘤细胞中的IFN-γ信号通路的相关分子(如IFN-γ受体链JAK1/2、STAT、IRFs)发生突变或表观遗传沉默后,IFN-γ的抗肿瘤作用将丧失,导致肿瘤细胞逃逸T细胞的免疫应答[11];另在IFN-γ的不断刺激下,肿瘤细胞可以过表达PD-L1以逃逸免疫应答,故肿瘤细胞上PD-L1的表达是PD-1/PD-L1抑制剂产生免疫应答的充分条件,目前许多临床试验均证实其可潜在预测肺癌ICIs治疗的疗效[52],但一些PD-L1表达极低甚至缺失的患者也对PD-1/PD-L1抑制剂表现出持久的应答,目前仍缺乏机制来解释这一现象[53],未来仍需进一步探索。
2.肿瘤细胞外源性耐药机制
除肿瘤细胞内源性耐药机制外,肿瘤细胞外在因素即TME中的某些成分也参与ICIs的原发性和适应性耐药。当肿瘤细胞糖酵解代谢引起缺氧和酸中毒时,会表现出对TME的免疫抑制作用,具体表现为CD8+T细胞活性降低、Tregs和MDSCs表达上调,巨噬细胞从炎症表型(M1)转变为免疫抑制表型(M2),而这种免疫抑制性的TME将促使肿瘤细胞发生免疫逃逸[47],临床前的研究同样表明,ICIs较好的疗效与较低的Tregs和MDSCs浸润有关[54]。
另TME中的一些免疫抑制因子也参与ICIs的耐药,如血管内皮生长因子(VEGF)可减少效应T细胞运输及浸润到TME中,其也可促进Tregs浸润[40],且Tregs可通过分泌某些抑制性的细胞因子(如IL-10、IL-35和TGF-β)或其直接与细胞接触来抑制T细胞反应[11]。值得注意的是,IFN-γ也可促进一些免疫抑制分子的表达(如IDO、CEACAM1等),这将直接抑制效应T细胞的功能[38]。此外,包括CCL5、CCL17、CCL22、CXCL8和CXCL12在内的一些趋化因子可诱导MDSCs和Tregs进入TME中,从而促进机体形成一个免疫抑制性的微环境[40]。
除上文阐述的免疫抑制细胞、免疫抑制因子外,一些抑制性的免疫检查点如TIM-3、LAG-3、BTLA、TIGIT和/或VISTA的上调,也可增加机体的免疫抑制功能,进而促进肿瘤细胞发生逃逸[47]。
3.宿主相关耐药机制
近年来,肠道微生物菌群已被发现与ICIs疗效密切相关,多项研究均表明菌群的多样性和特定物种的丰富可改善ICIs疗效,这可能是由于微生物和肿瘤抗原之间存在交叉反应,可增强DC的激活、抗原呈递和炎症细胞因子的产生[40, 47],然而,在ICIs治疗之前使用抗生素可导致肠道微生物组成异常,进而降低了ICIs的疗效[55]。此外,宿主其它相关因素如年龄、全身状况、有无合并并发症等也可影响ICIs的疗效。
表2 免疫检查点抑制剂耐药相关机制

五、小结与展望
尽管靶向CTLA-4和PD-1/PD-L1的ICIs治疗已全面改变了肺癌患者的治疗格局,但ICIs的总体有效率及优势人群仍十分有限,且肿瘤与免疫系统之间的相互作用极其复杂,肿瘤逃逸免疫监视的途径也多种多样,而目前对ICIs的耐药机制及生物标志物的探索也大多源于黑色素瘤的研究,是否可应用于肺癌领域仍充满不确定性。展望未来,全基因组测序和表观遗传学分析将有助于确定可准确预测ICIs疗效的生物标志物,且在ICIs的整个治疗过程中,尽可能地连续肿瘤活检和外周血取样也有助于发现新的耐药机制。总之,为成功实现肺癌患者的精准免疫治疗,探索ICIs的耐药机制及ICIs新靶点、新药物的开发势在必行。
参考文献
[1] Ferlay J, Ervik M, Bray F, et al. Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer [EB/OL]. https://gco.iarc.fr/today.
[2] Theodoulakis Christofi, Stavroula Baritaki, Luca Falzone, et al. Current Perspectives on Cancer Immunotherapy[J]. Cancers (Basel), 2019,11(10):1472.
[3] Herbst R S, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature (London), 2018,553(7689):446-454.
[4] Suresh K, Naidoo J, Lin C T, et al. Immune Checkpoint Immunotherapy for Non-Small Cell Lung Cancer: Benefits and Pulmonary Toxicities[J]. Chest, 2018,154(6):1416-1423.
[5] Hegde P S, Karanikas V, Evers S. The Where, the When, and the How of Immune Monitoring for Cancer Immunotherapies in the Era of Checkpoint Inhibition[J]. Clin Cancer Res, 2016,22(8):1865-1874.
[6] Xia Bu, Yihui Yao, Li X. Immune Checkpoint Blockade in Breast Cancer Therapy[J]. Adv Exp Med Biol, 2017(1026):383-402.
[7] Califano R, Kerr K, Morgan R D, et al. Immune Checkpoint Blockade: A New Era for Non-Small Cell Lung Cancer[J]. Curr Oncol Rep, 2016,18(9):59.
[8] Janakiram M, Pareek V, Cheng H, et al. Immune checkpoint blockade in human cancer therapy: lung cancer and hematologic malignancies[J]. Immunotherapy, 2016,8(7):809-819.
[9] O'Donnell J S, Teng M, Smyth M J. Cancer immunoediting and resistance to T cell-based immunotherapy[J]. Nat Rev Clin Oncol, 2019,16(3):151-167.
[10] Schreiber R D, Old L J, Smyth M J. Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion[J]. Science, 2011,331(6024):1565-1570.
[11] Li X, Shao C, Shi Y, et al. Lessons learned from the blockade of immune checkpoints in cancer immunotherapy[J]. J Hematol Oncol, 2018,11(1):26-31.
[12] Syn N L, Teng M W L, Mok T S K, et al. De-novo and acquired resistance to immune checkpoint targeting[J]. Lancet oncol, 2017,18(12):e731-e741.
[13] Aspeslagh S, Chabanon R M, Champiat S, et al. Understanding genetic determinants of resistance to immune checkpoint blockers[J]. Semin Cancer Biol, 2020,65:123-139.
[14] Qin S, Xu L, Yi M, et al. Novel immune checkpoint targets: moving beyond PD-1 and CTLA-4[J]. Mol Cancer, 2019,18(1):155.
[15] Shi T, Ma Y, Yu L, et al. Cancer Immunotherapy: A Focus on the Regulation of Immune Checkpoints[J]. Int J Mol Sci, 2018,19(5).
[16] Yang J, Chen J, Wei J, et al. Immune checkpoint blockade as a potential therapeutic target in non-small cell lung cancer[J]. Expert Opin Biol Ther, 2016,16(10):1209-1223.
[17] Chen D S, Mellman I. Oncology Meets Immunology: The Cancer-Immunity Cycle[J]. Immunity (Cambridge, Mass.), 2013,39(1):1-10.
[18] Zugazagoitia J, Molina-Pinelo S, Lopez-Rios F, et al. Biological therapies in nonsmall cell lung cancer[J]. Eur Respir J, 2017,49(3).
[19] Jain P, Jain C, Velcheti V. Role of immune-checkpoint inhibitors in lung cancer[J]. Ther Adv Respir Dis, 2018,12:1825482181.
[20] Carlisle J W, Steuer C E, Owonikoko T K, et al. An update on the immune landscape in lung and head and neck cancers[J]. CA Cancer J Clin, 2020.
[21] Memon H, Patel B M. Immune checkpoint inhibitors in non-small cell lung cancer: A bird's eye view[J]. Life Sci, 2019,233:116713.
[22] Valecha G K, Vennepureddy A, Ibrahim U, et al. Anti-PD-1/PD-L1 antibodies in non-small cell lung cancer: the era of immunotherapy[J]. Expert Rev Anticancer Ther, 2017,17(1):47-59.
[23] Antoni Ribas, Wolchok J D. Cancer Immunotherapy Using Checkpoint Blockade[J].Science, 2018,359(6382):1350-1355.
[24] Xia L, Liu Y, Wang Y. PD-1/PD-L1 Blockade Therapy in Advanced Non-Small-Cell Lung Cancer: Current Status and Future Directions[J]. Oncologist, 2019,24(Suppl 1):S31-S41.
[25] Spranger S, Spaapen R M, Zha Y, et al. Up-regulation of PD-L1, IDO, and T(regs) in the melanoma tumor microenvironment is driven by CD8(+) T cells[J]. Sci Transl Med, 2013,5(200):116r-200r.
[26] Inoue H, Okamoto I. Immune Checkpoint Inhibitors for the Treatment of Unresectable Stage III Non-Small Cell Lung Cancer: Emerging Mechanisms and Perspectives[J]. Lung cancer (Auckland), 2019,10:161-170.
[27] van de Ven R, Niemeijer A N, Stam A, et al. High PD-1 expression on regulatory and effector T-cells in lung cancer draining lymph nodes[J]. ERJ Open Res, 2017,3(2).
[28] Wei S C, Duffy C R, Allison J P. Fundamental Mechanisms of Immune Checkpoint Blockade Therapy[J]. Cancer Discov, 2018,8(9):1069-1086.
[29] Byun D J, Wolchok J D, Rosenberg L M, et al. Cancer immunotherapy-immune checkpoint blockade and associated endocrinopathies[J]. Nat Rev Endocrinol, 2017,13(4):195-207.
[30] He X, Xu C. Immune checkpoint signaling and cancer immunotherapy[J]. Cell research, 2020,30(8):660-669.
[31] Champiat S, Ileana E, Giaccone G, et al. Incorporating Immune-Checkpoint Inhibitors into Systemic Therapy of NSCLC[J]. J Thorac Oncol, 2014,9(2):144-153.
[32] Young Kwang Chae, Ayush Arya, Wade Iams, et al. Immune checkpoint pathways in non-small cell lung cancer[J]. Ann Transl Med, 2018,6(5):88.
[33] Tomasini P, Khobta N, Greillier L, et al. Ipilimumab: its potential in non-small cell lung cancer[J]. Ther Adv Med Oncol, 2011,4(2):43-50.
[34] Davies M. How Checkpoint Inhibitors Are Changing the Treatment Paradigm in Solid Tumors: What Advanced Practitioners in Oncology Need to Know[J]. J Adv Pract Oncol, 2016,7(5):498-509.
[35] Chiang A C, Herbst R S. Frontline immunotherapy for NSCLC-the tale of the tail[J]. Nat Rev Clin Oncol, 2020,17(2):73-74.
[36] Syn N L, Teng M, Mok T, et al. De-novo and acquired resistance to immune checkpoint targeting[J]. Lancet Oncol, 2017,18(12):e731-e741.
[37] Hegde P S, Chen D S. Top 10 Challenges in Cancer Immunotherapy[J]. Immunity (Cambridge, Mass.), 2020,52(1):17-35.
[38] Sharma P, Hu-Lieskovan S, Wargo J A, et al. Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy[J]. Cell, 2017,168(4):707-723.
[39] Adam J Schoenfeld, Hellmann M D. Acquired Resistance to Immune Checkpoint Inhibitors[J]. Cancer cell, 2020,37(4):443-455.
[40] Fares C M, Van Allen E M, Drake C G, et al. Mechanisms of Resistance to Immune Checkpoint Blockade: Why Does Checkpoint Inhibitor Immunotherapy Not Work for All Patients?[J]. Am Soc Clin Oncol Educ Book, 2019,39:147-164.
[41] Hellmann M D, Ciuleanu T E, Pluzanski A, et al. Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden[J]. N Engl J Med, 2018,378(22):2093-2104.
[42] Ready N, Hellmann M D, Awad M M, et al. First-Line Nivolumab Plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer (CheckMate 568): Outcomes by Programmed Death Ligand 1 and Tumor Mutational Burden as Biomarkers[J]. J Clin Oncol, 2019,37(12):992-1000.
[43] Nadal E, Massuti B, Dómine M, et al. Immunotherapy with checkpoint inhibitors in non-small cell lung cancer: insights from long-term survivors[J]. Cancer Immunol Immunother, 2019,68(3):341-352.
[44] Gettinger S, Choi J, Hastings K, et al. Impaired HLA Class I Antigen Processing and Presentation as a Mechanism of Acquired Resistance to Immune Checkpoint Inhibitors in Lung Cancer[J]. Cancer Discov, 2017,7(12):1420-1435.
[45] McGranahan N, Rosenthal R, Hiley C T, et al. Allele-Specific HLA Loss and Immune Escape in Lung Cancer Evolution[J]. Cell (Cambridge), 2017,171(6):1259-1271.
[46] Kalbasi A, Ribas A. Tumour-intrinsic resistance to immune checkpoint blockade[J]. Nat Rev Immunol, 2019,20(1):25-39.
[47] Walsh R J, Soo R A. Resistance to immune checkpoint inhibitors in non-small cell lung cancer: biomarkers and therapeutic strategies[J]. Ther Adv Med Oncol, 2020,12:431414354.
[48] Spranger S, Bao R, Gajewski T F. Melanoma-intrinsic beta-catenin signalling prevents anti-tumour immunity[J]. Nature, 2015,523(7559):231-235.
[49] Luke J J, Bao R, Sweis R F, et al. WNT/beta-catenin Pathway Activation Correlates with Immune Exclusion across Human Cancers[J]. Clin Cancer Res, 2019,25(10):3074-3083.
[50] Ferdinandos Skoulidis, Michael E Goldberg, Danielle M Greenawalt, et al. STK11/LKB1 Mutations and PD-1 Inhibitor Resistance in KRASMutant Lung Adenocarcinoma[J]. Cancer Discov, 2018,8(7):822-835.
[51] Koyama S, Akbay E A, Li Y Y, et al. STK11/LKB1 Deficiency Promotes Neutrophil Recruitment and Proinflammatory Cytokine Production to Suppress T-cell Activity in the Lung Tumor Microenvironment[J]. Cancer Res, 2016,76(5):999-1008.
[52] Khunger M, Rakshit S, Pasupuleti V, et al. Incidence of Pneumonitis With Use of Programmed Death 1 and Programmed Death-Ligand 1 Inhibitors in Non-Small Cell Lung Cancer: A Systematic Review and Meta-Analysis of Trials[J]. Chest, 2017,152(2):271-281.
[53] Joel Sunshine, Taube J M. PD-1/PD-L1 inhibitors[J]. Curr Opin Pharmacol, 2015(23):32-38.
[54] Horvath L, Thienpont B, Zhao L, et al. Overcoming immunotherapy resistance in non-small cell lung cancer (NSCLC)-novel approaches and future outlook[J]. Mol Cancer, 2020,19(1):1-15.
[55] Routy B, Le Chatelier E, Derosa L, et al. Gut Microbiome Influences Efficacy of PD-1-based Immunotherapy Against Epithelial Tumors[J]. Science, 2018,359(6371):91-97.

王志杰,中国医学科学院肿瘤医院内科副主任医师,肿瘤学博士,硕士研究生导师
中国临床肿瘤学会(CSCO)理事
中国临床肿瘤学会(CSCO)非小细胞肺癌专家委员会委员
中国临床肿瘤学会(CSCO)青年专家委员会委员
中国抗癌协会肺癌专委会青委副主任委员
中国人体健康科技促进会肿瘤化疗专委会 副主任委员
北京肿瘤学会肺癌专委会常委
北京医学奖励基金会肺癌青年专家委员会副主任委员,内科学组副组长
北京肿瘤病理精准诊断研究会青委 副主任委员
中国抗癌协会肿瘤药物临床研究专委会青委
中国医促会控烟和肺癌防治专委会委员
国家科技进步奖评审专家、国家自然科学基金评审专家
以第一/共同第一/通讯作者发表SCI论文30余篇,包括Lancet respiratory medicine、JCO、JAMA Oncology、PNAS等杂志
获得“北京市科技新星”
北京市优秀人才培养资助计划
主持国家自然科学基金4项
获得国家科技进步奖二等奖,教育部“高等学校科技进步奖”一等奖,中国抗癌协会科技奖一等奖等。
来源:人民卫生出版社《临床知识》约稿
作者:王志杰教授,中国医学科学院肿瘤医院内科副主任医师;李思妮
编辑:环球医学资讯丁好奇

- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

