龙新、陈孝平:合并门静脉癌栓、门静脉高压肝癌的中国特色外科治疗
一、合并门静脉癌栓肝癌的中国特色外科治疗
肝癌合并门静脉癌栓(portal vein tumor thrombosis,PVTT)是肝癌病人重要的不良预后因素,然而在肝癌病人中PVTT发生率为12.5%~39.7%,尸检肝癌病人中PVTT发生率高达64.7%,晚期肝癌中发生率达90%,小肝癌中达20%~30%。合并PVTT肝癌病人自然病程中位生存时间2.7~4.0个月,而无PVTT病人为24.4个月。按照国际广泛使用的巴塞罗那肝癌临床分期(Barcelona clinic liver cancer,BCLC),肝癌合并PVTT属于BCLC C期。对于肝癌合并PVTT的治疗目前国际上没有形成统一的标准,基于BCLC分期的美国肝病研究学会(American association for the study of liver diseases,AASLD)和欧洲肝病学会(European association for the study of the liver,EASL)推荐分子靶向治疗(索拉非尼/仑伐替尼)为唯一的一线治疗方案。中国香港肝癌分期系统(Hong Kong liver cancer staging system,HKLC)推荐TACE为肝癌合并PVTT一线治疗,但对肿瘤直径小于5cm,肝功能Child-Pugh A级伴肝内血管侵犯则行手术切除。日本肝病学会(Japan society of hepatology,JSH)和亚太肝病研究学会(Asian pacific association for the study of the liver,APASL)均推荐手术切除为肝癌合并PVTT多种治疗策略中一项选择。从20世纪50年代开始我国学者就探索肝癌合并PVTT的外科治疗,且取得了较好的预后。从20世纪90年代开始,关于肝癌合并PVTT的外科治疗的报道逐渐增多,并对PVTT形成机制进行了初步探讨。进入21世纪,随着临床经验的积累和PVTT研究的深入,肝癌合并PVTT的外科治疗逐渐规范化。与此同时,对于发生门静脉不同部位的癌栓的接受外科手术的预后进行了分析。近年来,随着新的循证医学证据的出现,肝癌合并PVTT的治疗国内趋向于多种治疗手段的综合治疗,包括手术切除、TACE、放疗、化疗、分子靶向治疗、免疫治疗及中医中药治疗、肝移植等。
(一)PVTT形成机制
肝癌PVTT形成是肝癌肝内播散和复发转移的病理学基础,目前国内外对PVTT形成机制研究较多,但其具体机制目前尚不清楚。PVTT形成的因素较多,包括肝脏肿瘤的病理解剖、门静脉血流动力学改变、肿瘤细胞自身的特性、肿瘤微环境的改变、循环肿瘤细胞(circulating tumor cell,CTC)以及免疫逃逸等因素。
PVTT形成的主要解剖学基础是:肝癌主要由肝动脉供血滋养,门静脉分支分布于肿瘤周边,并不供血滋养肿瘤,与肝静脉一样为出瘤血管。当肿瘤细胞侵入血管壁进入血管腔,以出芽的方式在血管腔内延伸,突破肿瘤包膜进入门静脉,从而形成门静脉癌栓。另外,门静脉附壁癌栓和原发肿瘤一样为动脉供血,其滋养动脉为供养门静脉的小动脉,门静脉为其流出通道,从而使门静脉癌栓得以生存和进展。肝静脉管壁薄,容易受到压迫,肝癌病人大多数有肝硬化背景,硬化结节及纤维结缔组织可压迫肝静脉,逐渐长大的肿瘤亦可压迫肝静脉,从而导致肝静脉流出受阻,形成区域性门静脉高压;受到较大或较多肝脏肿瘤的压迫,肝内正常淋巴循环受阻,肝脏微循环淤滞;再加上肿瘤内存在大量动静脉瘘,动脉血直接进入门静脉,使得门静脉的压力更加增高,从而出现门静脉血流瘀滞,甚至出现不同程度的逆肝血流,这为门静脉癌栓的形成创造了条件,同时也解释了门静脉癌栓发生的概率高于肝静脉癌栓。门静脉癌栓与门静脉逆流密切相关,静脉逆流频率越高、逆流速度越快,门静脉癌栓形成的机会就越多。另外,门静脉回流血液富含消化吸收的营养物质和胰腺内分泌所产生的胰岛素、胰高血糖素和生长抑素等,为肿瘤细胞增殖提供了丰富的营养物质,更加有利于PVTT的形成。
肿瘤细胞自身的改变,包括基因表达谱的改变、DNA的甲基化、组蛋白的转录后修饰、染色质空间结构的改变和非编码RNA的调控、肝癌细胞表面黏附分子表达改变(钙黏蛋白、免疫球蛋白超家族、选凝素及整合蛋白),使得肝癌细胞自我更新能力、迁移和侵袭能力增强,从而促进PVTT形成。肿瘤微环境中的基质金属蛋白酶、趋化因子、低氧、Treg细胞、血管生长因子、凝血酶调节素以及载脂蛋白等为PVTT的形成提供了不可或缺的条件。此外,门静脉内微环境的Treg细胞及骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)等抑制免疫细胞活性,肿瘤细胞进入门静脉系统,成功地逃避机体免疫监视后必须有足够的增殖活性,从而形成PVTT。
肝癌病人的外周血、门静脉系统及肝静脉均存在CTC,其数量与肝切除术后门静脉癌栓和微血管癌栓的发生成正相关,提示可能CTC“归巢”形成PVTT。
综上,PVTT的形成机制复杂,有多种因素参与,其形成机制需进一步探索。
(二)PVTT分型
肝癌分期系统较多,但单独涉及PVTT的程度或者范围进行分型的目前只有2003年日本学者提出的Vp分型和上海东方肝胆外科医院提出的程氏分型。日本Vp分型共分为5型:Vp0,未发现癌栓;Vp1,癌栓位于门静脉三级分支及以上;Vp2,癌栓延伸至门静脉二级分支;Vp3,癌栓延伸至门静脉一级分支;Vp4,癌栓延伸至门静脉主干或对侧门静脉分支。Vp3与Vp4型PVTT术后5年生存率并无统计学差异。程氏分型是根据PVTT侵犯的部位及范围将癌栓分为Ⅰ~Ⅳ型:Ⅰ型为癌栓累及二级以上门静脉分支;Ⅱ型为癌栓累及门静脉一级分支;Ⅲ型为癌栓累及门静脉主干;Ⅳ型为癌栓累及肠系膜上静脉。Ⅰ型和Ⅱ型手术效果较Ⅲ型和Ⅳ型好。此两种分型可较好的将PVTT进行分类,并能预测预后,为肝癌合并PVTT的治疗提供指导。但此分型的预后预测能力仅适用于行手术切除的病人,且没有考虑肝功能及肿瘤相关因素,其临床应用可能有一定的局限性。将PVTT进行分型是很有必要的,根据不同分型选择最合适的治疗方法可使病人获益最大,目前关于PVTT的分型还有待进一步完善。
(三)PVTT外科治疗
PVTT的外科治疗是以手术为主的综合治疗,术前辅以TACE、分子靶向治疗及放疗等降期治疗,以提高手术切除率。术后辅助TACE、分子靶向治疗、免疫治疗(PD-1或PD-L1单抗)及中医中药治疗等以提高术后生存率和生活质量。
1.手术适应证
中华医学会外科学分会肝脏外科学组2001年制定了肝癌合并PVTT的手术适应证,随着临床经验的积累和新的循证医学证据的出现,手术适应证也不断得到完善。病人的一般情况符合肝切除的要求:病人一般情况较好,无明显心、肺、肾、脑等重要脏器器质性病变;肝功能正常,或仅有轻度损害,按肝功能分级属A级;或肝功能分级属B级,经短期护肝治疗后肝功能恢复到A级;肝储备功能(如ICGR15)基本在正常范围以内;无不可切除的肝外转移性肿瘤。
局部病变须符合以下要求:①按照肝癌肝切除手术适应证的标准判断,肿瘤是可切除的:单发肝癌,表面较光滑,周围界限较清楚或有假包膜形成,受肿瘤破坏的肝组织少于30%(可通过CT或MRI测量);或虽然受肿瘤破坏的肝组织大于30%,但无瘤侧肝脏明显代偿性增大,达全肝组织的50%以上;或多发性肿瘤,且局限在肝脏的一段或一叶内;②癌栓充满门静脉主支和(或)主干,进一步发展,将很快危及病人生命;③估计癌栓形成的时间较短,尚未发生机化。上述病例适合做门静脉主干切开取癌栓术,同时行姑息性肝切除;④如行半肝切除,可开放门静脉残端取癌栓,不必经切开门静脉主干取栓;⑤如癌栓位于肝段以上小的门静脉分支内,可在切除肝癌的同时连同该段门静脉分支一并切除;⑥如术中发现癌灶不可切除,可在门静脉主干切开取癌栓术后,术中做选择性肝动脉插管栓塞化疗或门静脉插管化疗、射频治疗、微波治疗或冷冻治疗等。
2.手术方式
手术切除是治疗肝癌合并PVTT一种治疗方式,主要分为以下几种:
(1)肝切除术:癌栓连同肿瘤一并切除。通常癌栓位于门静脉一级分支以上,如肿瘤位于左半肝,癌栓位于门静脉左支及更小分支,则行左半肝切除术;肿瘤位于右半肝,癌栓位于门静脉右支及更小分支,则行右半肝切除术;如肿瘤位于右后叶,癌栓位于门静脉右后支,则行右后叶肝切除术;肿瘤位于肝段,癌栓位于门静脉相应段间支,则行肝段切除术或肝叶切除术或半肝切除术。
(2)肝切除+取癌栓术:包括肝切除+肝段面取癌栓术,肝切除+门静脉切开取癌栓术或取癌栓后行门静脉内膜剥脱,或门静脉重建。适用于癌栓延伸门静脉主干,超出肝切除线1.0~2.0cm。切除肿瘤后,暂时阻断门静脉主干及对侧门静脉血流,通过气囊导管取栓术、胆道取石钳或其他器械、吸引器吸出等方法去除门静脉内的癌栓;若经肝断面癌栓难以取出或取净,分离显露门静脉主干或一级分支,自前壁或右侧壁纵行切开1.5~2.0cm,直接取出癌栓。癌栓取出后用生理盐水反复冲洗,然后再开放第一肝门,将癌栓碎片随门静脉血流从门静脉断端冲出。然后经术中超声确认无残留病灶后关闭门静脉断端。癌栓取出后可行门静脉内膜剥脱。切除肝癌及受累门静脉分支后,再直接行静脉端端吻合,或者利用自体血管及人造血管行静脉搭桥吻合术。研究证实,肝断端取栓术、门静脉切除后行门静脉重建和门静脉断端取栓合并门静脉内膜剥脱术,预后无明显差别,外科医生可根据具体病情进行选择实施。
3.手术效果
对于肿瘤切除同时行门静脉取栓的病人,手术能明显改善其预后,这一点已为大多学者共识。另外,解除或缓解了因PVTT引起的门静脉高压症,从而减少食管胃底静脉曲张破裂出血及顽固性腹水,同时,PVTT引起的消化道症状如饱胀、厌食、腹泻等也会得到不同程度改善,恢复门静脉血流,改善肝功能。肿瘤及癌栓切除后,为以后的进一步综合治疗如经肝动脉或门静脉化疗、TACE及生物治疗等提供了机会与条件。陈孝平等总结了260例肝癌合并门静脉癌栓的资料,分为肿瘤切除合并门静脉取癌栓组、门静脉取栓组、TACE组、保守治疗组,分析发现肿瘤切除合并门静脉取癌栓组的中位生存时间17.2个月,1年、3年、5年总体生存率分别为67.7%、40.3%和20.9%,明显高于其他3个治疗组。国内其他众多回顾性研究表明,手术治疗肝癌合并门静脉癌栓优于TACE、肝动脉结扎/肝动脉灌注化疗、系统化疗及保守治疗。
表1总结了我国学者发表的关于肝癌合并PVTT手术治疗效果的英文文献。从该表中可以看出,PVVT术后病人生存差异较大,中位生存时间为5~22个月不等,1年总体生存率0~86.5%,2年总体生存率0~53.0%,3年总体生存率0~69.0%,5年总体生存率0~59%;1年无瘤生存率0~50.7%,2年无瘤生存率4.2%~11.2%,3年无瘤生存率0~17.8%,5年无瘤生存率0~10.1%。存在上述差异的除了与肿瘤数目、肿瘤大小、甲胎蛋白、肝内复发转移等因素相关外,也与PVTT部位密切相关。总体来说,癌栓位于门静脉一级分支及以上的病人手术切除可以有较好的生存获益,然而癌栓位于门静脉主干及肠系膜上静脉,手术治疗并不能让病人在生存上获益,因而对于肝脏可切除的肿瘤,癌栓位于门静脉一级分支以上病人优先考虑手术,癌栓位于门静脉主干手术需慎重,不推荐癌栓位于肠系膜上静脉病人行手术治疗。门静脉主干癌栓病人,若肝功能为Child-Pugh A级,则适合手术。陈孝平等的研究表明机化型癌栓病人术后生存获益小于增生型、坏死型及混合型癌栓病人,多因素分析发现附壁癌栓病人的生存预后差于悬浮癌栓的病人,癌栓充满门静脉主干病人的预后较非充满型病人预后差。因而,对门静脉主干癌栓病人是否手术,除肝功能是个重要的考量指标外,癌栓的病理类型、是否为附壁癌栓及癌栓是否充满门静脉主干应在考虑的范围内。
表1 手术治疗合并门静脉癌栓肝癌效果
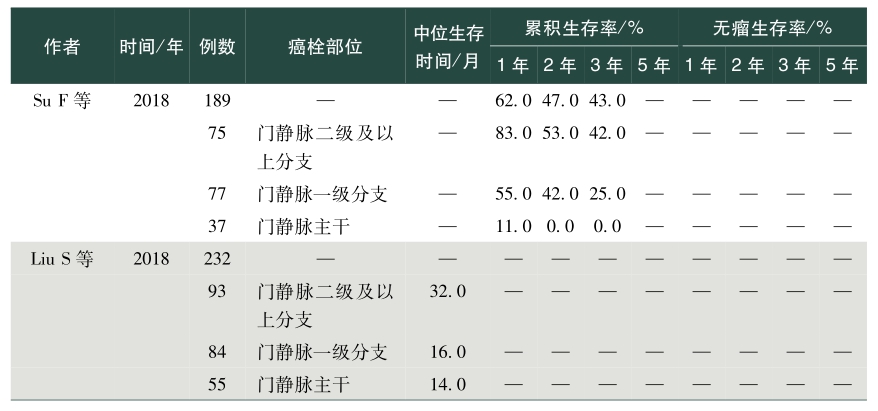
续表
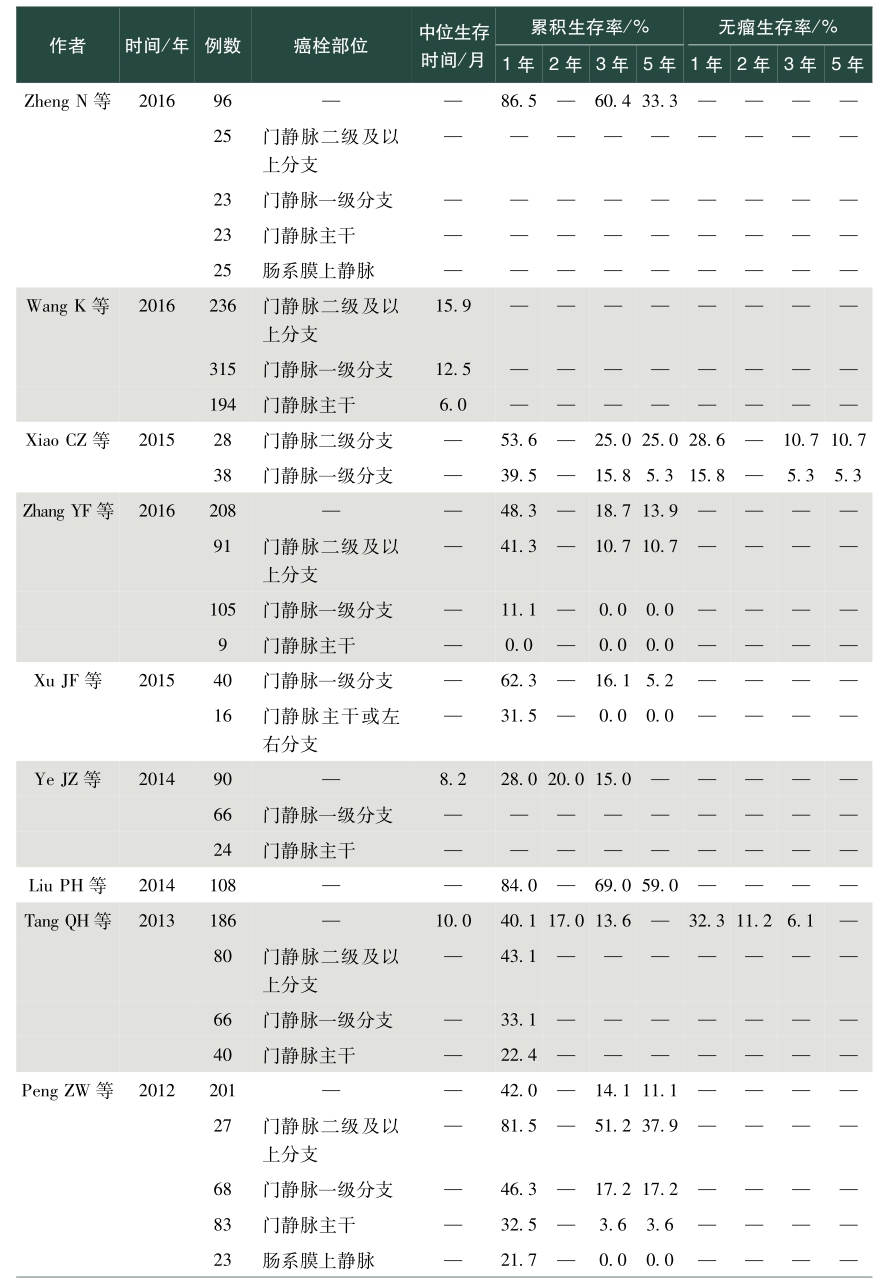
续表
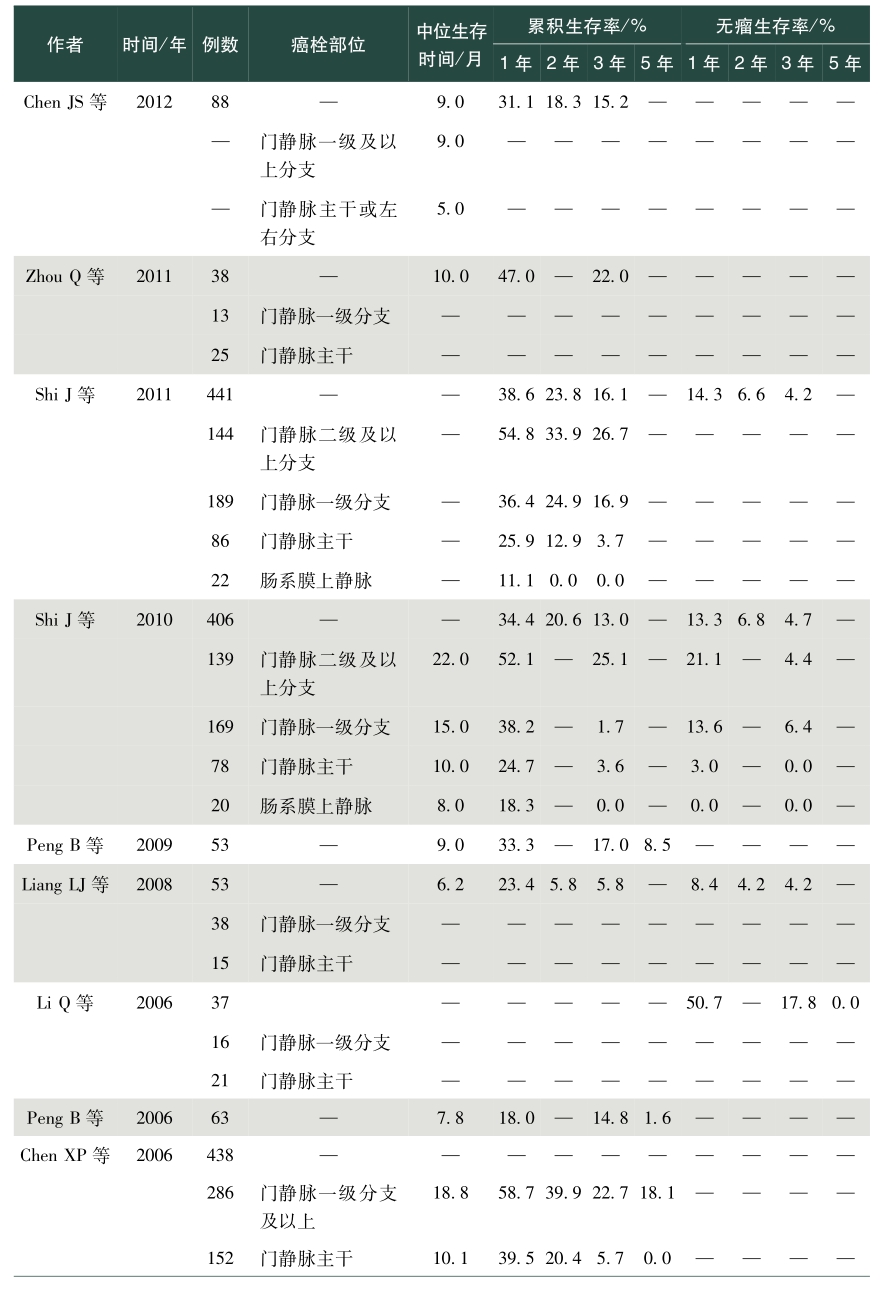
续表
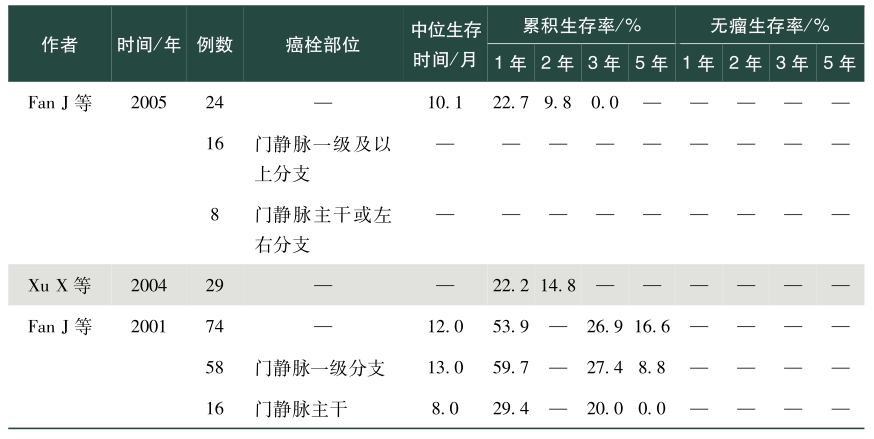
注:—表示文献中无此数据或部位。
4.以手术为基础的综合治疗
为提高PVTT病人手术疗效,降低复发转移风险,延长生存时间,通常需要行术后辅助治疗,包括TACE、门静脉化疗、肝动脉灌注化疗、分子靶向治疗、中医中药治疗以及免疫治疗等。肝癌合并PVTT病人术后辅助TACE或门静脉灌注化疗或经肝动脉灌注化疗,或多种辅助治疗联合应用,可以改善病人的生存预后。但目前的研究大多为单中心回顾性研究,最终辅助治疗的有效性需大样本多中心前瞻性随机对照研究进一步证实。
研究证实肝癌病人术后分子靶向药物索拉非尼不能延长病人的生存时间,延缓肝癌的复发,因而索拉非尼对于肝癌合并PVTT病人术后治疗不是一个合理的选择。另外,其他靶向药物,如仑伐替尼、卡博替尼、阿帕替尼等,以及免疫治疗药物,如PD-1单抗、PD-L1单抗,为肝癌合并PVTT术后辅助治疗提供了更多的选择,但其有效性和安全性需进一步评估;术后辅助全身静脉化疗或放疗目前没有可靠的证据。多中心随机临床研究证实中成药槐耳颗粒能够显著延长根治性切除术后疾病无进展生存期,降低术后肝外复发转移风险,这为肝癌合并PVTT术后辅助治疗开辟了一条新的途径。
肝癌合并PVTT病人术后辅助治疗不可忽视,术前的辅助治疗同样值得关注。肝癌合并门静脉主干癌栓病人术前接受多次低剂量放疗,可以使癌栓缩小甚至回缩至门静脉分支,可以提高手术切除率,降低肝癌相关死亡率和复发风险。术前TACE可以使部分病人肿瘤坏死缩小达50%,可以提高术后病人生存时间,目前肝癌合并PVTT病人术前TACE治疗国内外中心报道较少。
5.肝移植
肝移植是治疗肝癌最有效的手段,不仅能去除病灶,而且也消除了产生肝癌的土壤,即病肝本身,然而,肝移植术后复发转移率可高达60%。PVTT是肝癌术后复发和影响术后长期生存的独立危险因素。肝癌合并PVTT病人肝移植术后2年总体生存率只有29.5%,3年总体生存率只有23.6%,3年内复发率为100%。肝癌合并PVTT病人肝移植术后中位生存时间为7个月,与TACE相同;1年和3年总体生存率差于手术切除。这些临床实践表明肝癌伴PVTT肝移植术后,肿瘤复发率高,预后差,提示肝癌合并PVTT不适合行肝移植治疗。目前国际上将肝癌合并PVTT列为肝移植禁忌证。
(四)小结
不同于欧美国家,我国对于可切除病灶的肝癌合并PVTT首选手术切除,术后辅助以多种形式的综合治疗,包括TACE、肝动脉灌注化疗、门静脉灌注化疗、分子靶向治疗、免疫治疗及中医中药治疗等,另外术前综合治疗如放疗、TACE、分子靶向治疗及免疫治疗等亦在探索中,以期最终改善病人的生活质量和延长生存时间。然而,具有中国特色的以手术为基础的综合治疗均源于回顾性研究,证据等级低,因而需要大样本、多中心、前瞻性随机对照研究来提供可靠的证据。
二、合并门静脉高压肝癌的中国特色外科治疗
肝癌合并门静脉高压的原因有多种,与肿瘤本身相关的原因为PVTT、肿瘤压迫门静脉和肿瘤内的动静脉瘘。肝癌伴发疾病如乙型病毒性肝炎、丙型病毒性肝炎、非酒精性脂肪性肝炎,黄曲霉素及其他原因引起的肝硬化所导致的门静脉高压,另外门静脉或脾静脉栓塞、门静脉海绵样变性等原因引起的肝前型门静脉高压及巴德-吉亚利综合征等原因引起的肝后型门静脉高压。肿瘤压迫或者瘤内动静脉瘘,肿瘤切除后门静脉高压即可解除。下面主要阐述具有我国特色的合并门静脉高压肝癌的外科治疗。
乙型病毒性肝炎肝硬化在我国是常见疾病,肝硬化是形成肝癌和门静脉高压共同的病理基础,1/3的肝硬化病人会发展成肝癌,约80%的肝癌病人合并有肝硬化,肝硬化亦是导致门静脉高压最常见的原因,同时25%~55%的肝硬化肝癌病人合并有门静脉高压症。因而,合并门静脉高压肝癌的诊治在临床工作中是一个不可忽略的问题。
(一)门静脉高压的定义
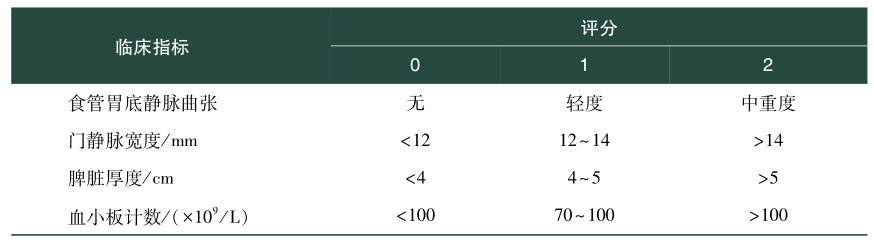
门静脉高压主要特点是门静脉和下腔静脉之间的压力梯度病理性增高。通常通过肝静脉压力梯度(hepatic venous pressure gradient,HVPG),即肝静脉锲压(wedged hepatic vein pressure,WHVP)与游离压(FHVP)之差,反映门静脉压力的大小,正常HVPG<5mmHg,若HVPG≥10mmHg则为临床显著性门静脉高压。HVPG的测量为有创操作、病人不适感强、费用较高,且对操作者有一定技术要求,因而不能在临床上广泛开展。临床上通常根据门静脉高压的临床表现食管胃底静脉曲张或脾大伴随血小板计数<100×109/L来判断门静脉高压。
(二)合并门静脉高压肝癌的外科治疗
1.肝移植
是治疗合并门静脉高压肝癌最理想的手段,这在国内外已达成共识。肝移植既消除病灶又去除肝硬化肝脏,解决门静脉高压问题,目前常用的肝移植标准为意大利Milan标准:单个肿瘤直径不超过5cm,或肿瘤数目不超过3个,最大直径不超过3cm,不伴有血管及淋巴结的侵犯;以及美国加州旧金山大学(University of California, San Francisco,UCSF)标准:单个肿瘤直径不超过6.5cm,或肿瘤数目不超过3个,最大直径不超过4.5cm,总的肿瘤直径不超过8cm,不伴有血管及淋巴结的侵犯。肝移植的开展已没有技术瓶颈,且预后较好,但是目前我国合并门静脉高压肝癌病人基数大,肝源紧缺,费用高,术后长期服用免疫抑制剂,一般家庭难以承受,因而对大多数病人来说,肝移植往往并不是首选方案。
2.肝切除
(1)手术适应证:肝切除治疗合并门静脉高压肝癌在东西方国家之间存在争议。早期回顾性研究提示合并门静脉高压肝癌病人肝切除术后并发症高,长期预后较差,门静脉高压是肝切除的禁忌证。基于这些研究的2001年EASL和2005年AASLD肝癌临床指南均将门静脉高压列为肝癌肝切除的手术禁忌证。尽管随着临床证据的增加、样本扩大、证据级别的提高,目前EASL和AASLD肝癌临床指南仍未将合并门静脉高压肝癌的手术治疗视为一线治疗。然而,亚洲国家特别是我国,合并门静脉高压肝癌的肝切除从来就不是问题。早在2001年中华医学会外科学分会肝脏外科学组就制定原发性肝癌合并肝硬化门静脉高压症的外科治疗方法和适应证:①病人一般情况较好,无明显心、肺、肾等重要脏器器质性病变;肝功能正常,或仅有轻度损害,按肝功能分级属A级,或肝功能属B级,经短期护肝治疗后有明显改善,肝功能恢复到A级;肝储备功能正常范围;无肝外转移性肿瘤;②局部情况:可切除的肝癌,有明显脾大、脾功能亢进(如白细胞计数低于3×109/L,血小板低于50×109/L)表现者,可同时作脾切除术;有明显食道、胃底静脉曲张,特别是发生过食道胃底曲张静脉破裂大出血者,可考虑同时作贲门周围血管离断术;有严重胃黏膜病变者,如病人术中情况允许,应行脾肾分流术或其他类型的选择性门腔分流术。术中发现为不可切除的肝癌,有明显脾大、脾功能亢进(如白细胞计数低于3×109/L,血小板低于50×109/L)表现,无明显食道、胃底静脉曲张者,行脾切除术的同时,在术中作选择性肝动脉插管栓塞化疗,冷冻治疗或射频治疗等;有明显食道、胃底静脉曲张,特别是发生过食道胃底曲张静脉破裂大出血,无严重胃黏膜病变,可行脾切除,或脾动脉结扎加冠状静脉缝扎术;是否做断流术,根据病人术中所见而定。然后,术中作射频或冷冻治疗;不宜作肝动脉插管栓塞化疗。
(2)手术安全性评估:合并门静脉高压肝癌病人术前需行严格的评估,除了需评估肿瘤状态,病人身体状况和肝功能外,还需要评估门静脉高压程度。病人体力状况为ECOG评分0~1分。肝功能的评估目前主要通过Child-Pugh改良分级评分行肝功能分级、ICGR15了解肝脏储备功能以及肝体积测量评估残余肝体积。肝功能C级为手术禁忌证,ICGR15大于40%,术后发生肝衰竭的风险较大,肝硬化病人术后残余肝体积一般要大于40%。此外,肝硬化的程度也需要进行评估,术前肝硬化评分系统内容包括食管胃底静脉曲张、门静脉宽度、脾脏厚度和血小板计数,无或轻度肝硬化0~1,中度肝硬化2~3,重度肝硬化≥4(表2)。门静脉高压的评估临床上主要通过胃镜了解食管胃底静脉曲张状态,通过彩超和血常规、血红蛋白、血小板以了解脾脏大小和脾功能亢进情况。合并门静脉高压的肝癌病人行肝切除术后有一定的胆漏、肝衰竭、腹水等风险以及脾切除术后门静脉系统血栓形成的风险,但通过对病人的选择,严格的术前评估和精细围手术期的管理,上述并发症均是可控的,总体来说,病人是安全的。
表2 术前肝硬化评分系统
(3)手术方式
1)肝癌的处理方式:门静脉高压病人能够行肝切除前提是没有腹水或者可控腹水,血清总胆红素低于1.2mg/dl。对于可切除肝癌,肝切除范围取决于血清总胆红素,白蛋白,胆固醇及凝血酶原时间。血清总胆红素0.7~1.2mg/dl,白蛋白35g/L及以下,胆固醇3.6mmol/L以下,凝血酶原时间3~4秒,则只能行小范围肝切除(2个肝段及以下)。血清总胆红素小于0.7mg/dl,白蛋白大于35g/L,胆固醇大于3.6mmol/L,凝血酶原时间延长小于3秒,则可以行大范围肝切除(3个肝段及以上),但残余肝体积比需大于60%。合并门静脉高压肝癌病人均有不同程度肝硬化,轻度肝硬化或无肝硬化病人,可以耐受4个肝段切除,但肝衰竭的发生率为9.1%;中度肝硬化病人行大范围肝切除,术后肝衰竭的发生率明显高于小范围肝切除(38.1%vs3%);对于重度肝硬化病人行2个肝段及以上肝切除,术后肝衰竭的发生率高达63.2%。因而,随着肝硬化程度的加重,在保证切缘情况下,尽量行小范围肝切除。另外,对于直径小于2cm肿瘤可选择微波固化或者射频消融治疗,从而避免了切肝导致的术后肝衰竭。术中发现的不可切除肝癌,仅作姑息性处理。
2)门静脉压高压的处理方式
A.不联合脾切除或贲门周围血管离断:脾大,脾功能亢进较轻(如白细胞计数高于3×109/L,血小板高于50×109/L,低于100×109/L),目前没有足够的证据表明病人行脾切除会获益,因而,门静脉高压情况可不作处理。针对这种情况,一项关于肝部分切除联合脾切除治疗肝癌合并肝硬化脾功能亢进病人多中心、随机、阳性平行对照临床研究正在进行中(注册号:ChiCTR1900024695)。
B.脾切除:脾大,血小板低于50×109/L,食管胃底静脉曲张不明显,可联合行脾切除手术,术后T细胞亚群和Th细胞平衡可以恢复,白细胞和血小板计数能够恢复正常,此外,术后肝脏胆红素代谢负担也能够减轻,从而有利于肝功能恢复。
C.贲门周围血管离断术:胃镜提示食管胃底静脉重度曲张或伴有红色征,以及发生过食管胃底曲张静脉破裂大出血病人,需联合行贲门周围血管离断术。贲门周围血管离断术即时止血率高、手术死亡率低、对肝脏灌注影响小、术后肝性脑病发生率低,且手术操作简单,易于推广。
D.分流术:胃黏膜严重病变的病人,可行脾肾分流术或其他类型的选择性门腔分流术,但是大量分流会使门静脉血流减少,术后肝功能可能会进一步恶化,肝性脑病发生率高,目前对于肝癌合并门静脉高压症的病人,肝切除不同时行分流术。
(4)手术效果:合并门静脉高压肝癌手术切除是安全有效的,总体生存率和总体无瘤生存率与非门静脉高压肝癌病人相当。合并门静脉高压肝癌的病人,接受肝切除或联合脾切除或贲门周围血管离断术,生存预后明显优于TACE或热消融治疗,且与非门静脉高压肝癌病人无差异。Chen XP等回顾性分析204例肝癌合并肝硬化门静脉高压、脾功能亢进的病例,94例接受了肝切除加脾切除,110例仅接受了肝切除,两组在肝切除的范围及术后并发症上无统计学差异。术后5年总体生存率两组无统计学差异,但是肝切除加脾切除组5年总体无瘤生存率(37%)优于单纯肝切除组(27.3%,P=0.003)(图1)。肝切除加脾切除组术后全部接受了6个周期的化疗,而肝切除组只有15.5%的人能够耐受化疗。因为脾切除后机体的白细胞和血小板能够恢复正常,脾切除能够影响肝脏代谢,缓解肝硬化的进展以及改善肝功能及机体的免疫功能,从而能够让病人有条件接受后续治疗,改善生存预后。另外脾切除或者联合贲门周围血管离断,可减少门静脉血流,减低食管胃底曲张静脉破裂出血的风险,这也利于病人长期生存。该研究提示肝切除联合脾切除是治疗肝癌合并肝硬化脾功能亢进的有效手段。因而,门静脉高压不是肝癌肝切除的手术禁忌证,反而针对门静脉高压所引起脾功能亢进和食管胃底静脉曲张需要扩大手术方式,更有利于改善病人的生存预后。
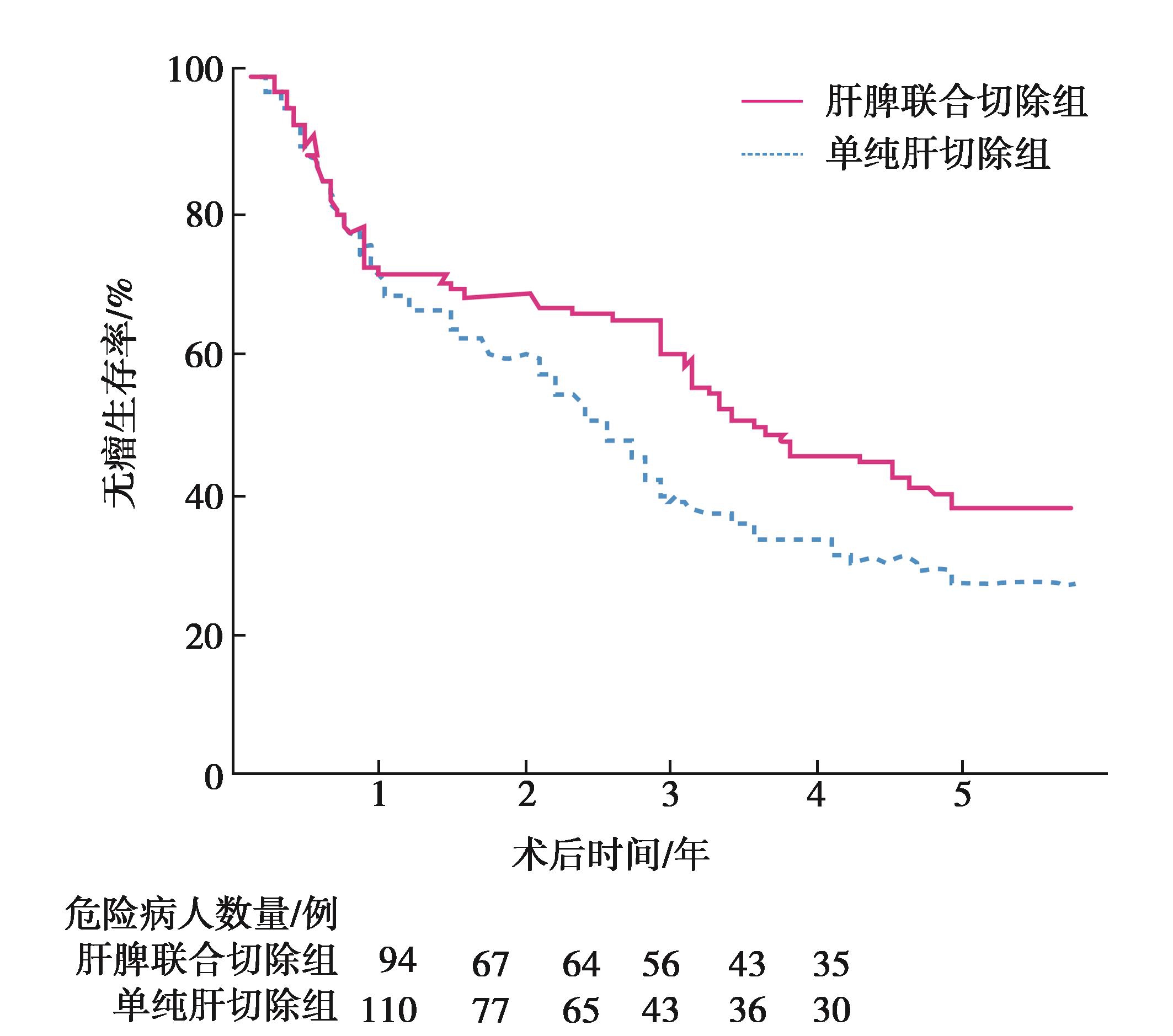
图1 肝脾联合切除组病人无瘤生存期显著高于单纯行肝切除病人
因此,肝切除在我国是治疗合并门静脉高压肝癌的一线治疗措施,有明显脾肿大、脾功能亢进需扩大手术方式同时行脾切除。有明显食管、胃底静脉曲张,特别是发生过食管胃底曲张静脉破裂大出血者,需同时行贲门周围血管离断术。
3.非手术治疗
对于合并肝硬化门静脉高压不可切除肝癌的病人(肿瘤多发、巨大、门静脉广泛癌栓等无法切除),在肝功能和病人身体状况允许的情况下,可选择介入或放疗、靶向治疗、免疫治疗、中医中药等治疗手段。脾肿大伴严重的脾功能亢进,可选择脾动脉栓塞治疗。食管胃底静脉曲张破裂出血,首选内镜治疗。
4.小结
合并门静脉高压肝癌的治疗,在条件允许的情况下,首选肝移植,但肝切除联合脾切除或贲门周围血管离断术仍是主流治疗手段。
知识来源
人卫知识数字服务体系
作者:龙新,陈孝平,华中科技大学同济医学院附属同济医院
专家简介
龙新
专业职称:副主任医师、副教授
师从著名外科学家陈孝平院士,本科毕业于武汉同济医学院,美国Johns Hopkins大学医学院访问学者。国际肝胆胰协会中国分会肝胆胰外科ERAS专业委员会秘书,国际肝胆胰协会中国分会肝胆胰外科MDT专业委员会委员,湖北省临床肿瘤学会青委会委员。主持国家自然科学基金1项,参与国家自然科学基金8项,主持湖北陈孝平科技发展基金会肝胆胰恶性肿瘤基金1项,主持华中科技大学博士学位论文创新基金1项和同济医院重点基金1项,参与华中科技大学自主创新重点专项研究基金1项,发表SCI论文20余篇,单篇最高影响因子14分,获肝癌方向发明专利1项。
陈孝平
专业职称:教授 主任医师
中国科学院院士,教授、博士生导师,华中科技大学同济医学院同济医院外科学系主任、肝脏外科中心主任、肝胆胰外科研究所所长,对普通外科疾病的诊断及治疗积累了丰富经验。在肝胆胰外科领域取得了巨大的成就,施行过各类手术一万多例。其成果得到国内外同行认同,先后获国家科学与技术进步奖二等奖、教育部提名国家科技进步奖一等奖、中华医学科技奖一等奖和湖北省科技进步奖一等奖各1项;2007年获何梁何利科学与技术进步奖;2008年获中国肝胆胰外科领域杰出成就金质奖章;2010年获教育部科学技术进步二等奖;2012年获中国抗癌协会科技奖一等奖;2013年获湖北省科技推广奖一等奖。
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

