林岩松教授:甲状腺癌全程管理理念
甲状腺癌以其发病率逐年增高、患病基数巨大成为临床上最常见的内分泌系统肿瘤。由于占甲状腺癌90%的分化型甲状腺癌(DTC)经手术、碘-131治疗及促甲状腺激素(TSH)抑制治疗后多数预后良好,准确监测可能的复发、使患者达到无病状态,是针对甲状腺癌患者终生随诊管理的主要目的。然而,如何在甲状腺癌患者漫长的终生管理中,有效地协调外科、核医学、内分泌、放疗科、肿瘤科等多学科团队(MDT),利用最佳的病理、影像学、血清学等诊断、监测手段,权衡利弊,为患者制订切实的治疗及随访方案,达到控制疾病、预防复发、改善患者生存质量的目的,仍是甲状腺癌临床全程管理的重点、难点和努力的方向。本文主要以DTC为例,从DTC一线治疗理念的形成、诊断技术的进步、多学科团队(MDT)及精准医学四个方面对甲状腺癌全程管理理念的推动角度,浅谈甲状腺癌的全程管理理念的形成。
一、分化型甲状腺癌一线治疗体系的形成
从人类认识、探索甲状腺及其疾病的历史中,可以一窥甲状腺癌诊治与随访的全程管理理念的形成历程(图1)。甲状腺癌的外科治疗可追溯至961年,A.Kasim第一次描述了甲状腺肿的切除;A.Vesalius于1543年在《人体构造》一书中描述了甲状腺的解剖结构。1646年,W.Fabicus报道了第一例甲状腺腺叶切除术,但他却因患者术后死亡而入狱,为甲状腺手术的创新探索付出了代价。1857年,M.Sciff成功完成动物甲状腺全切除术后,E.T.Kocher更是利用扎实的精细解剖知识、细致的止血技术和卓越的手术技能,将甲状腺切除术这项当时出血多、伴有甲状旁腺及喉返神经损伤等严重并发症、死亡率高达40%以上的“外科禁区”,变成了死亡率1%以下的“无血的”安全术式,自此开启了甲状腺癌规范化手术治疗的里程。
同样可贵的是,在手术的同时,Kocher也非常注重观察临床症状、善于思考总结。1874年他注意到11岁患儿甲状腺术后出现的懒散、呆笨、发育迟缓等表现可能与甲状腺切除过多有关,并尝试通过注射甲状腺组织提取物对患者进行治疗。随后,他总结出甲状腺的主要功能是合成甲状腺激素,甲状腺激素参与机体生长、发育、代谢的调节。Kocher因其在甲状腺领域生理学、病理学及手术的卓越成就获1909年诺贝尔生理学或医学奖。1997年C.S.Huscher报道了首例腔镜手术治疗甲状腺癌,开启了甲状腺癌微创手术治疗的先河。外科学技术的不断改进及外科医生的探索不仅在甲状腺癌全程管理理念中起到了引领作用,更促进了内分泌等相关学科在甲状腺癌诊疗中的发展。
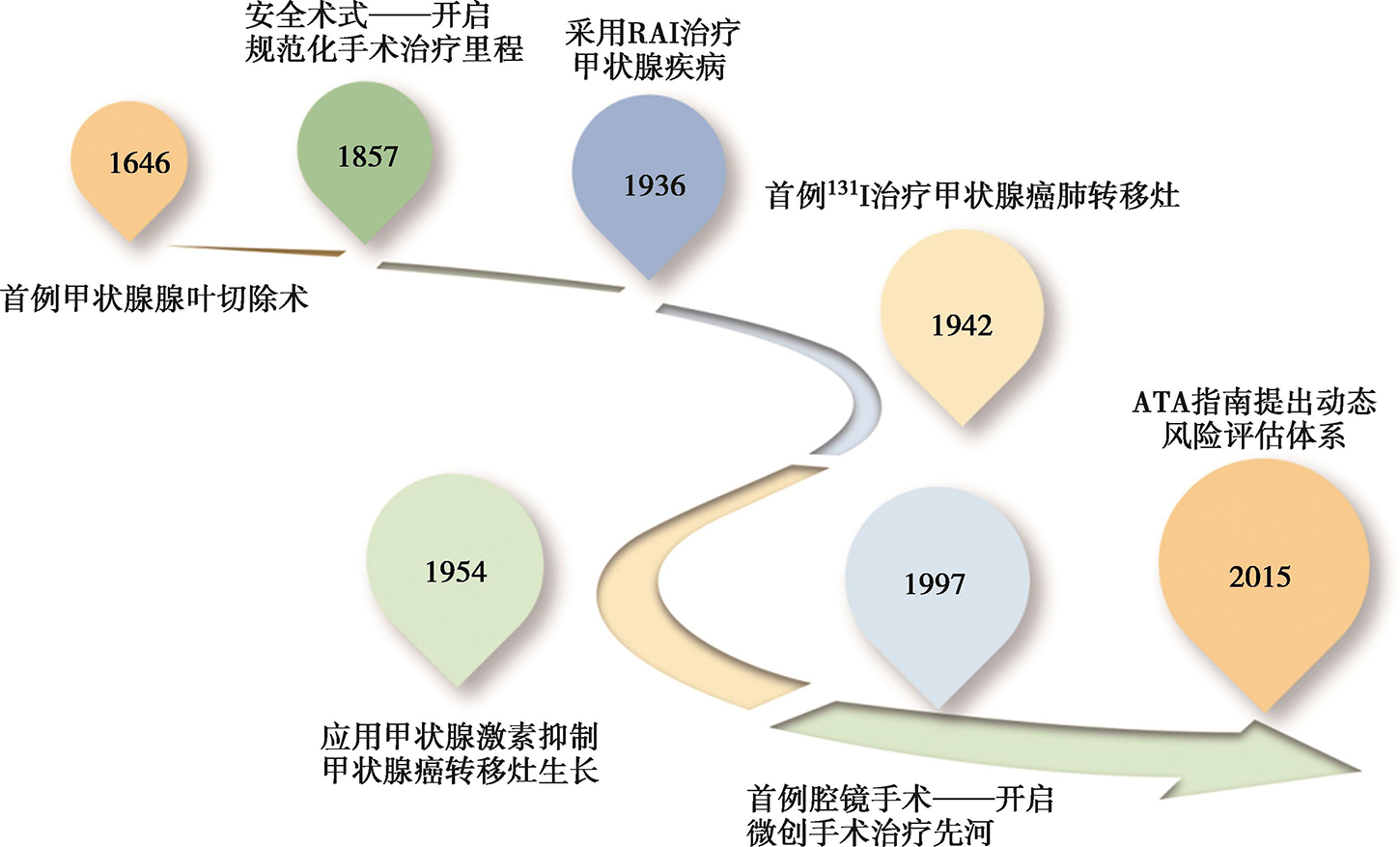
图1 甲状腺癌诊治与随访全程管理理念的形成历程
虽然核医学在甲状腺癌诊治中的应用得益于现代物理学的蓬勃发展及其与相关学科的融合及互动,但碘与甲状腺的关系则可追溯至公元前2700年,《神农本草经》中就记载了采用海藻治疗甲状腺肿(中医称“瘿瘤”)的方法。19世纪起,诸多的探索和发现使碘与甲状腺疾病之间的联系逐渐明晰,如1811年B.Courtois用硫酸氧化海草灰的过程中发现了碘元素;1820年J.F.Coindet提出碘缺乏致甲状腺肿的理论,并用碘来治疗甲状腺肿;1825年J.B.Boussingault在天然盐中发现了碘,并推荐用加碘盐来预防和治疗地方性甲状腺肿;1896年E.Baumann发现碘是甲状腺组织的天然组成部分,并将甲状腺摄碘的部位命名为“iodothyrin”。这些研究使人们逐渐意识到碘在甲状腺生理及病理中的重要意义。1917年M.Seymour采用X射线治疗格雷夫斯病(Graves disease),创立了外放射治疗甲状腺疾病的理念。随着现代物理学及放射性示踪技术的发展,放射性碘131(131I或称RAI)在甲状腺疾病诊治中的创新应用应运而生。在1936年11月12日波士顿的一次由麻省理工学院(MIT)主持的与麻省总医院(MGH)午餐座谈上MIT校长、物理学家K.Compton做了“物理学可以为生物学和医学做些什么?”主题报告后,来自MGH甲状腺专科主任Saul Hertz提出“是否可以人工生产碘的放射性同位素”,并在随后与Compton的通信中,提出基于甲状腺可以特异性摄取碘的现象,采用RAI治疗甲状腺功能亢进的想法。内分泌学与核物理碰撞产生的这一创新性的设想开启了核医学在甲状腺疾病诊治中的应用。1936—1943年Hertz等采用RAI进行甲状腺生理学研究,并成功将其用于甲状腺机能亢进的治疗。1943年在碘显像上发现一例甲状腺癌伴甲亢患者的肺转移灶可以浓聚放射性碘后,S.M.Seidlin第一次成功采用131I治疗控制该患者的甲状腺癌转移灶及其肿瘤源性甲亢症状。1948年Hertz在一次研讨会中提出RAI是第一个癌症的靶向治疗手段的理念,从此,放射性碘成为甲状腺癌术后的重要辅助治疗手段。
在甲状腺癌的内分泌治疗方面,我们同样看到了无数善于思索又不乏勤奋的身影,体味到内分泌学与外科学、核医学间密切的联系。甲状腺激素的治疗可追溯到1475年的中国,中医王喜采用破碎甲状腺组织治疗甲状腺肿(goiter)。1922年P.E. Smith等发现用牛垂体提取物可以有效刺激垂体功能低下的蝌蚪的甲状腺组织,初步揭示了垂体对甲状腺的调控作用;1927年C.R.Hariton等合成甲状腺素、确定了其化学结构,并证实了其生理学活性,为甲状腺功能减退(甲减)的病因、诊断及后续甲状腺激素抑制治疗奠定了基础。1931年,C.vanCaulaert等的研究提示甲状腺与垂体间的反馈调节机制;1937年L.Loeb等从牛垂体中提取并纯化出促甲状腺激素(TSH)。有关TSH与甲状腺癌抑制治疗关系的记载应追溯到1937年的一次英国伦敦医学会讲座,来自外科的TP.Dunhill报道了给予大剂量干甲状腺片后两例DTC复发患者复发病灶逐渐消失的现象。1949年,R. G.Hoskins发现了甲状腺对垂体的负反馈调节机制。与此同时,随着人们对甲状腺激素、TSH及甲状腺组织131I摄取率关系的认识,围131I治疗期的甲减所致的高TSH水平被视为可以增加RAI疗效的“得力助手”;但亦有在甲减期间DTC患者转移灶快速生长的报道。在前述现象的基础上,Balme医生通过观察停用甲状腺素前后患者对131I摄取率的变化,提出应用甲状腺激素抑制甲状腺癌转移灶生长的抑制治疗模式,指出其可能通过抑制TSH而阻止甲状腺癌肺转移的进展。1954年Balme医生在Lancet杂志开创性报道了应用甲状腺激素抑制甲状腺癌转移灶生长的发现及其理论。
从上述甲状腺癌一线治疗体系的发展历程,我们看到每一个勤奋探索者的发现,每一个有准备的头脑在学科间碰撞中所暴发的灵感,及其带给后人的启发。事实上,很难用学科的概念将上述三种治疗严格划分,可以看到在对甲状腺癌的认识和治疗的探索中三者相互融合、相互促进,从而形成了甲状腺癌一线治疗间彼此密切的协作关系,这也正是一个多学科治疗模式建立的过程。对于有长期生存可能的甲状腺癌患者,MDT的管理目前已经成为甲状腺癌从诊断、治疗到随访的全程管理的持续模式,这种全程管理模式要求我们在甲状腺癌患者的长期管理中,应兼顾疗效及治疗风险,以提高患者生活质量为最终目的。
目前,DTC外科治疗被认为是影响预后的最重要治疗措施,已形成了基于系统术前评估来决定术式的治疗体系,并且是后续131I治疗的前提。131I治疗形成基于术后、131I治疗前实时动态风险评估的循证治疗体系,并将治疗的理念细化为“清甲”“辅助”治疗及“清灶”治疗,作为DTC尤其是中高危患者术后重要治疗手段,降低了转移性DTC的复发及死亡风险。DTC的TSH抑制治疗亦已形成基于DTC双风险分层的细化管理体系。
二、诊断技术的进步
“工欲善其事,必先利其器”,在甲状腺癌全程管理中,兼顾灵敏度和特异性的有效诊断监测手段至关重要。治疗前精准识别甲状腺癌累及范围及转移等情况,尽可能对病情进行全面准确的评估,以降低过度治疗或治疗不足的风险。甲状腺癌诊断手段的不断进步和突破,对甲状腺癌全程管理有着明确的推动作用。
早在公元961年,A.Kasim便描述了甲状腺的针吸活检术;1948年,T.Tempka等提出采用细针穿刺作为甲状腺疾病的诊断手段;1975年,R.Petzoldt等开始在超声引导下对囊性甲状腺结节进行囊液抽吸,并对实性成分进行细胞学活检。发展至今,更为精准的超声引导下细胞学活检诊断技术已成为甲状腺癌常规的术前评估手段,是甲状腺癌的全程管理初期的重要环节。
甲状腺癌病理学诊断的发展可以追溯至1822年,M.J.Chetuins报道一例弥漫浸润性甲状腺癌导致颈部肿大的病例,肿瘤广泛浸润至周围气管、肌肉等邻近组织;1843年,C.Hawkings报道了当时非常罕见的甲状腺癌;1855年,T.Billroth报道了甲状腺肿瘤伴颈部淋巴结转移。1876年,J.Cohnheim首次提出甲状腺癌组织学分类,并指出部分甲状腺癌形似正常腺体,将其命名为“良性转移性甲状腺肿”;1934年,BF.Schreiner提出将甲状腺恶性肿瘤分为癌、腺癌和肉瘤。1948年,G.J.Crile等将甲状腺癌分为乳头状癌和非乳头状癌;在1953年S.Warren等所编撰的《甲状腺肿瘤》的病理图谱中,提出将甲状腺癌分为分化型(包括乳头状癌和滤泡癌)和未分化型(甲状腺未分化癌);1959年,J.B.Hazard等确认甲状腺髓样癌是一种与其他甲状腺癌截然不同的病理类型;1961年L.B.Woolner提出甲状腺癌的主要分类,即乳头状癌(papillary thyroid cancer,PTC)、滤泡癌(follicular thyroid cancer,FTC)、髓样癌(medullary thyroid cancer,MTC)及未分化癌(anaplastic thyroid cancer,ATC);1984 年,M.L.Carcangiu等描述了介于甲状腺癌分化型与未分化型之间的侵袭性较强的分化较差型DTC。1987年,RET/PTC作为第一个甲状腺癌的基因变异特征被鉴别出来,此后人们逐渐认识到RET/PTC、TRK、PAX8-PPARG等基因重排所编码的融合蛋白在甲状腺癌细胞转化中的作用;伴随着癌症基因图谱(TCGA)研究在甲状腺癌的深入,更多有关甲状腺癌的基因突变如BRAFV600E突变、重排等被识别,使人们明确了这些分子特征在甲状腺癌发生、进展中的决定性作用的同时,也将传统的病理分型进一步细化,例如将PTC进一步分为伴有RAS基因变异的“RAS样肿瘤”和BRAF基因变异的“BRAF样肿瘤”。随着生命科学技术的不断发展,对甲状腺癌病理学的认识也从组织-细胞逐渐向基因深入。
DTC的血清学监测指标的探索可以追溯到1923年,L.Hektoen等首次用沉淀反应法发现犬的甲状腺组织中存在甲状腺球蛋白(Tg),并在1925年报道了用抗原抗体反应在人血液中检测出Tg;1956年N.R.Rose等报道了对甲状腺球蛋白(Tg)的自身免疫反应;1956年I.M.Roitt等发现在桥本甲状腺炎组织中存在自身抗体,并进一步证实该病是由这些抗体针对正常甲状腺组织的细胞毒性破坏所致。随后,人们逐渐认识到,在甲状腺全切以及131I清甲后,无抗甲状腺球蛋白抗体(TgAb)干扰下,具有高度组织特异性的Tg可以在一定程度上提供DTC肿瘤负荷、复发、转移等信息,成为监测分化型甲状腺癌复发及转移的灵敏指标。因此,Tg作为DTC治疗、随访及全程管理中监测病情变化的最经济、实用指标。1961年,D.H.Copp首次描述了降钙素,这为甲状腺髓样癌的监测及随访带来了便利。1965年S.Berson和R.Yalow发展了放射免疫分析法,并因此获得1977年的诺贝尔生理学或医学奖,为甲状腺癌相关血清学指标的检测及随诊提供了灵敏的方法。
超声作为甲状腺癌重要的一线评估手段,具备灵敏、便捷、经济、无辐射、人群(包括儿童及孕妇)普适性高等其他影像学所不具备的优势,在全程管理中发挥着重要作用。超声技术在甲状腺方面的应用始于1964年,M.Takano试验性地将A型超声波应用于甲状腺疾病的诊断,而随后更先进的B超提供了甲状腺及周围组织器官二维灰阶断面图像,彩色多普勒提供大于100μm以上血管的信息,使其应用从甲状腺肿及“冷”结节定性诊断逐渐发展至良恶性鉴别。1968年,R.Gramiak和Shah在心导管检查时发现可以利用快速推注生理盐水时产生的微气泡成像,从此开启了超声成像的二次革命——超声造影(contrast enhanced ultrasound,CEUS),为甲状腺癌的诊断与鉴别诊断提供了微循环灌注信息。1991年,J.Ophir等提出了超声弹性成像(ultrasonic elastography,UE)的概念,尝试利用超声来反映结节硬度,从而推断结节的良恶性。这些新技术已使超声成为甲状腺癌全程管理,包括甲状腺结节诊断、疗效评估及随访的重要手段。而随着计算机深度学习理论(deep learning,DL)的不断突破和创新,人工智能(artificial intelligence,AI)在超声中的应用有可能对未来的甲状腺癌诊断、治疗及临床路径带来革命性变化,为甲状腺癌高效、精准的全程管理提供了无限的可能性。
计算机断层扫描(computed tomography,CT)作为当今最重要的影像学手段之一,在甲状腺癌的评估中也发挥着重要的作用。早在1967年,G.Hounsfield发明出第一台CT机,并在1973年正式投入临床应用。1977年,B.S.Wolf等提出CT可以用于甲状腺及其低密度结节的成像,增强后成像效果更佳。1989年,滑环技术的发明促使螺旋CT(spiral CT)问世,1998年,多层螺旋CT(MDCT)的问世,开创了容积数据成像的新时代,伴随着CT技术的飞速发展,扫描时间不断缩短,图像的分辨率不断提高,CT能清晰显示各种形态大小的钙化灶,平扫即可清晰显示含碘量高的甲状腺组织;应用薄层图像联合多平面重建技术(multiplanar reformation,MPR)能很好地观察病变范围、与邻近结构的关系。在显示病变整体、局部侵犯、区域淋巴结转移情况及病变与大血管的关系等方面,CT有着不可取代的作用,对明确肿瘤分期、术前制订手术方案、预测手术中可能发生的损伤、治疗后的随访有重要意义。
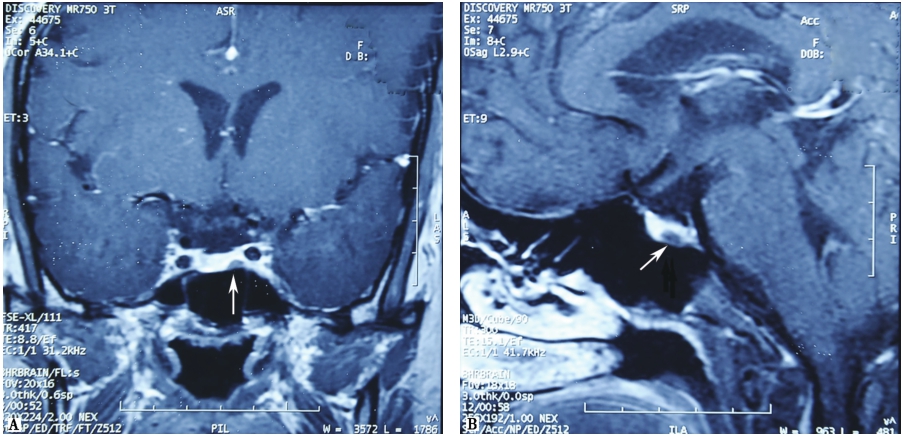
磁共振成像(magnetic resonance imaging,MRI)是继CT之后影像医学领域的另一重大突破。1973年,P. Lauterbur和P.Mansfield搭建了最初的磁共振成像系统,并对充满液体的物体进行了成像。1978年,0.15T的磁共振系统问世,并于1980年得到了第一幅人类头部磁共振图像和第一幅二维傅里叶变换后的图像。1984年,D.D.Stark等首次将MRI用于甲状腺成像。随后,MRI的磁场强度不断提升,从最初的0.15T到如今临床应用最广的3T,大大提高了图像的信噪比及空间和时间分辨率,使其在甲状腺癌的探测中具有软组织分辨率高,无电离辐射,可多序列扫描,进行解剖及功能成像等优势。除探查病变的大小、周围组织的侵犯及可疑颈部淋巴结的转移外,磁共振扩散加权成像、动态增强成像、波谱成像有助于鉴别甲状腺癌的良恶性。同时,MRI避免了增强CT含碘造影剂延后131I治疗可能贻误高危DTC患者治疗的问题,成为CT等影像学检查重要的补充手段。
而相较于超声、CT、MRI成像,核医学成像技术可采用反映糖代谢、生长抑素受体、前列腺特异膜抗原PSMA表达等多种分子显像手段来协助探测分化较差或不摄碘DTC病灶的生化特性,为其后续治疗提供依据。
目前,上述诊断技术已成为甲状腺癌MDT的重要组成部分,为全程管理中的临床后续治疗及随访决策制定提供了重要依据(图2)。
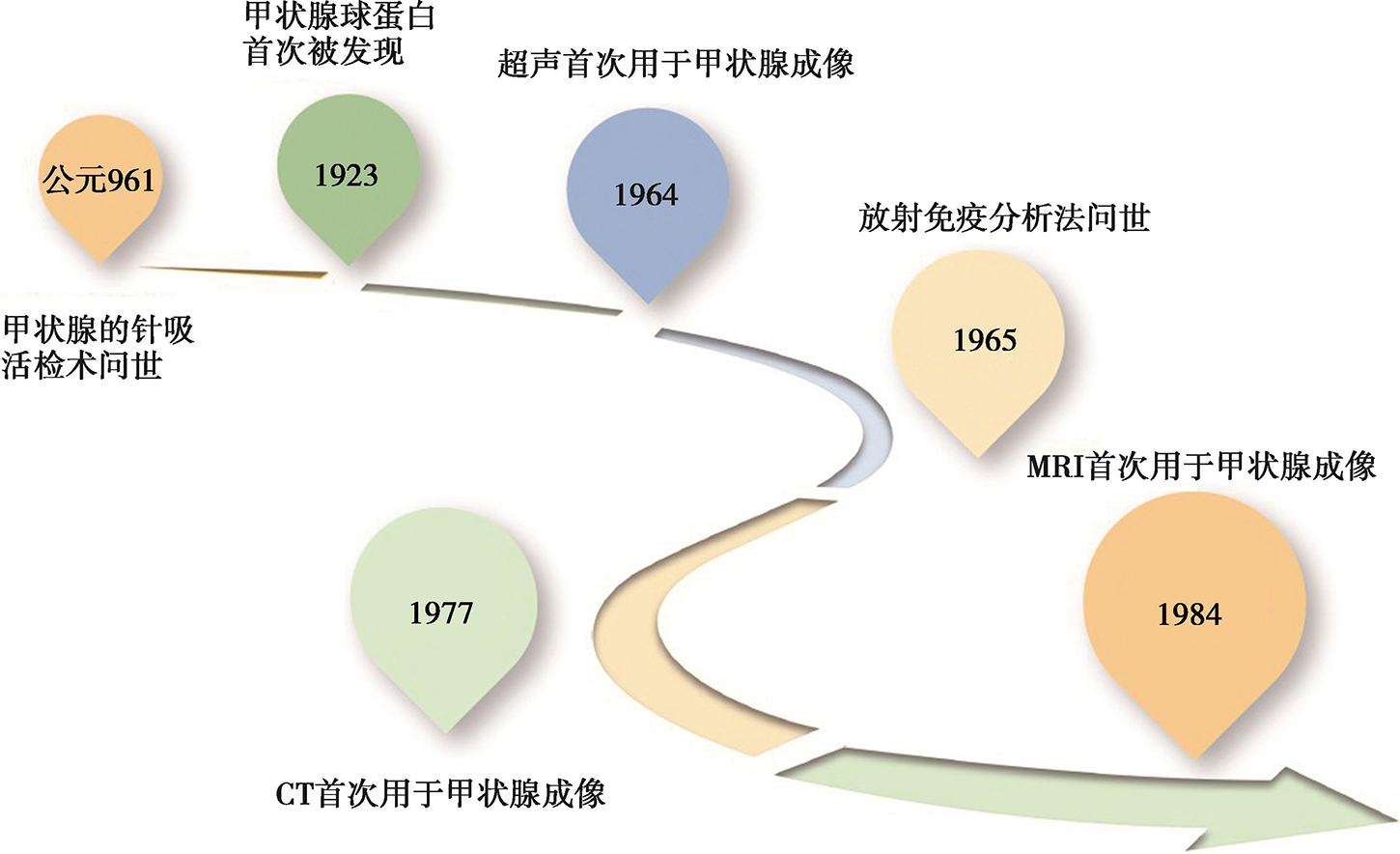
图2 甲状腺癌管理中诊断技术的进步历程
三、多学科团队在甲状腺癌全程管理中的意义
对甲状腺癌的认识和治疗的探索中处处都体现了各学科之间的相互融合、相互促进,MDT在甲状腺癌全程管理中的重要性不言而喻。MDT是强调以患者为中心的多学科管理模式,这种贯穿甲状腺癌全程管理的MDT模式可减少单一专科医生判断及决策的局限性,各科医生群策群力、扬长避短、互相补充,以期达到:①更精确的疾病分期;②较少的治疗混乱和延误;③更个性化的评估和治疗;④更好的治疗衔接;⑤更高的生活质量;⑥最佳的临床和生存获益。
DTC独特的生物学特征,如部分保留了甲状腺滤泡细胞摄碘和碘的有机化、对TSH刺激的反应等,使131I治疗及TSH抑制治疗得以成为术后重要的辅助治疗手段,更奠定了DTC独特的多学科MDT管理模式的基础。DTC一线治疗的相关理念(图3)已逐渐成熟,不论是外科、核医学科或内分泌科,更先进的治疗理念、更合理而个体化的方案、更佳的生存获益都是大家共同的追求。而更精细的病理分期、更精准的检验及显像技术所提供的患者疾病状态信息,则是一切治疗决策的依据和基础。从诊断、治疗到长期管理,患者始终都处于多学科的监管下;每一学科的理念进步,也在促成其余相关领域的不断更新。
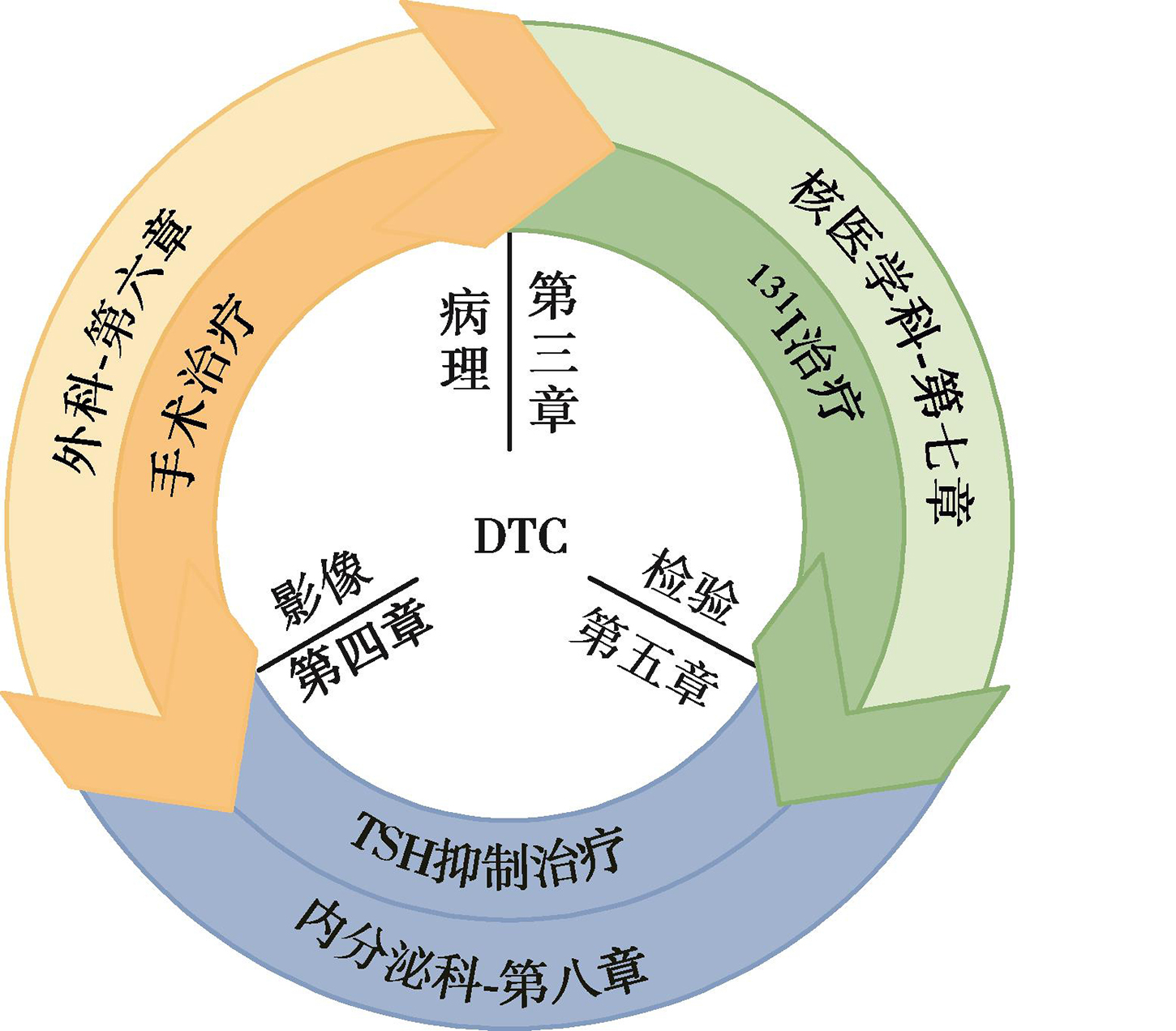
图3 DTC一线治疗相关理念
由于兼具发射β、γ射线的核素性质,131I在DTC的管理中有着独特的诊治一体化功能,这使131I治疗得以形成不同于其他肿瘤系统治疗的“可视化”治疗模式;通过SPECT成像,我们可以追踪患者甲状腺残余组织及转移病灶的摄碘情况,预估治疗疗效。虽然DTC在一定程度上保留了摄碘及碘有机化功能,但DTC细胞摄碘及有机化功能存在缺陷,表现为对131I的快速释放、相对短的有效半衰期及低的甲状腺激素合成速率,这会使131I治疗效果欠佳,呈现碘难治性。放射性碘难治性DTC(radioiodine refractory differentiated thyroid cancer,RAIR-DTC)的全程管理中更体现了开放灵活的MDT协作模式的重要性。131I治疗前或治疗后的核医学显像可以快速、灵敏地监测到病灶不摄碘的特征,早期判定病灶RAIR-DTC的性质;而利用超声、放射等手段均有助于来协同寻找不摄碘的病灶;活检及细针穿刺病理学则有助于明确其分子特征;核医学显示糖代谢、生长抑素受体、前列腺特异膜抗原PSMA表达等多种分子影像学手段可用于协助探测不摄碘病灶的生化特性;种种诊断学手段为其后续放疗、化疗、靶向治疗及免疫治疗提供依据。而外科、放疗科、肿瘤科、放射及超声介入治疗等专科将依据病灶进展情况决策进一步的必要干预治疗。这些更大范围的MDT团队协作体现了除一线治疗外的更多学科在甲状腺癌尤其是DTC全程诊治、随访决策中的协同作用。有关RAIR-DTC的MDT协作诊治模式详见图4。
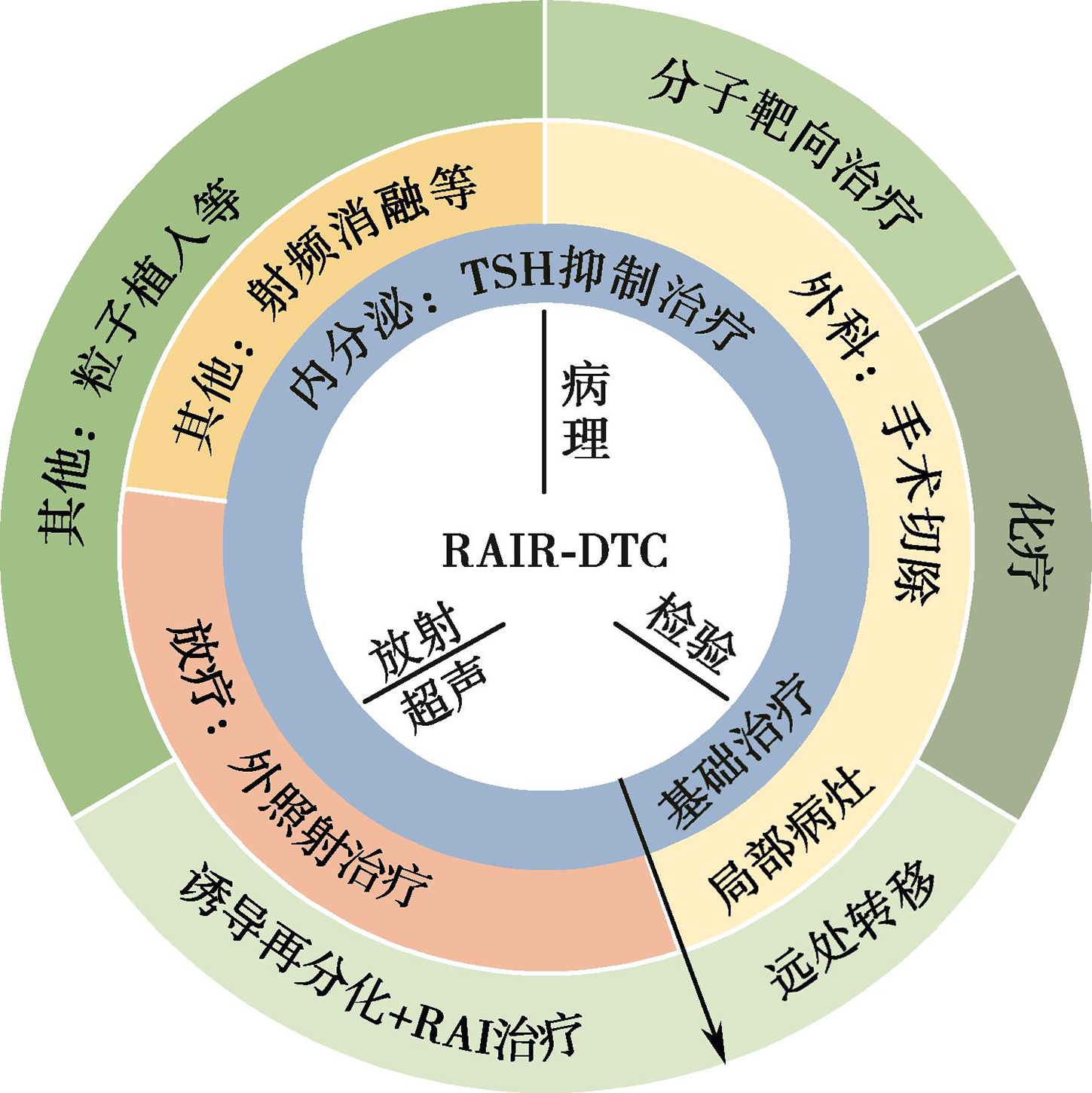
图4 RAIR-DTC的MDT协作诊治模式
围绕甲状腺癌的临床诊治,1987年3月,来自13个国家的外科、核医学科、内分泌科及病理科专家在荷兰莱顿就甲状腺癌的诊治中的争议进行讨论并推出共识。随着此类多学科、多地区间的交流的兴盛,1996年美国甲状腺协会(American Thyroid Association,ATA)、美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)及日本甲状腺协会先后出台了有关甲状腺结节及分化型甲状腺癌的临床诊治指南,2003—2010年德国及欧洲甲状腺协会出台了相关指南;2012年我会中华医学会等四学会制定了中国甲状腺结节及甲状腺癌诊治指南。各类指南及规范的出台,推动了世界范围内甲状腺癌诊治的规范化进程,改善了患者的生存质量及无病生存。
另外,在治疗方案的选择中,患者的意愿和就诊时的具体情况也有着极大的权重。每一项临床决策都应与患者讨论,以明确风险及获益、可能的不确定因素及其临床意义。尊重患者的价值观及偏好,依据情况作出最可行的选择,不仅是个体化医疗的体现,更是甲状腺癌全程管理的重要组成部分。
四、有关甲状腺癌的精准治疗
伴随着基因组、蛋白质组、影像组等组学技术及数据信息及人工智能技术等的不断进步,精准医疗(precision medicine)已逐渐成为集疾病个体生物信息与大数据科学的交叉应用于一体的新型医疗管理模式。其旨在最终实现对于疾病和特定患者的个性化精准治疗,提高疾病诊治与预防的效益。精准医疗正在悄无声息地改变着我们对甲状腺癌的深入认知和理解,推动着全程管理理念的进步。
早在1953年,在显微镜的帮助下人们了解了分化型及未分化型甲状腺癌两种亚型,但却解释不清同样是DTC,为什么多数患者在手术、131I及TSH抑制治疗下可达到完全缓解,而有些人却出现复发及转移?随着对甲状腺癌的不断认知,人们了解到病灶的大小、甲状腺外侵犯、淋巴结侵犯、脉管侵犯及治疗干预时机等均影响着DTC患者的预后。2002年,Davies等首次发现包括甲状腺癌在内的人类肿瘤中广泛存在的B型丝氨酸/苏氨酸蛋白激酶(BRAF)突变,随后,邢明照等先后证实,作为丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号传导通路中的主要分子事件,BRAF基因突变导致MAPK通路的过度激活使其与甲状腺乳头状癌的侵袭性、复发、转移及死亡风险密切相关,并在甲状腺癌的失分化机制中起到主导作用。在先前研究基础上,X Yang等观察到伴有BRAF基因突变的甲状腺乳头状癌远处转移灶的摄碘能力明显低于BRAF野生组远处转移灶,从在体角度为BRAF基因突变下调甲状腺相关基因如钠碘转运体(sodium-iodide symporter,NIS)的表达而使131I治疗疗效欠佳提供了核医学分子影像学依据。目前,BRAF、TERT、P53等分子特征正逐渐渗透至DTC患者术后管理的复发风险分层中,而靶向RET变异的药物普拉替尼等在碘难治性甲状腺癌的优异表现令我们期待未来分子特征驱动的DTC术后131I治疗及靶向治疗。
从BRAF这一基因变异事件的相关探索可以看到,分子生物学技术的进步为我们从分子机制深入了解甲状腺癌开启了一扇门。对甲状腺癌的认识已从之前的病理组织学水平逐渐转变为结合了分子病理特征等多层次、多维度的辨识。
这种深入的理解和认知也为RAIR-DTC的治疗带来了希望,新的靶向治疗策略随着分子机制的探索不断推进到临床应用。在1996年的ATA指南中,RAIR-DTC的后续治疗仅为多柔比星的单一化疗推荐。而随着全球多中心Ⅲ期随机对照试验提示RAIR-DTC患者从索拉非尼(mPFS:10.8个月vs.5.8个月,HR=0.59,95% CI 0.45~0.76,P=0.001)及仑伐替尼(mPFS:18.3个月vs.3.6个月,HR=0.21,99% CI 0.14~0.31,P<0.001)治疗中 PFS 的获益甚至生存获益,它们先后被美国食品和药品监督管理局(United States Food and Drug Administration,USFDA)及欧洲药品管理局(European Medicines Agency,EMA)批准用于进展性RAIR-DTC。2018年,ASCO会议报道了BLU667和LOXO 292作为RET基因高度选择性药物在甲状腺癌的探索。2020年5月selpercatinib基于Ⅰ/Ⅱ期临床研究LIBRETTO-001的数据被美国FDA批准用于治疗包括RAIR-DTC及甲状腺髓样癌在内存在RET基因重排、突变或融合的肿瘤,成为全球首个RET激酶抑制剂。此外,采用靶向BRAF及MEK的药物成功诱导RAIR-DTC再摄取碘的初步研究,正为RAIR-DTC的后续治疗探索靶向治疗与131I联合的新型治疗模式。
同时,反映肿瘤糖代谢的18F-FDG PET/CT和反映肿瘤新生血管生成的68Ga-NOTAPRGD2 PET/CT等核医学分子影像学手段有望早期预测药物疗效,并可在治疗后短期(8周)观察到代谢变化,且与CT评估的病灶变化及预后显著相关,在弥补RECIST评估标准的不足的同时,为靶向药物治疗的后续治疗决策提供实时在体的代谢证据。
综上,从上述DTC一线治疗理念的形成、诊断技术的进步、MDT及精准医学四个方面,我们可以看到甲状腺癌全程管理的理念形成不只是技术进步的产物,更是数代甲状腺领域的科学家共同深入探索的历程。像是从荒芜之地探出小径不断前行而愈走愈宽的路,在这条甲状腺癌全程管理的路上,人们正带着对甲状腺癌的探究精神、医者的仁爱前赴后继。
参考文献
[1] AHN H S, KIM H J, WELCH H G. Korea′s thyroid-cancer“epidemic”: screening and overdiagnosis [J]. N Engl J Med, 2014, 371 (19): 1765-1767.
[2] ALMQUIST M, JOHANSEN D, BJÖRGE T, et al. Metabolic factors and risk of thyroid cancer in the metabolic syndrome and cancer project (Me-Can)[J]. Cancer Causes Control, 2011, 22 (5): 743-751.
[3] BAKER S R, BHATTI W A. The thyroid cancer epidemic: is it the dark side of the CT revolution?[J]. Eur J Radiol, 2006, 60 (1): 67-69.
[4] BARREA L, GALLO M, RUGGERI R M, et al. Nutritional status and follicular-derived thyroid cancer: An update [J]. Crit Rev Food Sci Nutr, 2021, 61 (1): 25-59.
[5] BARROWS C E, BELLE J M, FLEISHMAN A, et al. Financial burden of thyroid cancer in the United States: An estimate of economic and psychological hardship among thyroid cancer survivors [J]. Surgery, 2020, 167 (2): 378-384.
[6] BOLTZ M M, HOLLENBEAK C S, SCHAEFER E, et al. Attributable costs of differentiated thyroid cancer in the elderly Medicare population [J]. Surgery, 2013, 154 (6): 1363-1369.
[7] BROSE M S, NUTTING C M, JARZAB B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: A randomised, double-blind, phase 3 trial [J]. Lancet, 2014, 384(9940): 319-328.
[8] CHAM S, ZANOCCO K, STURGEON C, et al. Risk-based ultrasound screening for thyroid cancer in obese patients is cost-effective [J]. Thyroid, 2014, 24 (6): 975-986.
[9] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66 (2):115-132.
[10] DAL MASO L, LISE M, ZAMBON P, et al. Incidence of thyroid cancer in Italy, 1991-2005: time trends and age-period-cohort effects [J]. Ann Oncol, 2011, 22 (4): 957-963.
[11] DAVIES H, BIGNELL G R, COX C, et al. Mutations of the BRAF gene in human cancer [J]. Nature, 2002,417 (6892): 949-954.
[12] ELISEI R, MOLINARO E, AGATE L, et al. Are the clinical and pathological features of differentiated thyroid carcinoma really changed over the last 35 years?: Study on 4187 patients from a single Italian institution to answer this question [J]. J Clin Endocrinol Metab, 2010, 95 (4): 1516-1527.
[13] FERLAY J, COLOMBET M, SOERJOMATARAM I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods [J]. Int J Cancer, 2019, 144 (8): 1941-1953.
[14] FILETTI S, DURANTE C, HARTL D, et al. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2019, 30 (12): 1856-1883.
[15] FURUYA-KANAMORI L, SEDRAKYAN A, ONITILO A A, et al. Differentiated thyroid cancer: millions spent with no tangible gain?[J]. EndocrRelat Cancer, 2018, 25 (1): 51-57.
[16] GUO K, ZHENG X, LI D, et al. Cost-effectiveness analysis in papillary thyroid carcinoma patients with different neck dissection strategy: A retrospective cohort study [J]. Int J Surg, 2018, 50: 1-5.
[17] HO A L, GREWAL R K, LEBOEUF R, et al. Selumetinib-enhanced radioiodine uptake in advanced thyroid cancer [J]. N Engl J Med, 2013, 368 (7): 623-632.
[18] ITO Y, MIYAUCHI A, KIHARA M, et al. Patient age is significantly related to the progression of papillary microcarcinoma of the thyroid under observation [J]. Thyroid, 2014, 24 (1): 27-34.
[19] JANOVSKY C, BITTENCOURT M S, NOVAIS M, et al. Thyroid cancer burden and economic impact on the Brazilian public health system [J]. Arch Endocrinol Metab, 2018, 62 (5): 537-544.
[20] JUNG S K, KIM K, TAE K, et al. The effect of raw vegetable and fruit intake on thyroid cancer risk among women: a case-control study in South Korea [J]. Br J Nutr, 2013, 109 (1): 118-128.
[21] KEEGAN T H, GROGAN R H, PARSONS H M, et al. Sociodemographic disparities in differentiated thyroid cancer survival among adolescents and young adults in California [J]. Thyroid, 2015, 25 (6): 635-648.
[22] KILFOY B, ZHENG T, HOLFORD T, et al. International patterns and trends in thyroid cancer incidence, 1973-2002 [J]. Cancer Causes Control, 2009, 20 (5): 525-531.
[23] KIM H J, PARK H K, BYUN D W, et al. Iodine intake as a risk factor for BRAF mutations in papillary thyroid cancer patients from an iodine-replete area [J]. Eur J Nutr, 2018, 57 (2): 809-815.
[24] KITAHARA C M, MCCULLOUGH M L, FRANCESCHI S, et al. Anthropometric factors and thyroid cancer risk by histological subtype: pooled analysis of 22 prospective studies [J]. Thyroid, 2016, 26 (2):306-318.
[25] KITAHARA C M, SOSA J A. The changing incidence of thyroid cancer [J]. Nat Rev Endocrinol, 2016, 12 (11): 646-653.
[26] LANG B H, WONG C K, CHAN C T. Initial attributable cost and economic burden of clinicallyrelevant differentiated thyroid cancer: A health care service provider perspective [J]. Eur J Surg Oncol, 2015, 41 (6): 758-765.
[27] LANG B H, WONG C K. A cost-effectiveness comparison between early surgery and non-surgical approach for incidental papillary thyroid microcarcinoma [J]. Eur J Endocrinol, 2015, 173 (3): 367-375.
[28] LAURBERG P, BüLOW PEDERSEN I, KNUDSEN N, et al. Environmental iodine intake affects the type of nonmalignant thyroid disease [J]. Thyroid, 2001, 11 (5): 457-469.
[29] LI N, DU X L, REITZEL L R, et al. Impact of enhanced detection on the increase in thyroid cancer incidence in the united states: Review of incidence trends by socioeconomic status within the surveillance, epidemiology, and end results registry, 1980-2008 [J]. Thyroid, 2013, 23 (1): 103-110.
[30] LIM H, DEVESA S S, SOSA J A, et al. Trends in thyroid cancer incidence and mortality in the United States, 1974-2013 [J]. JAMA, 2017, 317 (13): 1338.
[31] LOEHRER A P, MURTHY S S, SONG Z, et al. Association of insurance expansion with surgical management of thyroid cancer [J]. JAMA Surg, 2017, 152 (8): 734-740.
[32] LUBITZ C C, KONG C Y, MCMAHON P M, et al. Annual fi nancial impact of well-differentiated thyroid cancer care in the United States [J]. Cancer, 2014, 120 (9): 1345-1352.
[33] WANG L Y, ROMAN B R, MIGLIACCI J C, et al. Cost-effectiveness analysis of papillary thyroid cancer surveillance [J]. Cancer, 2015, 121 (23): 4132-4140.
[34] MEMON A, ROGERS I, PAUDYAL P, et al. Dental X-rays and the risk of thyroid cancer and meningioma: A systematic review and meta-analysis of current epidemiological evidence [J]. Thyroid, 2019,29 (11): 1572-1593.
[35] MORRIS L G, SIKORA A G, TOSTESON T D, et al. The increasing incidence of thyroid cancer: The influence of access to care [J]. Thyroid, 2013, 23 (7): 885-891.
[36] NASH S H, LANIER A P, SOUTHWORTH M B. Occurrence of endocrine and thyroid cancers among Alaska native people, 1969-2013 [J]. Thyroid, 2018, 28 (4): 481-487.
[37] PAPPA T, ALEVIZAKI M. Obesity and thyroid cancer: A clinical update [J]. Thyroid, 2014, 24 (2): 190-199.
[38] ROCHE A M, FEDEWA S A, SHI L L, et al. Treatment and survival vary by race/ethnicity in patients with anaplastic thyroid cancer [J]. Cancer, 2018, 124 (8): 1780-1790.
[39] ROTHENBERG S M, DANIELS G H, WIRTH L J. Redifferentiation of iodine-refractory BRAF V600E-mutant metastatic papillary thyroid cancer with dabrafenib-response [J]. Clin Cancer Res, 2015, 21 (24): 5640-5641.
[40] SCHLUMBERGER M, TAHARA M, WIRTH L J, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer [J]. N Engl J Med, 2015, 372 (7): 621-630.
[41] SCHMID D, RICCI C, BEHRENS G, et al. Adiposity and risk of thyroid cancer: a systematic review and meta-analysis [J]. Obes Rev, 2015, 16 (12): 1042-1054.
[42] SCIUTO R, ROMANO L, REA S, et al. Natural history and clinical outcome of differentiated thyroid carcinoma: A retrospective analysis of 1503 patients treated at a single institution [J]. Ann Oncol, 2009, 20 (10): 1728-1735.
[43] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020 [J]. CA Cancer J Clin, 2020, 70 (1): 7-30.
[44] TAMMINGA S J, BÜLTMANN U, HUSSON O, et al. Employment and insurance outcomes and factors associated with employment among long-term thyroid cancer survivors: A population-based study from the PROFILES registry [J]. Qual Life Res, 2016, 25 (4): 997-1005.
[45] TANG J, KONG D, CUI Q, et al. Racial disparities of differentiated thyroid carcinoma: Clinical behavior, treatments, and long-term outcomes [J]. World J Surg Oncol, 2018, 16 (1): 45.
[46] THE CLARK T. Sawin history resource center thyroid history timeline [EB/OL]. https://www. thyroid. org/about-american-thyroid-association/clark-t-sawin-history-resource-center/thyroid-history-timeline/; American Thyroid Association. 2015-10-04/2020-07-01.
[47] U. S. FOOD & DRUG ADMINISTRATION. White Paper: Initiative to reduce unnecessary radiation exposure from medical imaging [EB/OL]. https://www. fda. gov/radiation-emitting-products/initiative-reduceunnecessary-radiation-exposure-medical-imaging/white-paper-initiative-reduce-unnecessary-radiationexposure-medical-imaging. 2019-06-14/2020-07-01.
[48] VENKATESH S, PASTERNAK J D, BENINATO T, et al. Cost-effectiveness of active surveillance versus hemithyroidectomy for micropapillary thyroid cancer [J]. Surgery, 2017, 161 (1): 116-126.
[49] WANG C, ZHANG X, YANG X, et al. PET response assessment in apatinib-treated radioactive iodinerefractory thyroid cancer [J]. EndocrRelat Cancer, 2018, 25 (6): 653-663.
[50] WARTOFSKY L. Increasing world incidence of thyroid cancer: Increased detection or higher radiation exposure?[J]. Hormones (Athens), 2010, 9 (2): 103-108.
[51] WU J X, BENI C E, ZANOCCO K A, et al. Cost-effectiveness of long-term every three-year versus annual postoperative surveillance for low-risk papillary thyroid cancer [J]. Thyroid, 2015, 25 (7): 797-803.
[52] XING M, ALZAHRANI A S, CARSON K A, et al. Association between BRAF V600E mutation and recurrence of papillary thyroid cancer [J]. J Clin Oncol, 2015, 33 (1): 42-50.
[53] XING M, LIU R, LIU X, et al. BRAF V600E and TERT promoter mutations cooperatively identify the most aggressive papillary thyroid cancer with highest recurrence [J]. J Clin Oncol, 2014, 32 (25): 2718-2726.
[54] YANG X, LI J, LI X, et al. TERT promoter mutation predicts radioiodine-refractory character in distant metastatic differentiated thyroid cancer [J]. J Nucl Med, 2017, 58 (2): 258-265.
[55] YU G P, LI J C, BRANOVAN D, et al. Thyroid cancer incidence and survival in the national cancer institute surveillance, epidemiology, and end results race/ethnicity groups [J]. Thyroid, 2010, 20 (5): 465-473.
[56] JAY B, TIMOTHY H, PETER T. 健康经济学 [M]. 曹乾, 译. 桂林: 广西师范大学出版社, 2019.
[57] 敖小凤, 高志红. 甲状腺癌流行现状研究进展 [J]. 中国慢性病预防与控制, 2008, 16 (2): 217-219.
[58] 陈芳, 吴凯, 徐明星, 等. 基于病例对照研究的甲状腺癌危险因素的meta分析 [J]. 中华地方病学杂志, 2017, 36 (4): 250-256.
[59] 陈龙, 马利, 何文英, 等. 甲状腺癌病人平均住院日影响因素分析 [J]. 中国卫生统计, 2014, 31 (2):304-306.
[60] 陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析 [J]. 中国肿瘤, 2018, 27 (1):1-14.
[61] 陈文, 刘国祥, 江启成, 等. 卫生经济学 [M]. 4版. 北京: 人民卫生出版社, 2017.
[62] 陈孝平, 汪建平. 外科学 [M]. 8版. 北京: 人民卫生出版社, 2018: 244.
[63] 董芬, 张彪, 单广良. 中国甲状腺癌的流行现状和影响因素 [J]. 中国癌症杂志, 2016, 26 (1): 47-52.
[64] 杜瑞, 梁楠, 孙辉. 儿童及青少年甲状腺癌诊疗进展 [J]. 中国普通外科杂志, 2019, 28 (11): 1431-1436.
[65] 关海霞, 滕卫平, 杨世明, 等. 不同碘摄入量地区甲状腺癌的流行病学研究 [J]. 中华医学杂志,2001, 81 (8): 457-458.
[66] 郝伟静, 张寰, 于洋, 等. 血清降钙素检测对甲状腺髓样癌诊治的临床意义及成本效益分析 [J]. 中华耳鼻咽喉头颈外科杂志, 2019, 54 (7): 506-509.
[67] 赫捷. 2018中国肿瘤登记年报 [M]. 北京: 人民卫生出版社, 2019.
[68] 黄美玲, 李永平, 凌瑞. BRAFV600E基因突变与乳头状甲状腺癌淋巴结转移相关性的meta分析 [J]. 中国肿瘤, 2017, 26 (2): 145-151.
[69] 黄小玲, 张帆, 廖宇航. 公共卫生项目经济学评价方法 [M]. 北京: 人民卫生出版社, 2017.
[70] 雷林, 尚庆刚, 刘维耿, 等. 深圳市2001~2015年甲状腺癌发病现状和趋势分析 [J]. 中国肿瘤, 2019, 28 (7): 504-508.
[71] 梁岭. 甲状腺癌临床特征分布与发病相关因素研究 [D]. 合肥: 安徽医科大学, 2019.
[72] 罗亭亭, 孟迪, 张华, 等. 2010—2017年青岛市居民甲状腺癌发病与死亡分析 [J]. 中华肿瘤防治杂志, 2019, 26 (17): 1231-1236.
[73] 邱贝, 赵波, 王涛, 等. 基于倾向评分匹配分析甲状腺乳头状癌多灶性对不良预后的影响 [J]. 中华医学杂志, 2019, 99 (30): 2332-2336.
[74] 任艳军, 刘庆敏, 葛明华, 等. 2010—2014年浙江省肿瘤登记地区甲状腺癌发病和死亡情况分析 [J]. 中华预防医学杂志, 2019, 53 (10): 1062-1064.
[75] 宋创业, 严丽, 孟艳林, 等. 甲状腺癌发生发展及预后的相关影响因素 [J]. 中华普通外科学文献 (电子版), 2020, 14 (01): 72-75.
[76] 吴菲, 刘霄宇, 赵根明, 等. 癌症筛查成本效果评估的研究进展 [J]. 中国肿瘤, 2016, 25 (2): 81-87.
[77] 吴恋, 于健春, 康维明, 等. 碘营养状况与甲状腺疾病 [J]. 中国医学科学院学报, 2013, 35 (4): 363-368.
[78] 谢岱仪, 王前, 李超, 等. 甲状腺癌患者住院费用影响因素分析 [J]. 中国医疗保险, 2018 (1): 46-50.
[79] 杨雷, 王宁. 甲状腺癌流行病学研究进展 [J]. 中华预防医学杂志, 2014, 48 (8): 744-748.
[80] 张乐升. 碘摄入量与地方病碘防治政策探讨 [J]. 医药前沿, 2014 (4): 119-120.
[81] 张磊, 董云伟, 胡神保, 等. 美国癌症联合委员会甲状腺癌分期系统 (第8版) 修订对甲状腺乳头状癌分期的影响 [J]. 中国癌症杂志, 2018, 28 (7): 491-496.
[82] 郑维晖, 龚巍巍, 陆凤, 等. 甲状腺癌相关基因突变和表观遗传学研究进展 [J]. 中华流行病学杂志, 2017, 38 (11): 1579-1583.
知识来源
人卫知识数字服务体系
作者:林岩松教授,中国医学科学院北京协和医院核医学科
专家简介
林岩松,主任医师,教授,博士研究生导师。中国医学科学院北京协和医院核医学科副主任。
国家卫生健康委员会专业技术职称考试专家委员会专家;国际原子能机构IEAE RAS6074、RAS6083项目中国区协调员。中国临床肿瘤学会(CSCO)核医学专家委员会主任委员;中国医师协会科普分会甲状腺科普专家委员会主任委员;中国医疗保健国际交流促进会甲状腺疾病专业委员会副主任委员;中国研究型医院学会分子诊断专业委员会副主任委员;中国抗癌协会甲状腺癌专业委员会常务委员;北京医学会核医学分会常委,治疗组组长;中华医学会核医学分会及中国医师协会核医学分会治疗学组副组长;2020年《全国医疗服务项目技术规范》核医学专业临床专家工作组专家;《中华核医学与分子影像杂志》常务编委。
从事治疗核医学工作,并致力于分化型甲状腺癌的术后评估、治疗决策、全程管理及碘难治性分化型甲状腺癌的诊断与后续治疗探索。先后多次获得国家自然科学基金及科技部国际合作项目等资助。于2006、2015、2018年三度荣获中华医学科技奖,2018、2020年两度荣获华夏医学科技奖。作为主编完成中国临床肿瘤学会(CSCO)《分化型甲状腺癌术后131I治疗前评估专家共识》《复发转移性分化型甲状腺癌诊治共识》《甲状腺癌患者教育手册》《持续/复发及转移性甲状腺癌诊疗指南》(2018、2019、2021版),及2019版《持续/复发及转移性甲状腺癌诊疗指南》英文版。作为主要执笔人先后完成我国《131I治疗Graves甲亢专家共识2010版》《甲状腺结节和分化型甲状腺癌诊治指南》(2012版)《131I治疗Graves甲亢指南》(2013、2021版)《131I治疗分化型甲状腺癌指南》(2014、2021版)。
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

