张永学教授:PET/CT在肺癌临床分期中的作用
在肺癌患者中,尽管侵入性治疗方法的应用越来越多,但是其存活率仍然比较差。肺癌纵隔和远处转移灶直接关系到肿瘤的正确分期,对于治疗方案决策具有重要意义。在NSCLC患者,如果出现对侧纵隔淋巴结转移(N3期)时,则一般不主张手术治疗。传统的分期主要依靠CT显像,根据纵隔淋巴结肿大的程度来判定,其敏感性约为58%~67%,特异性70%~80%。而且根据淋巴结大小判断有一定局限性,因为小于1cm的淋巴结也有可能是转移,同样大于1cm的淋巴结也不一定就是转移灶。
随着18F-FDG PET/CT在临床上的应用,为NSCLC的正确分期带来希望,根据CT显示的淋巴结大小结合PET功能显像判断淋巴结代谢活性,可以明显改善对转移灶探测和分期的准确性(图1),其敏感性、特异性可达83%~92%和94%~100%。尤其是对于探测胸外远处淋巴结、软组织和骨骼转移具有其他影像无法比拟的优势。18F-FDG PET/CT全身显像可使20%~30%的肺癌患者临床分期得到了修正,约20%以上的肺癌患者其治疗方案因PET/CT检查结果而改变。
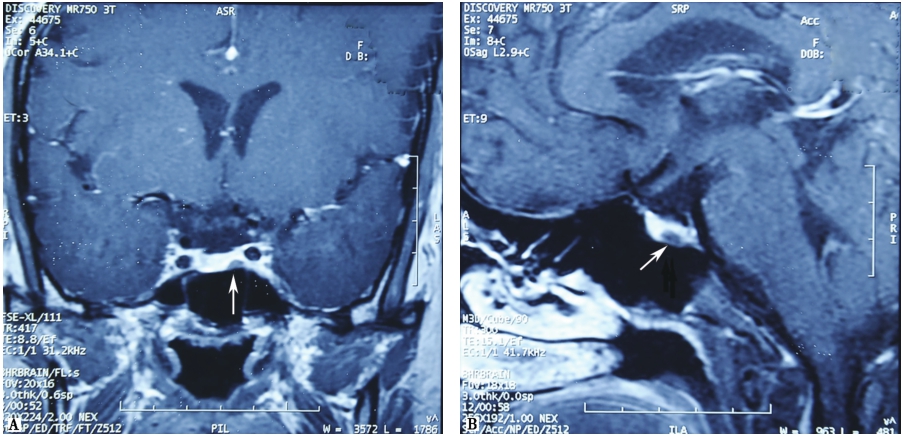
图1 左肺鳞癌伴纵隔、双肺门淋巴结转移
男性,56岁。反复咳嗽、背疼、胸闷。CT示左肺门占位,行纤支镜及活检示左上肺鳞状细胞癌。PET/CT左肺上叶不规则团块,大小约9.0cm×5.5cm,内伴空洞,周边伴毛刺和胸膜牵拉,SUVmax 7.7~15.8。纵隔(3A、2R、4R、7、6区)可见多发肿大淋巴结影,SUVmax 3.3~9.3。提示左肺上叶肺癌伴纵隔、双肺门淋巴结转移
Rodney等应用18F-FDG PET显像研究了153例连续的新近诊断的NSCLC患者,并且比较了根据常规的分期法和结合PET发现的分期法制订的治疗计划,使用Cox相对危险回归法模型分析生存率。结果显示,PET结果使得10%的患者分期下调,33%的患者分期上调,且PET分期的结果在89%的患者最后得到确认。通过PET显像有54例(35%)患者受到了较大影响,包括34例患者的治疗从治愈改变为缓解,6例患者治疗由缓解改变为治愈,14例患者的治疗方式发生改变。39例(25%)过去已选择治疗方案的患者因PET发现而改变。Cox模型提示,PET前的分期与生存率具有明显的相关性(p=0.013),而PET后的分期提供了更有力的预后分层(p=0.000 1),结合PET发现的分期比根据常规方法的分期提供了更准确的预后分层,而PET提供的附加信息使得多数患者的治疗方案得到适当的改变(表1)。
表1 PET检查前后治疗分期的比较
*数据为患者数
1.18F-FDG PET/CT在NSCLC分期与再分期中的价值
肺癌发生早期转移以血行播散和淋巴结转移为主,肺癌的纵隔转移和远处转移的准确判断关系到患者治疗方案的制订和预后的判断。
(1)T分期:
对于NSCLC患者,手术治疗是治愈的最有效手段,肺癌原发病灶及浸润范围直接影响手术范围,而原发病灶侵犯胸膜、纵隔和大血管均可能导致手术失败。18F-FDG PET/CT融合图像能更清楚显示病灶大小及周围组织侵犯情况,鉴别肿瘤残余、复发和瘢痕坏死组织,提高肿瘤对胸壁、纵隔、膈肌、支气管和心血管侵犯探测的可靠性,对术前准确判断T分期、评估手术切除范围及手术难度有很大帮助。伴有胸壁侵犯的非小细胞肺癌在T分期中定义为T3,手术治疗可以完全切除原发灶及相邻被侵犯的胸壁;但对于心肺储备功能较差的患者,如果具有胸壁侵犯,一般不适宜行扩大根治手术。
18F-FDG PET/CT的应用可使部分患者避免不必要的开胸手术,尤其是在原发肿瘤伴阻塞性炎症和肺不张时具有明显优势,这对于精确的放射治疗计划尤为重要。18F-FDG PET/CT的应用可使30%~40%肺癌患者的照射视野得到修正。由于PET/CT可以精确的界定不张肺叶中肿瘤体积的大小,排除未受侵犯的不张肺组织,PET/CT对肺癌T分期的准确性(98%)明显优于单独CT(78%)和单独的PET显像(80%),尤其是对胸壁和纵隔侵犯的准确性非常高。
(2)N分期:
肺癌淋巴结转移关系到治疗方案和预后,18F-FDG PET/CT能早期发现淋巴结代谢增高,对小淋巴结进行精确的解剖定位,在N分期方面的准确性(84%)明显优于CT(64%)。Liu等人对39例有术后活检资料的NSCLC患者回顾性评估了18F-FDG PET/CT在预测纵隔和肺门淋巴结转移的诊断准确性,比较术前PET/CT结果与术中组织病理学发现的一致性。结果表明,208个切除的淋巴结中有57个组织学检查证实为转移,57个淋巴结中有23个是纵隔和肺门淋巴结,提示PET/CT在NSCLC患者术前预测纵隔淋巴结转移的敏感性、特异性、准确性、阳性预测值和阴性预测值分别为65%、96.8%、92%、78.5%和90%。PET/CT显像在NSCLC患者术前诊断纵隔和肺门淋巴结转移是非常准确的方法,可以作为肿瘤诊断、治疗评估和随访的首选方法。
纵隔淋巴结的定性对于NSCLC的临床决策至关重要,转移至同侧纵隔和/或隆嵴下淋巴结(N2)的肺癌患者一般均可选择手术治疗;而转移至对侧纵隔、对侧肺门淋巴结,同侧或对侧斜角肌或锁骨上淋巴结(N3)的患者则提示不宜施行手术治疗。CT、MRI等形态学影像是评估纵隔淋巴结的主要方法,主要是根据淋巴结的大小来评价其性质,但淋巴结的良恶性与其大小缺乏良好相关性,正常大小的淋巴结亦可发生肿瘤转移,而30%~40%的直径超过1cm的淋巴结并无转移。因此CT探测淋巴结转移的敏感性和特异性均较差,有30%~40%的患者可能出现误诊或漏诊。
18F-FDG PET/CT的应用提高了NSCLC淋巴结分期的准确性,Park等分析了18F-FDG PET/CT在临床Ⅰa期NSCLC患者隐匿性淋巴结转移的危险因子。回顾性分析了147例诊断为临床Ⅰa期的NSCLC患者的PET/CT显像,所有患者均接受了以肺癌分期为目的的18F-FDG PET/CT检查以及经颈纵隔镜或淋巴结清扫术。78例患者接受了经颈纵隔镜检查,有3.8%(3/78)的患者发现有N2侵犯;144例患者行开胸淋巴结切开探查,2.8%(4/144)的患者淋巴结清扫术后诊断为N2期疾病;总的N2期侵犯为4.8%(7/147),N1期为9.5%(14/147),而隐匿性淋巴结转移(N1或 N2)占14.3%(21/147)。通过单变量分析发现,较大体积、SUVmax > 7.3的肿瘤都伴有隐匿性淋巴结转移。而多因素分析表明,原发肿瘤SUVmax > 7.3是隐匿性淋巴结转移独立的预后因子(odds ratio:7.574,p=0.001)。提示术前PET/CT扫描有助于减少隐匿性淋巴结转移的频率,在临床Ⅰa期NSCLC患者中,原发肿瘤PET/CT有较高的SUVmax是一个独立的预测因子。
Cerfolio等报道的18F-FDG PET/CT和PET的N分期准确性分别为78%和56%(p=0.008);N1期为90%和80%(p=0.001);N2期为96%和93%(p=0.01);对于N2和N1淋巴结,18F-FDG PET/CT比单独PET有更好的敏感性、特异性和阳性预测值(p < 0.05),PET/CT 准确的淋巴结分期能对治疗和预后产生良好效果。
(3)M分期:
NSCLC早期易发生远处转移,常见的转移器官为肝脏、肾上腺、骨骼和脑(图2)。18F-FDG PET/CT早期发现远处转移并对转移灶进行准确定位,及时制订正确的治疗方案。由于18F-FDG PET/CT显像观察的范围大,一般均为全身显像,不仅能精确定位远处的转移灶,还可将形态学异常与代谢功能的改变结合起来判断,探测远处转移的敏感性、特异性和准确性分别可达94%、97%和96%,可使近20%肺癌患者改变治疗决策。
图2 肺癌伴纵隔淋巴结及左侧肋骨转移(Ⅲb)
华中科技大学同济医学院附属协和医院对43例治疗前、早期治疗后及最终治疗后行PET/CT显像,且有病理诊断结果(腺癌20例、鳞癌18例、小细胞肺癌5例)的肺癌患者研究表明:与治疗前TNM分期相比,43例患者中早期治疗后7例(16.28%)分期上调,13例分期下调(30.23%);而与早期治疗后TNM分期比较,最终治疗后12例(27.91%)患者分期上调,3例患者分期下调(6.97%),提示PET/CT对肺癌治疗后再分期也有重要价值。采用生存曲线和log-rank检验结果表明,以最终治疗后的TNM分期(图3)作为离界点,0-Ⅳ期5组肺癌患者与生存时间之间具有显著性统计学差异(R2=13.659,p < 0.01)。
图3 最终治疗后TNM分期与生存曲线的关系(R2 =13.659,p < 0.01)
2.双时相18F-FDG PET/CT在NSCLC分期中的价值
为了评价双时相18F-FDG PET/CT在患有多种肺部疾病的NSCLC患者纵隔淋巴结分期的有效性,Hu等人对53例有病理证据、同患多种肺病的NSCLC患者和49例无同患病的患者作为对照,注射18F-FDG后1小时行全身PET/CT,2小时后行胸部PET/CT延迟显像,所有患者均接受了系统的淋巴结切除根治性手术,单时相和双时相显像淋巴结探测的结果与组织学发现进行比较。以患者个体为基础,在同患多肺病的患者中,单时相显像的敏感性、特异性、准确性、阳性预测值和阴性预测值分别为87.5%,59.5%,67.9%,48.3%和91.7%,而双时相显像分别为93.8%、67.6%、75.5%、55.6%和96.2%。与此相比,在没有同患病患者中,双时相显像与单时相显像的价值相似,而在有同患病的患者中,以每个结站为基础(on a per-nodal station basis),双时相显像的特异性、准确性和阳性预测值明显优于单时相显像,两者间具有显著性差异(p=0.017,0.002和0.027),但是在没有同患多肺病的患者中没有统计学意义。提示在同患多肺病的患者中,双时相18F-FDG PET/CT显像对纵隔淋巴结的分期比单时相显像更有效,在所有患者中双时相显像对减少纵隔淋巴结转移的假阳性是有用的,但是仅在患有多肺病的患者中能改善其特异性、准确性和阳性预测值。
Kim等研究双时相18F-FDG PET/CT在NSCLC早期(Ⅰ和Ⅱ期)患者的预后价值,对66例接受了肿瘤诊断性的双时相显像并行早期手术切除治疗的NSCLC患者进行了回顾性研究。生存分析采用使用Kaplan-Meier分析,生存曲线按照年龄、性别、纵隔淋巴结侵犯、TNM分期、SUVmaxE、SUVmaxD和%ΔSUVmax分层以估计总的生存期和无病生存期(DFS)。存活的独立预测因子使用Cox比例风险模型(proportional hazard model)确定。结果表明,肿瘤SUVmaxE≤5.75的患者的总生成期和DFS好于SUVmaxE≥5.75的患者,肿瘤SUVmaxD≥6.8的17例(18.2%)患者和33例SUVmaxD≤6.8的患者中有4例随访中复发。肿瘤SUVmaxD≥6.8的患者中位无病生存期为31.7个月,且明显差于SUVmaxD≤6.8的患者。%ΔSUVmax对总生存期和无病生存期无预测价值,SUVmaxE和SUVmaxD是总生存期有效的预测指标,SUVmaxE也是DFS强有力的预测因子。本研究表明,通过双时相18F-FDG PET/CT测定%ΔSUVmax对于早期(Ⅰ、Ⅱ期)手术切除的NSCLC患者的总生存期和DFS可能没有预测价值。
3.肺癌分期中PET/CT与磁共振成像的比较
Ohno等在一组250例患者治疗前的前瞻性研究中比较了短反转时间反转恢复(STIR)、快速自旋回波(SE)、弥散加权磁共振成像(DW-MRI)、18F-FDG PET和CT在NSCLC患者N分期评估的价值,并通过阈值定量和术后病理进行分析。定量分析结果表明,淋巴结与盐水比值(lymph nodeto-saline ratio,LSR)和淋巴结与肌肉比值(lymph node-to-muscle ratio,LMR)的敏感性(82.8%)和准确性(86.8%)明显高于表观弥散系数(apparent diffusion coefficient,ADC)的敏感性(74.2%,p =0.01)、准确性(84.4%,p=0.04),其敏感性也高于SUVmax(74.2%,p=0.01)。定性评估结果显示,STIR自旋回波显像的敏感性(77.4%)明显高于DW-MRI(71.0%,p=0.03)和18F-FDG PET/CT(69.9%,p=0.02)。提示NSCLC患者疾病N分期中,STIR自旋回波MRI定量和定性评估比DWMRI和18F-FDG PET/CT具有更高的敏感性和准确性。
4.11C-胆碱、18F-FLT和18F-FDG对肺癌分期的比较
11C-胆碱、18F-FDG和18F -FLT都是恶性肿瘤诊断常用的PET显像剂,日本学者比较了11C-胆碱和18F-FDG在探测NSCLC患者纵隔淋巴结转移中的作用。29例有病理学证据的NSCLC患者均作了两种显像,在PET显像后,所有患者接受了肺叶节段切除和纵隔淋巴结清扫手术,PET显像结果与术后病理进行比较分析。结果表明,转移灶11C-胆碱的SUV值与肺原发肿瘤相似,仅40%的病灶有差别;而18F-FDG显像则不同,其转移灶的SUV远远低于原发灶,仅19%是相似的。以病理学结果为标准,11C-胆碱和18F-FDG探测纵隔淋巴结转移的敏感性分别为100%和75%,提示11C-胆碱对NSCLC患者纵隔淋巴结转移的检测是非常有效的,不仅可用于术前,也可用于术后评估(表2)。
表2 29例NSCLC患者11C-胆碱和18F-FDG PET对纵隔淋巴结转移检测的比较
对1~9站所有的淋巴结(n=261)进行分析,以淋巴结的SUV > 1.0为阳性
此外,David等研究了18F-FLT对NSCLC患者临床TNM分期的作用,并与FDG进行比较。对16例Ⅰa-Ⅳ期的NSCLC患者和1例高度疑为NSCLC的患者进行了评价,其中8例18F-FLT PET显像前接受了治疗的患者敏感性为80%,而没有接受治疗的9例患者敏感性为27%。与临床TNM分期进行比较,18F-FLT PET在17例患者中8例分期正确,9例治疗后的患者中5例正确,8例未行治疗的患者3例正确。18F-FLT PET中位SUVmax为2.7(范围0.8~4.5),明显低于18F-FDG PET(中位SUVmax为 8.0,范围 3.7~18.8),18F-FLT PET的平均SUV中位数为2.7和范围1.4~3.3也明显低于18F-FDG PET(平均SUV中位数为6.2,范围2.8~13.9)。提示18F-FLT PET对于NSCLC的分期和再分期用途不大。
5.PET/CT对肺癌患者肾上腺肿块的定性诊断价值
临床上肺癌常伴有肾上腺转移,而18F-FDG PET/CT显像在鉴别肾上腺肿块是良性还是恶性转移病灶具有重要作用。Lu等人对87例肺癌患者的110个肾上腺肿块(大小0.5~6.4cm,平均1.9cm)进行了回顾性分析。当肾上腺肿块摄取18F-FDG大于或等于肝脏作为PET显像阳性,低于肝脏则解释为阴性,然后分析其与临床随访或活检结果的相关性。共有77个肾上腺肿块PET/CT为阳性,其中74个最终确定为肾上腺恶性转移病变;其余的3个在随访过程中有2个接受了经皮穿刺,1个接受了手术,最终组织病理学检查证明为肾上腺病灶为腺瘤。而33个PET/CT为阴性的肾上腺肿块中,31个最终证明是良性,有2个病灶在两个月间隔内接受了第2次PET/CT证明为假阴性,其直径大小分别由初次检查时的0.5cm和0.9cm,在随访研究中PET/CT显示直径增加到1.6cm和2.3cm呈阳性结果,2个肾上腺肿块均解释为转移。其探测转移病灶的敏感性、特异性和准确性分别为97%(74/76)、94%(31/34)和95%(105/110)。阳性预测值为 95%(74/77),阴性预测值94%(31/33)。在肺癌患者,当CT或MRI发现有肾上腺肿块的患者,进一步用18F-FDG PET/CT显像鉴别良性与转移病灶是一种准确、无创性技术,且可以早期发现和准确定位肾上腺病灶,因此有助于临床制订治疗计划(图4)。
图4 肺癌伴肾上腺转移
67岁,女性。右肺上叶腺癌切除术后化疗4疗程后复查发现,左肾上腺团块。A、B.PET/CT见左肾上腺明显增粗,放射性异常浓聚,SUVmax 11.9(A);纵隔4R区1.5cm×1.0cm肿大淋巴结,SUVmax 7.9(B);提示右肺癌术后化疗后左肾上腺和纵隔淋巴结转移
6. 18F-FDG PET/CT与预后预测
在进展期可切除的NSCLC患者中18F-FDG PET/CT能提供预后信息。Kim等研究了Ⅲ和Ⅳ晚期NSCLC患者化疗后18F-FDG PET/CT的预测价值,对19例化疗后接受了18F-FDG PET/CT诊断显像的晚期(Ⅲ和Ⅳ期)NSCLC患者进行了回顾性评价。治疗前后存活的肉眼响应和SUVmax变化采用Kaplan-Meier和Cox比例风险模型(Cox proportional hazard)回归分析进行研究,中位随访时间总计24.8个月(范围9.4~59.8个月),存活患者平均存活期41个月(范围34.1~59.8个月),死亡患者平均存活16.6个月(范围9.4~29.4个月)。在基础的18F-FDG PET/CT显像后1年的总存活为73.3%,2年存活47.4%。18F-FDG PET/CT有反应与没有反应相比两组间具有显著性统计学差异(有反应者的中位存活期29.4个月,无反应者仅为14.2个月[Chi(2)=3.91,p=0.048]。同时也发现,使用 %ΔSUVmax为评估指标,两组间总生存期也存在显著性差异[Chi(2)= 12.6,p=0.000 4]。当肿瘤显示 %ΔSUVmax减少大于17.85%时,能够预示存活(AUC,0857;标准误0.086 6;95%置信区间0.622~0.971;敏感性75%;特异性100%;p=0.000 1)。Cox比例风险模型分析示%ΔSUVmax是存活有力的预测因子[Chi(2),12.09;p=0.000 5]。因此,在晚期 NSCLC 患者,18F-FDG PET/CT显像对化疗反应的定性和定量分析是非常好的预后指标,然而在晚期NSCLC患者,最有效的预后预测指标是%ΔSUVmax。
参考文献
[1] LAN X L,ZHANG Y X,WU Z J,et al. The value of dual time point 18F-FDG PET imaging for the differentiation between malignant and benign lesions[J]. Clinical Radiology,2008,63:756-764.
[2] YANG W,ZHANG Y,FU Z,et al. Imaging of proliferation with 18F-FLT PET/CT versus 18F-FDG PET/CT in non-small-cell lung cancer[J]. Eur J Nucl Med Mol Imaging,2010,37(7):1291-1299.
[3] KUMAR A,JINDAL T,DUTTA R,et al. Functional imaging in differentiating bronchial masses:an initial experience with a combination of(18)F-FDG PET-CT scan and(68)Ga DOTA-TOC PET-CT scan[J]. Ann Nucl Med,2009,23(8):745-751.
[4] MORRISON M S,RICKETTS S A,BARNETT J,et al. Use of a novel Arg-Gly-Asp radioligand,18F-AH111585,to determine changes in tumor vascularity after antitumor therapy[J]. J Nucl Med,2009,50(1):116-122.
[5] RODNEY J. HICKS,VICTOR KALFF,MICHAEL P. et al. 18F-FDG PET Provides High-Impact and Powerful Prognostic Stratification in Staging Newly Diagnosed Non-Small Cell Lung Cancer[J]. J Nucl Med,2001,42:1596-1604.
[6] LIU B J,DONG J C,XU C Q,et al. Accuracy of 18F-FDG PET/CT for lymph node staging in non-small-cell lung cancers[J]. Chin Med J(Engl),2009,122(15):1749-1754.
[7] KIM S J,KIM Y K,KIM I J,et al. Limited prognostic value of dual time point F-18 FDG PET/CT in patients with early stage(stage Ⅰ & Ⅱ)non-small cell lung cancer(NSCLC)[J].Radiother Oncol,2011,98(1):105-108.
[8] COBBEN D C,ELSINGA P H,et al. Is 18F-3-Fluoro-3-Deoxy-L-Thymidine Useful for the Staging and Restaging of Non-Small Cell Lung Cancer[J]. J Nucl Med,2004,45:1677-1682.
[9] LU Y,XIE D,HUANG W,GONG H,et al. 18F-FDG PET/CT in the evaluation of adrenal masses in lung cancer patients[J]. Neoplasma,2010,57(2):129-134.
[10] KIM Y S,LEE M K,KIM S J,et al. Prognostic stratification using F-18 FDG PET/CT in patients with advanced stage(stage Ⅲ and Ⅳ)non-small cell lung cancer[J].Neoplasma,2010,57(3):241-246.
[11] LEE D H,KIM S K,LEE H Y,et al. Early prediction of response to first-line therapy using integrated 18F-FDG PET/CT for patients with advanced/metastatic non-small cell lung cancer[J]. J Thorac Oncol,2009,4(7):816-821.
[12] RODNEY J. Hicks. Role of 18F-FDG PET in Assessment of Response in Non-Small Cell Lung Cancer[J]. J Nucl Med,2009,50:31-42.
[13] NAHMIAS C,HANNA W T,WAHL L M,et al. Time course of early response to chemotherapy in non-small cell lung cancer patients with 18F-FDG PET/CT[J]. J Nucl Med,2007,48:744-751.
[14] DOOMS C,VERBEKEN E,STROOBANTS S,et al. Prognostic stratification of stage ⅢAN2 non-small-cell lung cancer after induction chemotherapy:a model based on the combination of morphometric-pathologic response in mediastinal nodes and primary tumor response on serial 18-fluoro-2-deoxy-glucose positron emission tomography[J]. J Clin Oncol,2008,26:1128-1134.
[15] ESCHMANN S M,FRIEDEL G,PAULSEN F,et al. 18F-FDG PET for assessment of therapy response and preoperative re-evaluation after neoadjuvant radio-chemotherapy in stage Ⅲ non-small cell lung cancer[J]. Eur J Nucl Med Mol Imaging,2007,34:463-471.
[16] KEIDAR Z,HAIM N,GURALNIK L,et al. PET/CT Using 18F-FDG in Suspected Lung Cancer Recurrence:Diagnostic Value and Impact on Patient Management[J]. J Nucl Med,2004,45:1640-1646.
知识来源
来源:人卫知识数字服务体系
作者:张永学教授,华中科技大学同济医学院附属协和医院
专家简介
湖北省分子影像重点实验室主任,华中科技大学核医学与分子影像研究所主任,湖北省核医学质控中心主任,协和医院学术委员会副主任委员,华中科技大学临床医学专业学位指导委员会副主任。2001-2005年华中科技大学“特聘教授”,华中科技大学“教学名师”。任中国核学会常务理事、中国核学会核医学分会第八届理事长、中华医学会核医学分会第六届委员会副主任委员、中国医师协会核医学医师分会副会长、中国医学装备协会核医学装备与技术专业委员会副主任委员、湖北省核学会副理事长兼核医学分会理事长、湖北省医学会理事、湖北省医学会核医学分会第三、四、五届委员会主任委员等。担任《中华核医学与分子影像杂志》副总编、《中华医学杂志》中/英文版、《国际放射医学核医学杂志》《中国医学影像技术》《华中科技大学学报》《中国临床医学影像杂志》《临床心血管病杂志》《中德临床肿瘤学杂志》(英文版)等编委。
发表学术论文240余篇,其中SCI收录30余篇;先后主持国家863计划项目1项、国家自然科学基金重点项目1项,面上项目5项,科技部国家重大仪器专项子项目1项,卫生部临床学科重点项目各1项,部省级课题3项。在肿瘤分子影像研究领域第一完成人获湖北省科技进步一等奖、中华医学科技奖二等奖、教育部科技进步二等奖,两次获省科技进步三等奖。1992年批准享受国务院特殊津贴,1998年被教育部授予“全国优秀教师”称号,2001年获得宝钢教育基金优秀教师奖,并被湖北省科协授予“湖北科技精英”称号,2005年被评为湖北省优秀研究生导师,2007年获华中科技大学教学名师奖,2010年华中科技大学教学质量一等奖,2011年获华中科技大学研究生导师师表奖(治学楷模),2014年获中国医师协会“中国医师奖”。现担任教育部面向21世纪课程规划教材《核医学》主编,国家“十一五”规划教材临床医学八年制《核医学》主编,国家卫计委“十二五”规划全国研究生教材《核医学》主编等。培养博、硕士研究生70余名、博士后2名。
从事核医学临床、教学及研究工作40余年,在核医学临床、科研、教学及人才培养方面取得了显著成绩。在核医学影像诊断与治疗方面有深入的研究,尤其是甲状腺疾病的诊断、肿瘤疾病的PET/CT诊断与疗效评估、冠心病核医学影像诊断等有丰富的临床经验,并取得了多项科研成果。特别是甲亢、分化型甲状腺癌的131碘治疗,类风湿关节炎、转移性骨肿瘤、真红细胞增多症等治疗有独到的见解,2006年被武汉市卫生局和市文明办评为“武汉地区人民满意的好医生”,2014年获我国医师行业的最高奖项-中国医师奖。
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

