张志伟教授:大肝癌及巨大肝癌的中国特色治疗模式
一、概述
在我国,肝癌有两大显著特征,一是80%以上合并有不同程度的肝硬化;二是80%的病人就诊时肿瘤已长得很大,病情属中、晚期。传统上,以肿瘤最大径5cm为界线,将肝癌分为大肝癌和小肝癌。但随着外科手术病例的增加和经验的积累,这种分类法远不能满足临床的需要。为此,1994年陈孝平等提出,根据肿瘤大小不同将肝癌分为:微小肝癌,肿瘤最大径≤2.0cm;小肝癌,肿瘤最大径>2.0cm,≤5.0cm;大肝癌,肿瘤最大径>5.0cm,≤10.0cm;巨大肝癌,肿瘤最大径>10.0cm。对于微小肝癌和小肝癌,只要病人的状况允许,治疗方法首选肝切除术。然而,在我国绝大多数肝癌病人就诊时病情已发展到中、晚期,属大肝癌或巨大肝癌,且80%以上合并有肝硬化,手术切除的死亡率及术后并发症发生率相对较高,因此很多医生都不主张为此类病人选择手术治疗。但在临床上,经手术切除治疗的巨大肝癌病例,确有不少获得长期生存。如果轻易放弃手术,则意味着这些病人会失去长期生存的机会。
1994年,我们通过临床研究发现,对于大肝癌和巨大肝癌,病变侧的肝组织由于受癌肿的压迫或直接破坏,实际残存量已很少。而未受癌肿影响侧的肝体积则呈代偿性增大。结果是,肿瘤越小,一并切除的无瘤肝组织量越多;而癌肿越大,一并切除的无瘤肝组织越少(图1)。
也就是说,同样是右半肝切除术,癌肿直径大于10cm和小于5cm者相比,后者的无瘤肝组织切除量按比例计算,一定多于前者。因此,两者所承受的肝实质切除量和肝功能储备破坏程度并不相同。从华中科技大学同济医学院附属同济医院的一组171例巨大肝癌的手术结果来看,全组无术中死亡病例,术后死亡2例,术后1、2、3、5和10年生存率分别为66.1%、42.1%、32.7%、12.2%和2.3%,其中有2例生存时间超过20年。由此可见,巨大肝癌采用肝切除术治疗是安全可行的,可明显提高病人的生存率。
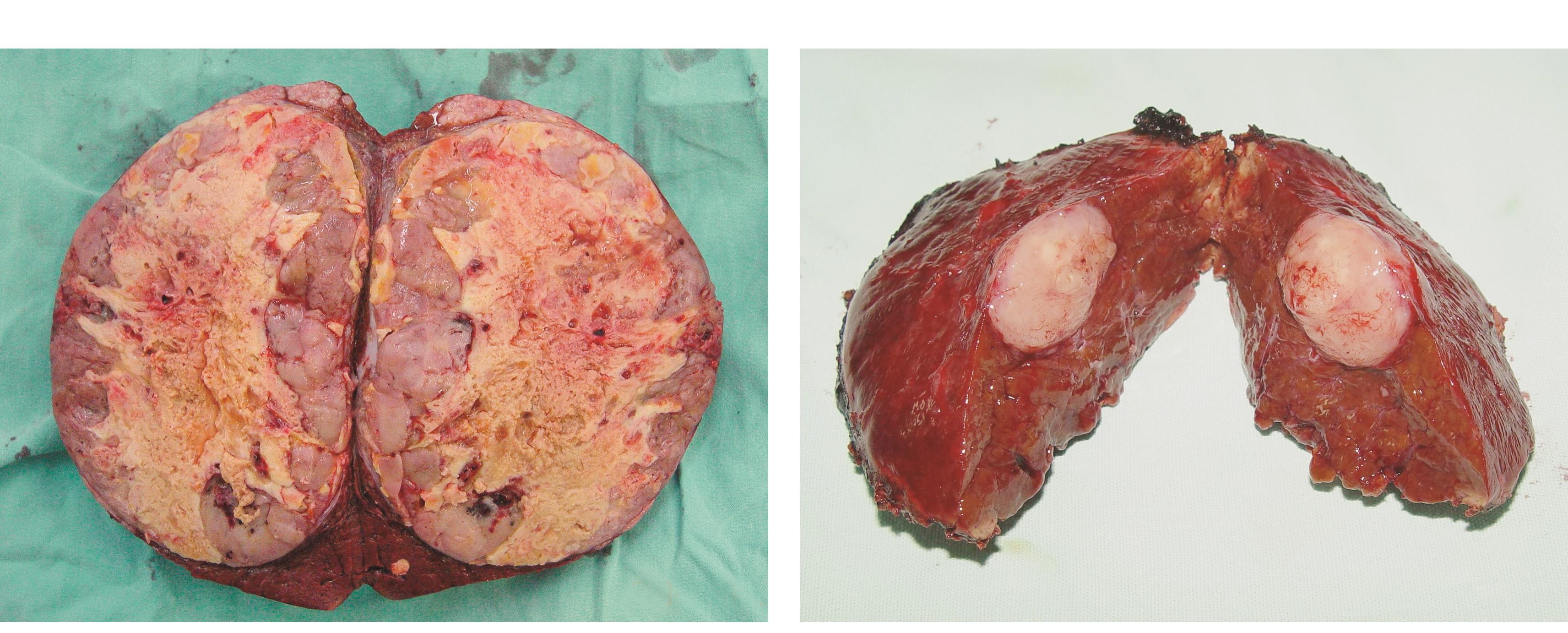
图1 巨大肝癌切除的无瘤肝组织量(左)明显小于小肝癌切除的无瘤肝组织量(右)
二、手术治疗
目前,大肝癌和巨大肝癌外科治疗的主要措施包括手术切除、消融治疗(射频、微波、冷冻)、肝移植等。手术切除应作为首选的治疗方法,但并非所有大肝癌和巨大肝癌都适合采取肝切除治疗。我们体会只有符合以下条件方可考虑手术:①病人一般情况较好,病情评分(PST)为0~1分,无明显心、肺、肾、脑等重要脏器器质性病变。②肝功能正常,或仅有轻度损害。肝功能Child-Pugh A级。③肝储备功能良好,如吲哚菁绿15分钟滞留率(ICGR15)为正常。④无瘤侧肝脏明显代偿性增大,>50%全肝体积。⑤无肝外转移性肿瘤。
大肝癌及巨大肝癌切除手术相对来说较为复杂,熟练掌握大肝癌切除的手术技巧是规避手术风险,提高手术疗效的重要环节,手术时应掌握以下要点:
1.充分显露手术野,应尽可能完全游离肝周韧带。右肋缘下斜形切口辅以框架式自动拉钩,能满足多数大肝癌肝切除手术的要求。如为巨大肝癌时,采用双侧肋缘下“人”字形切口则更有利于手术野的显露。切肝前应尽可能完全游离肝脏,使其能托至切口处,便于直视下操作。但对位于右肝的巨大肿瘤,若强行游离或搬动肝脏,有可能造成近肝静脉的损伤出血或挤压肿瘤造成癌细胞的播散,此时可先不游离右肝诸韧带,而采用前入路法切肝。对于曾行TACE治疗致局部严重粘连的病人,游离肝脏时应加倍小心,以防止损伤膈肌及邻近脏器,一旦损伤应予以修复。
2.合理运用肝血流阻断技术。大肝癌和巨大肝癌行肝切除时,除一些肝硬化严重,肿瘤位于肝左外叶或位于右肝但能顺利将肿瘤托至切口进行操作者,可谨慎地在不阻断入肝血流的情况下行肝切除术外,其他病例多需采用不同方式的肝血流阻断技术。对于肿瘤最大径小于10cm,与第一、二肝门尚有距离,切除难度不大,肝功能良好的大肝癌病人,首选间歇性第一肝门阻断可明显减少肝切除术中出血。而对于肝硬化较严重,或术前估计手术难度大,肝血流阻断时间较长者,为了避免健侧肝脏的损害,可在只阻断病侧入肝血流的情况下行肝切除术。而当肿瘤紧贴甚至侵犯到主肝静脉或下腔静脉,或需要进一步控制肝静脉分支的出血时,则可在全肝血流阻断下行肝切除术。传统的全肝血流阻断实施起来较复杂,特别是肝上下腔静脉游离困难时可导致难以控制的腔静脉出血。因而,自1989年起,我中心创用改良的全肝血流阻断方法,即只阻断入肝血流和肝下下腔静脉实施肝切除,至今已采用该阻断法完成2000余例开放和腔镜下肝切除,临床应用证明该方法操作简单、减少出血的效果明显。
3.熟练掌握肝切除术的技巧。目前,对于大肝癌和巨大肝癌,特别是对伴有肝硬化者,不强求行规则性肝切除,切缘大多不超过1~2cm。对于紧贴第一、第二或第三肝门处的大肝癌,往往只能紧贴肿瘤包膜切除肿瘤。断离肝实质时可利用许多肝实质断离器械,包括超声吸引刀(cut-ultrasound aspiration,CUSA)、百克钳等。在断离肝实质过程中要对断面妥善止血,予以电凝、钛夹或缝扎。如发现残肝重要管道受损要予以精细修补,以确保残肝功能。如肝癌巨大或与膈肌、邻近胃肠管有广泛粘连甚至侵犯,用常规切肝方法分离困难,显露不良,易致难以控制的大出血者,最好行前入路肝切除,华中科技大学同济医学院附属同济医院自1987年即采用这项肝切除技术。即在阻断(或不阻断)入肝血流后,直接从肝膈面沿预切线切开肝实质,直至下腔静脉前面,然后游离、结扎肝静脉和肝短静脉,最后再游离肝脏诸韧带将切除的肝脏取出。这样可减少由于翻转肝脏和挤压瘤体导致的癌细胞播散和近肝静脉损伤的危险。但采用这一技术切肝时,要求手术者对肝脏解剖非常熟悉,手术技术非常熟练。对于有些适合做右半肝、左半肝或左外叶切除的病例,我们采用直接结扎病侧肝入肝和出肝血管的技术切肝,或称不阻断肝门的无血肝切除术。此方法由于仅将病侧肝的血流完全阻断,不仅符合肿瘤学的处理原则,而且对血流动力学影响小;此外,还有方法简便、省时和断肝时出血少等优点。对于大肝癌和巨大肝癌合并有门静脉癌栓的病人,如癌栓位于肝癌所在的肝叶或肝段的门静脉分支范围内,可行包括癌肿及癌栓的肝叶切除。无法完整切除癌栓者,可于切除肿瘤后经断面门静脉支断端取栓。如癌栓位于门静脉主干或主支,可行门静脉切开取栓,同时行肝癌切除。肝癌合并下腔静脉(inferior vena cava,IVC)癌栓时,需要在全肝血流阻断下直接切开IVC取栓。我们报道的171例巨大肝癌病人中49例合并门静脉主干或主支内癌栓,行肝切除加癌栓取出术治疗,术后1、2和3年生存率分别为38.8%、22.4%和4.1%,此效果明显优于其他非手术治疗措施。由于大肝癌和巨大肝癌多毗邻甚至推挤重要的管道结构,因此在行肝切除时,可应用术中超声了解肿瘤与门静脉、肝管、肝静脉以及他们主要分支之间的解剖关系,以防误伤。术中如对胆道解剖有疑问,还可行术中胆道造影,以确定胆道走行、分布,避免损伤。
4.大肝癌和巨大肝癌行肝切除时,往往涉及肝静脉、肝短静脉和下腔静脉,这些静脉一旦损伤,出血量大、难以处理,有时可发生空气栓塞。因此,术者应避免过度牵拉、翻转肝脏,解剖、游离肝短静脉时要耐心细致,予以结扎后再从中剪断。发生损伤后要沉着冷静地处理,小的损伤可立即用指尖按压破口处,吸净外溢的血液,然后用无损伤缝线缝合修补。如靠近第二肝门处肝静脉损伤,修补时可将破口旁的部分肝组织一起缝合以避免再撕裂。如损伤的静脉已裸露一定宽度,则可在破口两侧用手指挤压或用Satinsky钳夹住破口,然后仔细修补。位于肝切除创面深部下腔静脉的小破口,如其两侧尚有肝组织时,直接将两侧肝组织对合缝拢,即可达到止血目的。应用血管闭合器(endovascular stapler)处理肝静脉,尤其是较短的肝右静脉则更为安全。如肝癌累及第二肝门或侵犯肝静脉无法分离时,可用无损伤血管钳钳夹肝静脉或下腔静脉,切除肿瘤后再予修复。
肿瘤切除后,多数情况下可采用水平褥式缝合加间断缝合使肝断面对拢。如整个创面对拢闭合张力过大,也不必强行对拢缝合,但必须确切止血和防止胆漏,可以大网膜、止血纱布和止血胶覆盖创面。
大多数外科医生主张至少要保留1cm的手术切缘。但对于大多数巨大肝癌病人来讲,要保留距肿瘤四周均为1cm的手术切缘几乎是不可能的。对于很多病例,为了保留足够多的肝实质,往往只能紧贴肿瘤包膜外切除。因为在第一、第二或第三肝门处离断肝实质时,如果想保留1cm的手术切缘,就有可能损伤相应部位的主要血管或胆管,导致相应区域的残肝组织缺血、坏死。经验证明,采用紧贴肿瘤包膜外分离,完整切除肿瘤,同样可取得很好的疗效。Yoshida等也认为,1cm的手术切缘并不能防止术后早期肝内复发。原因是,对于有些病例,距主瘤边界1cm以外的部位可能有无法发现的微小病灶存在。在影响手术效果的一些因素中,我们更重视肿瘤的病理及组织学特性、有无卫星结节以及门静脉癌栓等。
大肝癌和巨大肝癌行肝切除时尤其应控制术中出血,减少术中出血和输血量,对提高肝切除治疗巨大肝癌的成功率有一定帮助。对于有肝硬化的病人,大量失血会引起凝血机制的紊乱:失血量大时,为了维持血循环稳定,需要输入大量库血,会进一步加重凝血功能紊乱,最后导致难以控制的广泛渗血,甚至发生严重的失血性休克而死亡。此外,大量输血有导致癌肿扩散及传染病播散的危险。因此,我们特别强调,在为肝癌病人施行肝切除术时,一定要尽量减少术中出血和输血量。巨大肝癌施行肝切除时发生大出血的原因是多方面的:很多病人合并肝硬化门静脉高压,或门静脉主干内有癌栓,肝门区有较多的侧支循环建立。在肝门部解剖分离时,极易损伤这些小的侧支血管而发生大出血。肿瘤巨大,显露困难,按传统方法切肝时,需要游离肝脏。在游离肝脏的过程中,过度牵拉、挤压,会导致肿瘤表面包膜破裂而发生出血;也可能因撕裂肝短静脉、右肾上腺及其血管而发生大出血。
三、非手术治疗
对不能手术切除的大肝癌和巨大肝癌病人,治疗原则一是通过非手术切除的综合治疗后,争取二期手术切除和延长带瘤生存时间;二是进行姑息治疗,减轻病人痛苦和延长生存时间。对于不能耐受手术切除的大肝癌甚或巨大肝癌,只要肝功能尚可,就可选择行TACE治疗,部分病例经治疗后可使肿瘤缩小,健侧肝组织代偿性增生,从而获得二期手术的机会。由于TACE本身存在着一定的局限性,因此,只要大肝癌和巨大肝癌经TACE治疗后达到手术要求,就应该尽早手术。陈曙光等报道,21例不能手术切除的大肝癌经TACE治疗后获二期手术探查,13例手术切除,8例行肝癌冷冻治疗。二期手术切除1、3、5年生存率分别为84.6%、72.7%和63.5%。应该注意的是,对于不可切除的肝癌,TACE可取得肯定疗效。对于可切除的肝癌,TACE的价值应予以重新评价,多数文献认为术前TACE有害无益。术前应用TACE尽管近期复发率比较低,但是5生存率却明显下降,应用TACE的病人5年生存率为24%,而不应用TACE的病人5年生存率为63%。也有研究证实术前TACE是可切除肝癌不良预后的独立危险因素。吴孟超强调,术前TACE对可切除大肝癌或巨大肝癌而言延误了手术时机,增加了手术难度,增加了肿瘤侵犯邻近器官的可能及肝外复发的概率。华中科技大学同济医学院附属同济医院报告68例巨大肝癌只采用TACE者,其1、2和3年生存率分别为30.9%、19.1%和7.4%,无5年和10年生存者,效果明显比肝切除组差(P<0.05)。因此,对于可切除的大肝癌及巨大肝癌,原则上术前不做介入治疗。TACE作为大肝癌及巨大肝癌切除后的辅助治疗是必要的,兼有监测、预防和治疗复发的多重目的,有望进一步提高手术疗效。对于手术无法切除的大肝癌和巨大肝癌,消融(射频、微波、冷冻)治疗可作为综合治疗的一部分,可减轻病人痛苦和延长生存时间。CT或超声引导下经皮穿刺消融治疗侵袭性小,灭瘤效果可靠,有较高的临床应用价值。超声引导下的经皮消融治疗,优点是实时显像,准确度良好。但如肿瘤被肺气、肠气遮挡,或肿瘤靠近肝门及脏面,影响穿刺定位或阻碍穿刺针进入,也可行腹腔镜引导下消融治疗。对于大肝癌或巨大肝癌,无论是TACE还是消融治疗都有其局限性。因肿瘤巨大并常伴有侧支循环和动静脉瘘形成,单行TACE常难以产生较好的治疗效果。单用消融也常因肿瘤巨大,不可避免地遗留未被灭活的肿瘤组织,短期内可迅速复发。而两种治疗方法联合应用能弥补单一治疗的不足,增强治疗效果。2003—2005年华中科技大学同济医学院附属同济医院采用术中冷冻联合肝动脉栓塞治疗合并中、重度肝硬化的巨大肝癌病人共10例,结果无手术死亡病例,6个月生存率为80%。其中,有2例生存超过1年,有1例生存超过2年。上述结果说明联合以上两种方法治疗优于单一的治疗。
随着肝移植技术的不断完善和抗排异药物的更新,采用肝移植治疗肝癌已逐渐成为治疗肝癌的重要方法之一。理论上,肝移植治疗肝癌既能切除癌灶,又可以消除肝癌生长的土壤(肝硬化组织),前景诱人。但实践证明,大肝癌行肝移植复发率高,效果不理想,其指征应从严把握。目前大多数学者认为:当肿瘤很大只有行全肝切除才能将肿瘤切除时亦可考虑行肝移植,可手术切除的大肝癌则不宜行肝移植。
四、术后复发的治疗
近十年来,肝癌的治疗效果有了提高,但长期疗效仍不尽如人意,究其原因主要是术后复发率高。据报道,大肝癌切除术后5年复发率达80%,其中多数是在术后2年内复发。实际上,大肝癌切除术后复发有如下三种情况:①原发肿瘤未能完整地切除或主瘤旁小的卫星灶遗漏,复发灶与原发肿瘤位于同一肝段或相邻肝段;②术前就存在多发性肝内微转移灶,或术中挤压肿瘤使癌细胞在肝内播散,复发灶在肝内呈弥漫性分布;③肝癌为多中心性发生,复发灶与原发肿瘤多不一定在相同肝段或肝叶,复发肿瘤与原发癌在生物学特性上可以相同,也可以不同。目前已认识到复发肝癌治疗后仍可取得较好的效果,因此对复发肝癌不再以姑息的态度对待,而是采取积极的治疗。1997—2003年,华中科技大学同济医学院附属同济医院(1997—2000年为同济医科大学附属同济医院,2001—2003年为华中科技大学同济医学院附属同济医院)共有1143例大肝癌施行了肝切除术,在随访过程中,发现885例复发。复发后的治疗措施包括再次肝切除61例,射频消融和微波治疗358例,TACE治疗519例,无水乙醇瘤内注射治疗189例及肝动脉灌注化疗12例。通过上述治疗,大肝癌术后5年生存率提高到38.7%。大肝癌第一次手术时切除的肝组织较多,因此再手术的术式主要以局部切除为主。单个病灶距肿瘤边缘1cm行局部切除即可。如果残肝体积较大,对局限于一叶的多发灶可行非规则性肝叶切除。值得注意的是,对于复发肝癌较大且邻近第二肝门者,CT或MRI显示的情况可能认为肿瘤不可切除,但如果病人情况良好且无肝硬化或肝硬化程度很轻,就不应轻易放弃再切除的机会。因为首次手术造成的粘连可使肿瘤移位,解剖关系改变,病变在影像学检查中的表现可能被误判。术中将粘连松解后,病变与血管的关系清楚可见,肿瘤仍有切除的可能。随着肝外科不断取得进展,大肝癌切除术后因复发而接受2~3次再手术的病人已不少见。作为复发肝癌的首选治疗,再手术疗效远好于其他的治疗方法。总之,大肝癌切除术后复发应首选再次手术切除,而对<3cm复发肝癌也可考虑行射频、微波等消融疗法,不可切除的复发大肝癌或呈弥漫性发生者则选择行TACE,多结节复发、肝功能差的单结节复发或严重肝硬化者可考虑行肝移植。
肿瘤生物学观点认为,恶性肿瘤是一种全身性疾病,而原发性肿瘤只是全身疾病的局部表现。因此,大肝癌的治疗除局部治疗如手术切除、消融治疗外,还包括全身治疗如系统化疗、靶向治疗,以及基础疾病治疗(抗病毒、抗纤维化)、机体内环境调理(免疫治疗、中医药治疗)、康复治疗等。上述多种措施的综合治疗,相互弥补,协同作用杀伤肿瘤,以提高大肝癌及巨大肝癌的总体疗效。
最后还必须强调,现阶段制定大肝癌治疗方案时,主要是以肿瘤单发或多发、有无肉眼血管癌栓、有无包膜、有无远处转移、病人肝功能分级及肝脏储备功能等为基础,来选择行手术切除、肝移植、消融及TACE等治疗或联合治疗。但严格来说,肝癌个体的生物学特性应是制定大肝癌治疗方案的前提,也是影响大肝癌预后的决定因素。未来大肝癌的治疗应基于肝癌的分子分型,通过直接获取肝癌个体的组织样本,进行分子、细胞水平检测,如循环中肿瘤细胞的检测、化疗敏感实验及明确靶向治疗所需的活化靶点等,为临床决策提供依据或参考。
参考文献
[1]陈孝平,张志伟.大肝癌和巨大肝癌外科治疗策略[J].中华普外科手术学杂志(电子版),2009,3(4):702-706.
[2]CHEN X P,QIU F Z,WU Z D,et al.Longterm outcome of resection of large hepatocellular carcinoma[J].Br J Surg,2006,93(5):600-606.
[3]CHEN X,WU Z,QIU F.Hepatectomy for huge primary liver cancer:report of 171 patients[J].Zhonghua Wai Ke Za Zhi,2000,38(1):6-9.
[4]王义,陈汉,吴孟超,等.中央型巨大肝癌的手术切除及疗效观察[J].中华外科杂志,2004,42(17):1025-1028.
[5]张志伟,陈孝平.大肝癌肝切除的技术要点[J].肝胆外科杂志,2008,16(1):6-7.
[6]陈孝平,何松青.巨大肝癌手术切除的沿革与改变[J].岭南现代临床外科,2003,3(1):1-2.
[7]陈曙光,芮静安,赵海涛,等.原发性大肝癌583例综合治疗体会[J].中国综合临床,2006,22(3):224-226.
[8]陈孝平,张志伟.大肝癌切除术后复发的外科治疗[J].肝胆外科杂志,2009,17(1):3-4.
[9]陈孝平.关于开展肝切除治疗巨大肝癌的几点意见[J].临床外科杂志,2001,9(1):1-2.
[10]吴俣,张志伟,高丹,等.大肝癌伴门静脉癌栓病人综合疗法选择对照研究[J].中国实用外科杂志,2014,34(8):757-761.
[11]CHEN X P,QIU F Z,WU Z D,et al.Effects of location and extension of portal vein tumor thrombus on longterm outcomes of surgical treatment for hepatocellular carcinoma[J].Ann Surg Oncol,2006,13(7):940-946.
[12]张贯启,张志伟,项帅,等.大肝癌手术切除术中不同肝血流阻断方法的临床研究[J].中国普通外科杂志,2015,24(1):18-22.
[13]陈孝平,裘法祖,吴在德.肝切除治疗巨大肝癌65例报道[J].中华普通外科杂志,1998,13(6):332-334.
[14]陈孝平.肝切除治疗巨大肝癌体会[J].肝胆外科杂志,1994,2(4):193-194.
[15]程树群,吴孟超.肝癌门静脉癌栓临床研究进展和展望[J].中国微创外科杂志,2007,7(1):6-7.
知识来源
来源:人卫知识数字服务体系
作者:张志伟教授,华中科技大学同济医学院附属同济医院
专家简介
张志伟
担任职务:外科学系副主任、肝胆胰外科研究所副所长、肝脏外科中心副主任
所在科室:肝脏外科
研究方向:肝脏外科
导师类别:博士生导师
一级学科:临床医学
二级学科:外科学
擅长:肝脏良恶性肿瘤,肝炎肝硬化门脉高压症的诊治
1986年毕业于同济医学院,1994年获博士学位,从医24年,目前主要从事肝脏肿瘤及其微创治疗方面的临床和研究。1999年受香港大学之邀在Queen Mary医院进行了为期二年的研修,并获香港执业医师执照。参加了无数例疑难重症的诊断治疗及抢救,积累了丰富的临床经验。掌握了包括甲状腺、乳腺、胃肠、肝、胆、胰、脾等器官在内的各种普外科疾病的处理。特别是近十五年以来,在著名外科学家裘法祖院士、吴在德教授及陈孝平教授的指导下,对肝脏外科疾病的诊治进行了深入研究和广泛的实践,参加了各种高难度、复杂的肝脏外科手术二千余例,在肝癌、肝血管瘤、肝囊肿、胆道系统疾病及门脉高压症的诊治方面经验丰富。在香港大学期间,还参加了亚洲首例受体均为成人的劈离式肝移植手术,参加了成人间活体右半肝移植手术50例,积累了活体肝移植经验。
作为主要参加者的科研成果“肝外科五个观念的更新和技术改进”及“有关肝外科手术的系列研究和技术改进”“B超引导下肝癌射频消融治疗”“肝癌门静脉切开取癌栓”等荣获国家科技进步奖二等奖、中华医学科技奖一等奖等。担任了包括《中华外科杂志》在内的十余种专业期刊杂志的编委、常务编委及审稿专家,作为副主编编著了160万字的《肝胆外科学》。近年来出访美国、日本、意大利、新加坡、俄罗斯等国进行学术交流。
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

