失误病例4则:小心冠心病介入治疗的陷阱!
近二十年来冠心病介入治疗(PCI)取得了长足的进展。器械的不断更新和完善,大大提高了介入治疗的成功率,并发症发生率明显降低。迄今此项技术已成为冠心病治疗中非常重要和有效的治疗手段,但是对某些复杂病变如何处理的问题仍存在争议并值得讨论。本文取4则介入治疗的并发症及失误病例进行分析,使大家明确行PCI的注意事项以及错误引发的严重后果有哪些。
病例1
患者,男性,74岁,以“胸痛9小时”入院。胸痛于活动时出现,呈压榨样,含服硝酸甘油不缓解,症状反复发作。1996年曾发生心肌梗死,此后一直给予药物保守治疗。无“高血压、糖尿病”等病史。
入院诊治及病情变化过程:
入院查体:血压140/80mmHg心率78次/分。实验室检查:心肌酶入院后10小时达最高峰:CK 2171U/L,CK-MB 213U/L,LDH 460U/L;肌钙蛋白>2ng/ml。入院当天再次出现胸痛,持续20分钟,生命体征平稳,心电图演变见图1A,图1B。心脏彩超示:室间隔心尖段心肌回声偏强,EF:54%。诊断:冠心病急性广泛前壁心肌梗死KillipⅠ级。给予冠心病药物强化治疗,此后患者症状缓解,药物治疗10天后行PCI治疗。CAG结果:LAD近中段85%~90%弥漫性狭窄;LCX近中段80%~85%节段性狭窄;RCA细小,近中断90%节段性狭窄。手术过程:先于前降支中段置入1枚乐普2.5mm×36mm支架,释放完毕后患者开始出现胸痛,心电图提示胸前导联ST抬高,造影示近段狭窄加重,给硝酸甘油后缓解,于近段置入1枚乐普3.0mm×24mm支架,患者胸痛再次发作,且明显加重,伴血压下降,造影示前降支近段至开口狭窄加重,血流缓慢,TIMI 2级,于开口处置入1枚乐普3.5mm×24mm支架,但患者胸痛无明显缓解;造影回旋支中段第一钝缘支开口处狭窄加重,考虑痉挛,给予硝普钠等冠脉内静推,同时给多巴胺升压,替罗非班5ml冠脉内静推,疼痛有所缓解,遂于回旋支中段置入1枚乐普4.0mm×29mm支架,造影显示慢血流,患者仍有胸痛,但有所减轻,观察15分钟后血压心率均恢复正常,结束手术。返回病房途中患者突然出现呼吸心跳骤停,立即心肺复苏,心电图如图1C,抢救1小时无效死亡。造影及支架置入过程见图2。
讨论:
1.该患者多支病变是行CABG还是PCI?
多支血管病变在选择治疗措施时,必须对患者的病情进行全面的评估,根据评估的结果来选择合适的治疗策略。迄今为止,多支血管病变应该选择PCI还是CABG尚无定论。近些年来,介入技术及介入器械都有了突飞猛进的发展。从目前的研究显示,介入治疗对多支血管病变的疗效与CABG相当。国际上有多个评分标准包括SYNTAX评分标准、EuroSCORE评分标准等。若EuroSCORE评分大于6分,则外科手术死亡率较高,对这部分患者可能采用PCI治疗效果会更好。但对PCI的长期疗效,比较担心的是药物洗脱支架迟发延期血栓的问题。但至少到目前为止,无论是PCI还是CABG,对多支血管病变一定要采用某一项治疗措施的结论还为时过早。对多支冠脉病变患者,要充分评估患者的基本病情、冠脉的解剖情况等,据此选择治疗方式可能更为合理。
2.多支血管病变在完全血运重建时应遵循的原则是什么?
(1)对急性冠状动脉综合征(ACS)者首先处理“罪犯病变”,包括AMI时的梗死相关动脉靶病变及引起不稳定型心绞痛症状的高度狭窄靶病变等,其他病变依据患者症状和左心室功能延期处理,通常在术后1~6个月再次行PCI干预其他严重狭窄病变。若无闭塞病变血管,应首先处理导致显著心肌缺血的“罪犯”血管。如造影不能确定“罪犯”血管时,可通过血管内超声(IVUS)、FFR寻找“真正”罪犯病变进行干预,然后根据结果及临床情况决定下一步的介入治疗,如无法行FFR,则可首先处理最狭窄血管。
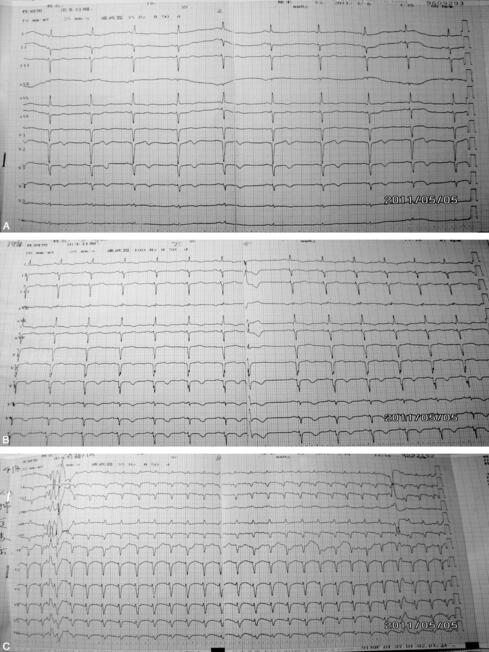
图1 A.入院时心电图,V1~V3导联呈QS型、Ⅱ、Ⅲ、avF导联rS型,T波直立;B.患者入院期间心绞痛再次发作时,V3~V6导联T波倒置加深,Ⅱ、Ⅲ、avF导联QS型、T波倒置;C.心肺复苏期间出现加速性室性心动过速
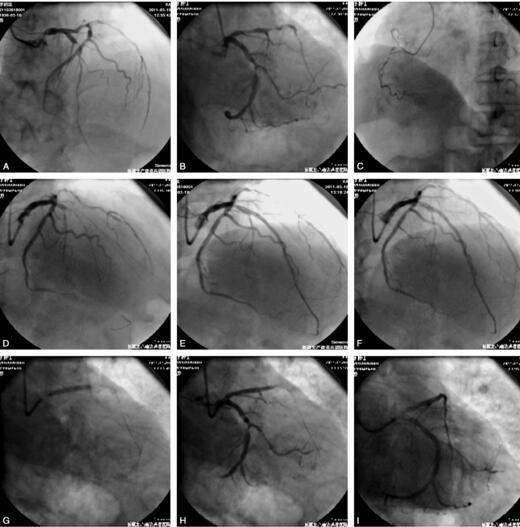
图2 A~C.LAD近段85%以上节段性狭窄,LCX中段75%狭窄,右冠细小并近中段95%狭窄;D~I.前降支及回旋支支架置入过程
(2)主要“罪犯”血管处理结果满意后,可继续处理其他病变,若结果不满意(PCI后即刻血栓形成、术后TIMI血流<3级、手术时间>3小时或造影剂总量>400ml)则中止操作。1~2周后冠状动脉造影复查,并决定行再次介入治疗或外科手术。
(3)对稳定型心绞痛的多支病变,首先处理供血最大面积心肌、功能意义最大且狭窄最严重或有侧支循环形成的慢性完全闭塞病变血管。如2个病变PCI的难度相近,应首先扩张供血范围较大的病变,其后扩张干预供血中等至大面积心肌的病变血管。
(4)同一支血管多处病变,应先处理远端病变,除非球囊或支架不能通过近端病变,以防止近端病变置入支架后,远端病变支架置入困难。但当导管等器械可能阻塞近端病变处血流或无法通过近端病变时,可首先扩张近端病变。
(5)对下述情况采取分期PCI:一次完成多支血管病变PCI危险性较大(如AMI)可先处理“罪犯病变”,其他血管病变留到后期处理;计划一次完成PCI,但第一支血管病变手术时间较长>3小时、造影剂用量较多>400ml或患者不能耐受时,余下的病变可在后期处理;严重心、肾功能不全、病变血管供血范围大的高危患者,宜分期行PCI。
(6)血运重建方式选择上,主要根据冠脉病变解剖特征进行决策,SYNTAX评分对于多支血管或左主干病变患者血运重建方式的选择有指导意义。SYNTAX评分较低的三分位组(0~22)的数据显示通过PCI和CABG实现再血管化有相近的预后。
SYNTAX实验的结果表明55%的患者仍然最好应选择CABG,然而,对于余下的患者采用PCI也是非常好的。SYNTAX评分>22的三支病变患者,在术后1~2年的观察期内,CABG术的疗效更优。SYNTAX评分≥33的患者适合CABG,如果行PCI治疗,那么可能增加不良事件的发生。
本例患者二次心梗,造影示三支病变,且右冠细小,左旋支作为重要的供血血管,属于冠心病高危患者,因此积极的介入治疗对于改善患者的症状、预后及提高患者生活质量,有积极的作用。根据心电图的动态演变及造影结果,考虑此次梗死相关血管为前降支,故先处理前降支病变原则没有错误,但当患者于前降支支架置入后即开始胸痛发作,造影提示慢血流、回旋支病变加重,此时应该停止干预回旋支病变,主要供血血管一旦发生意外,其后果将是灾难性的。因此加强抗凝、抗血小板聚集,并给提升血压、心率等药物治疗,1~2周后冠状动脉造影复查,再根据其结果决定是否行回旋支支架介入治疗,较为合适。
最终诊断:冠心病,急性前壁心肌梗死,KillipⅠ级,冠脉内支架置入术后,心源性猝死。
启示:本例患者同时干预2支供血范围较大的病变,属于决策失误,无疑增加了手术的风险,从而导致患者死亡。
病例2
患者,男性,58岁,以“间断胸痛12年,加重1日。”,患者于12年前开始间断出现劳累后胸痛,每次持续几分钟,呈压迫样,休息后可缓解,此次于入院前1天劳累后再次胸痛,且伴大汗淋漓,持续不缓解,遂于当地医院诊断:冠心病,急性心肌梗死。立即给予阿司匹林、氯吡格雷及低分子肝素等强化治疗,但仍有疼痛发作,转入院。既往否认高血压、糖尿病病史。
入院诊治及病情变化过程:
查体:血压112/70mmHg心率82次/分,律不齐,可及期前收缩,大于8次/分,各瓣膜未闻及杂音。双下肢无水肿。实验室检查:CK 6241U/L、CK-MB51U/L;肌钙蛋白1730pg/ml。纤维蛋白原4.6g/L高密度脂蛋白0.77mmol/L,低密度脂蛋白3.37mmol/L。入院心电图显示:Ⅰ、avL、V1~V4导联ST段压低≥0.5mV T波倒置。诊断:冠心病,急性非ST段抬高心肌梗死KillpⅠ级。因患者转入后给予冠心病药物强化治疗,症状缓解,生命体征平稳,故药物治疗10天后行冠脉造影检查。CAG结果:左冠造影,左主干未见明显狭窄,LAD近段95%节段性狭窄;LCX近段分叉处90%狭窄,远端闭塞,第一钝缘支近段80%狭窄,前向血流2级;以6FJR4.0造影导管行右冠造影:右冠开口90%狭窄,在行右冠造影过程中,患者突然出现胸痛,心电监测示下壁ST段抬高,血压、心率进行性下降,造影显示近中段夹层,血流消失;立即给予多巴胺、阿托品等药物,并置入IABP,同时立即开通闭塞前降支以改善心肌供血,以EBU3.5指引导管至左冠口,用MV1.5mm×15mm球囊过闭塞处予以扩张,前向血流TIMI1级,此时患者突然出现阿-斯发作。心电监测:室颤。意识丧失,立即给予电除颤,多巴胺升压,并再次给冠脉内推注替罗非班、腺苷等药物积极抢救,造影前降支血流TIMI1级,同时气管插管,给升压、扩冠、纠正酸中毒等药物治疗,并持续心外按压等抢救,终因抢救无效死亡。造影见图3。
讨论:
1.冠脉造影致冠脉夹层形成的原因有哪些?
病变因素:钙化,偏心,成角,长病变,血管迂曲及复杂病变(ACC/AHA病变B型或C型);疾病因素:急性心肌梗死或不稳定型心绞痛;器械因素:球囊或支架过大(球囊/动脉直径>1.2)、Amplazt导管,硬导丝等;操作因素:深置指引导管(deep seating)等;一般来说,冠脉造影引起的夹层及其他并发症发生率很低,但由于常影响冠脉开口或主干,一旦夹层扩大引起急性冠脉闭塞易造成大面积的心肌缺血而引起严重后果。造影导管引起夹层分离多见于本已存在粥样硬化病变的部位,造影导管不同轴,开口指向病变内,则注射造影剂或心脏跳动时导管的作用力均可造成局部内膜层的损伤而引起夹层分离的形成。由于右冠解剖特点及右冠中层平滑肌与左冠不同,造影夹层多见于右冠。本例患者右冠开口较低,近段向上走行,而造影管与开口不同轴,而指向右上方,且张力大,导管顶部指向的部位管壁不规则,在心脏跳动时造影管作用于病变部位是引起夹层的重要原因。

图3 A、B.LAD近段95%节段性狭窄,第一对角支开口90%狭窄,LCX近段分叉处90%以上狭窄、远端闭塞;C~E.右冠造影致右冠近中段夹层,血流消失;F.导丝过前降支并以球囊扩张
2.操作时需注意的事项有哪些?
该患者为经桡动脉行冠脉造影,常采用多功能造影导管,操作简便、快速、可减少X线照射时间、并发症少,但行右冠造影时,由于导管尖端指向右上方且位置偏高易造成导管与右冠开口不同轴而增加损伤可能性,且导管容易超选入右冠口近段的圆锥支及其分支内,推注造影剂引发室颤。因此术者需熟悉冠脉的解剖特点,轻柔操作导管,避免粗暴,注意避免导管插入过深,损伤内膜。在正式造影前宜先注射少量造影剂以了解导管是否进入冠脉内、导管的同轴性、是否深插等,避免导管尖端直接损伤冠脉开口。另外可了解冠脉内血流情况,若血流缓慢或无前向血流,应后撤导管直至造影剂迅速消失时较为安全,若经后撤导管调整后仍不能改善,宜更换导管型号或类型。还要连续监测压力,若出现压力下降或压力嵌顿提示插入过深,需调整造影导管位置。
启示:冠脉造影操作虽然看似简单,但其对操作者的要求很高,不仅要熟悉冠脉的解剖,同时在操作过程中应轻柔、避免粗暴,科学选择适合的器械,从而才能更大限度的降低手术的并发症及严重的不良事件。
病例3
患者,男性,78岁,以“胸闷1日”入院。患者于入院前一天出现胸闷、胸痛,呈压榨样,伴大汗淋漓,腹泻3次,在家休息后不缓解于次日上午来就诊。既往:2006年曾因急性脑梗致右侧肢体功能障碍,此后一直给予药物保守治疗。否认“高血压”病史,有“糖尿病”病史4年,给予胰岛素治疗,血糖控制可。
入院诊治及病情变化过程:
入院查体:血压112/57mmHg心率120次/分,律齐,心音低钝,各瓣膜未闻及杂音。双下肢无水肿。实验室检查:CK 6681U/L、CK-MB 76U/L;肌钙蛋白>4.885ng/ml。血常规示:中性粒细胞百分比77%。入院心电图显示:V1~V4导联ST段呈弓背样抬高,诊断:冠心病,急性前壁心肌梗死,KillpⅠ级。给予冠心病药物强化治疗,效果欠佳,患者胸痛仍反复发作,故急诊行冠脉造影检查。CAG结果:左冠优势型,左主干未见异常,LAD近段闭塞;LCX及RCA未见狭窄。根据造影结果决定开通前降支,以6FJL4.0指引导管置左冠口,送PLIOT 50导丝至前降支远端,送入抽吸导管反复抽吸6次,有大量碎小血栓,故予冠脉内推注替罗非班3ml,再分别以1.5mm×20mm及2.5mm×20mm球囊予以扩张,前向血流TIMI 2级,故先于前降支近段狭窄处置入resolute 3.5mm×30mm支架1枚,压力为10~12atm,造影提示TIMI 1级,支架远端可见夹层,同时患者血压下降至80/50mmHg,立即给予多巴胺升压,并行IABP置入,进行主动脉内球囊反搏,并再次给冠脉内推注替罗非班、腺苷等药物,血流较前改善,故再顺导丝于支架远端置入1枚resolute3.0mm×18mm支架并与前一枚支架连接,压力为10~12atm,此时患者再次出现血压下降,心电监测示加速性室性自主心律。后突然意识丧失,潮式呼吸,心电监测示室颤,立即给予电除颤,并予利多卡因抗心律失常,同时气管插管、升压、扩冠、纠正酸中毒等药物治疗,并持续心外按压等抢救,约1个半小时左右患者心律恢复为窦性,意识恢复,抢救成功,送入ICU进一步观察治疗。病情渐趋平稳,1周后出院。手术经过见图4。
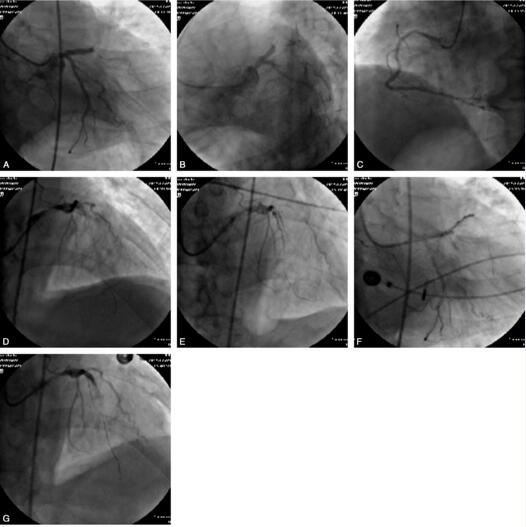
图4 A~C.前降支近段闭塞、第一钝缘支中段70%狭窄;D~G.前降支近段、中段支架置入及支架术后慢血流的发生过程
讨论:
1.患者行PCI治疗的时机是否得当?
患者心肌梗死发病时间从病史中可得知已大于24小时,但入院时患者仍有胸痛症状且血压较低,表现为心源性休克状态,心电图提示:V1~V4导联ST段呈弓背样抬高。诊断明确:急性前间壁心肌梗死。根据2007年急性心肌梗死诊疗指南指出:STEMI 24小时以上对有血流动力学意义狭窄的梗死相关动脉可行PCI(Ⅱb,B);STEMI 24小时以上,如血流动力学/心电稳定,没有严重缺血证据,无症状的单支或双支病变患者,不建议对完全闭塞的梗死动脉进行PCI(Ⅲ,B),因此选择给予急诊PCI手术治疗是合适的。
2.对于该患者造影结束后,是该强化药物抗凝还是支架置入更好?
对于该患者造影明确罪犯血管为前降支近段闭塞,且管腔内可见大量血栓,因此术者选择先使用抽吸导管反复抽吸,并给冠脉内推注替罗非班加强抗凝,但效果欠佳,血流无明显改善,远端血管显影差,此时术者选择于闭塞处置入resolute 3.5mm×30mm支架1枚,压力为10~12atm,造影提示TIMI 1级,同时支架远端血管可见夹层,患者血压及心跳均进行性下降,故于支架远端置入一枚resolute3.0mm×18mm支架,压力为10~12atm,但造影仍提示慢血流,前向血流1级。对手术病例分析,首先要对病变的特点进行分析:一是血栓负荷重,且术前未能充分抗凝,在多次抽吸后,血流仍未充分改善的患者,于病变部位置入支架,发生慢血流及支架内急性、亚急性血栓的风险较高;同时对于钙化、偏心、成角、长病变、血管迂曲及复杂病变(ACC/AHA病变B型或C型)在球囊及支架扩张时有较高发生冠脉夹层的风险,因此需要术者对病变特点准确判断;而夹层的发生除有上面病变部位的因素外,还包括疾病因素:急性心肌梗死或不稳定型心绞痛;器械因素:球囊或支架过大(球囊/动脉直径>1.2),尤其对老年人往往病变部位都有不同程度的钙化,因此无论是球囊和支架过大,还是扩张及释放压过高,都增加了病变远端夹层的可能性,其他如Amplazt导管、硬导丝等也是出现夹层的重要原因;操作因素:如深置指引导管(deep seating)等;然而一旦出现夹层及慢血流患者即刻表现为心绞痛加重,明显的ST-T改变,并有低血压及严重的心律失常等。而一旦出现首选治疗为:在确保导丝在真腔内,于夹层处置入支架。
诊疗建议:①术前在排除出血风险后给予负荷量的抗凝及抗血小板治疗;②进行客观准确的危险因素评估;③选择合适的手术器械;④减少造影剂的使用量;⑤给予IABP辅助治疗维持血压保证冠脉有效灌注。
病例4
患者,女性,82岁,以“间断胸闷、胸痛3个月余,加重2天”入院。患者于入院前3个月开始出现胸闷、胸痛,呈压迫感,夜间多发,曾住院药物保守治疗,病情好转。入院2天前感胸痛加重,行冠脉CT检查示:前降支近段第一对角支开口处90%狭窄,对角支开口90%狭窄,LCX及RCA无狭窄。既往:有“高血压、2型糖尿病”病史10余年,给予降压药物及胰岛素治疗,血压及血糖控制均不理想。入院查体:血压150/90mmHg心率72次/分,律齐,各瓣膜无杂音。实验室检查未见异常。入院心电图显示:V1~V4导联T波低平。诊断:冠心病,不稳定型心绞痛。给予冠心病药物强化治疗,病情稳定1周后行冠脉造影检查。CAG结果:左主干直径约1cm,LAD近段95%以上狭窄,第一对角支开口次全闭;LCX远端可见50%局限性狭窄,RCA未见狭窄。根据造影结果:以EBU3.5指引导管置左冠口,送BMW导丝至前降支远端,另一BMW导丝于第一对角支予以保护,以APEX1.5mm×15mm及微创2.0mm×15mm球囊于前降支狭窄处扩张,压力为8atm×8s,然后置入EXCEL 2.5mm×18mm支架于前降支近段狭窄压力最大为18atm,造影提示TIMI 3级,第一对角支开口闭塞;预交换导丝,回撤对角支导丝时,患者突然出现胸痛,同时血压下降至80/40mmHg,心电监测示:心率40次/分,回放造影提示指引导管深插入前降支导致前降支支架近段、左主干远端及回旋之开口夹层,同时出现大量血栓,回旋支近段也可见大量血栓形成,血流缓慢,立即送BMW导丝至回旋支远端,给予多巴胺2ml、阿托品1mg、吗啡2mg静推,5分钟后再次造影血栓负荷仍较重,给冠脉内推注尿激酶10μg;10分钟后再次于冠脉内推注替罗非班5ml、加大多巴胺用量,并送美敦力2.5mm×20mm球囊于前降支支架近段以12atm压力扩张,分别于回旋支、前降支置入支架,行Crush术,此后胸痛缓解,生命体征平稳,观察5分钟后撤出导丝及指引导管,送入ICU进一步观察治疗。此后复查心脏B超未见异常,恢复良好出院。手术经过见图5。

图5 A~C.前降支近段及第一对角支开口均95%以上狭窄;D.前降支置入支架后;E~J.大量血栓形成、LAD及LCX近段支架置入过程
讨论:
1.患者为前降支、对角支分叉病变,但对角支较小,故在治疗策略上只要保证对角支不闭塞,血流好就可以。故一般选择对角支单纯球囊扩张,前降支置入支架的单支架技术。
2.本例PCI,在回撤导丝时,指引导管超选至前降支致使支架近段冠脉夹层,同时继发左主干远端及回旋之开口痉挛,大量血栓形成,属于因操作失误导致冠脉夹层的典型病例。因此PCI过程中,要高度警惕指引导管深插入冠脉内,以免造成严重后果。
来源:《心脏病学实践.2012.规范化治疗》
作者:胡大一 马长生
参编:方圻 刘力生 杜昕 乔岩 雷寒
页码:500-508
出版:人民卫生出版社
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号


 会员登录
会员登录

