一波三折!患者PCI术后40天再现心包压塞
67岁男性患者因“胸闷5小时”入院,给予常规治疗未见好转,遂行冠状动脉造影及支架手术。术后患者胸闷症状缓解,然而,术后反复出现起搏功能不良,超声提示大量心包积液,考虑临时起搏电极穿孔导致急性心包压塞,行心包引流,术后一周出院。术后40天患者再次出现心包积液。为何PCI术后会出现心包压塞?该患者再次出现的原因又是什么?详见以下病例——
患者,男,67岁,主因“胸闷5小时”于2013年6月16日急诊入院。入院后查心电图提示:窦性心动过缓,Ⅱ、Ⅲ、avF、V7~V9导联ST段抬高0.1~0.3mV,血生化检测示:心肌酶CK 1272U/L,CK-MB 94U/L,BNP 758pg/ml.。诊断:冠心病,急性下壁、后壁心梗,Killip Ⅰ级。住院后给予常规扩张冠状动脉、抗凝等处理,胸闷症状仍然不缓解。遂于入院后3小时(心梗后8小时)行急诊冠状动脉造影术。
因为患者心电监测呈现持续窦性心动过缓,心率45次/分,遂经右股静脉途径送入临时起搏电极导线至右室心尖部,给予心室起搏,起搏频率60次/分。冠状动脉造影提示:LM及LAD、LCX未见明显狭窄(图1-23-3),RCA中段以远处完全闭塞,血栓负荷较重(图1-23-4)。
给予盐酸替罗非班静脉泵入,RCA植入支架(2.5mm × 23mm Xience V支架),血流恢复(图1-23-5)。冠状动脉造影及支架手术顺利,患者胸闷症状缓解。术后12小时出现间断起搏不良,床旁非透视下微调起搏电极后起搏功能恢复正常。术后24小时再次出现起搏功能不良,导管室透视下与前一天临时起搏电极位置(图1-23-6)比较,发现心室起搏电极头端在右室心尖部较前有移位,位置较深(图1-23-7),遂撤出电极导线将起搏电极导线重新调整定位,起搏感知功能良好,起搏频率50次/分,观察血压正常,回到监护病房。
术后1小时,患者出现恶心大汗,血压由110/79mmHg下降到75/50mmHg,急诊床旁超声示大量心包积液,考虑临时起搏电极穿孔导致急性心包压塞。立即床旁心包穿刺,穿刺引流300ml血性心包积液,患者胸闷恶心、症状缓解,血压恢复正常。留置心包引流管,停用低分子肝素,继续应用阿司匹林和氯吡格雷治疗。PCI术后36小时自主心律恢复正常,撤除临时起搏电极导线。PCI术后72小时,心包引流管无心包积液引出,心脏超声示无心包积液,遂拔除心包引流管。PCI术后1周复查心脏超声示无心包积液,患者顺利出院。
患者PCI术后40天,主诉“胸闷、气短、腹胀、双下肢水肿5天”再次入院。查体:血压106/70mmHg,衰竭病容,不能平卧,颈静脉怒张,心界向两侧明显扩大,心率68次/分,心音遥远,肝脏肿大于肋下3指处触及,双下肢水肿。当地医院CT检查可见大量胸腔积液和心包积液。
入院后行心脏超声检查示:大量心包积液,诊断:冠心病,PCI术后大量心包积液,慢性心包压塞。第2次入院后第1天,给予心包穿刺留置心包引流管,抽出血性心包积液250ml,患者症状明显缓解。心包积液行实验室检查:外观血性,Rivalta试验阳性,乳酸脱氢酶2461U/L,总蛋白63g/L,红细胞0.3 × 1012/L,同时外周血红细胞3.1 × 1012/L,提示心包积液为渗出液,心包积液与血液的红细胞比值约为1∶11。查血生化示肝功能明显异常:ALT明显升高至836U/L,TB 60μmol/L,凝血四项检查示:纤维蛋白原下降至95mg/d(l正常参考值为180~350mg/dl),INR1.88,凝血酶原时间延长至20.9秒(正常参考值为9.8~12.1秒),血小板降低至87g/L,血红蛋白下降至98g/L(PCI术后1周出院前Hb为114g/L)。
遂停用阿司匹林,维持氯吡格雷应用,给予保肝药物及输血浆补充凝血因子等治疗。留置心包引流管,每天血性心包积液引流量300~600ml。因为心包积液持续出现并无减少,在第3天氯吡格雷减量为50mg/d,引流1周后仍有大量血性心包积液,血红蛋白继续下降至84g/L,遂在第7天完全停用氯吡格雷。心包引流管外接负压吸引器给予持续负压吸引。第10天心包引流管无心包积液引出,复查心脏超声示心包积液消失。继续观察3天仍无心包积液,拔除心包引流管。继续超声监测观察1周仍无心包积液,恢复应用氯吡格雷75mg/d,再继续观察1周未见心包积液,恢复应用阿司匹林100mg/d,维持双联抗血小板药物治疗随访1年,病情稳定,未再发心包积液。

图1-23-3 左冠状动脉造影影像
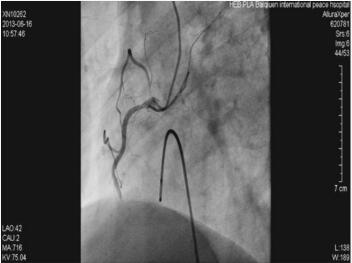
图1-23-4 右冠状动脉造影影像
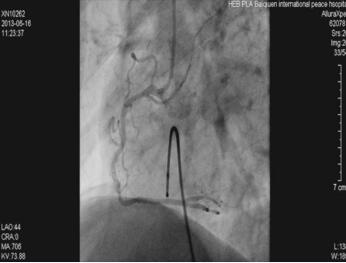
图1-23-5 右冠状动脉置入支架1枚
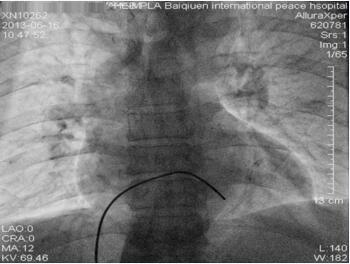
图1-23-6 临时起搏电极位置(急诊)

图1-23-7 临时起搏电极位置(较急诊影像比较临时起搏器电极头端向前移位)
点评:
1.心脏介入术中出现心包压塞的原因
心脏介入术中术后出现心包压塞是最危急的并发症之一。永久心脏起搏器术中因为起搏电极导致心肌穿孔,临床上并不少见,实际发生率远多于临床发现者,但是大多无症状,且未应用抗凝药,电极如果不拔除,一般不会出现心包压塞,电极尖端被纤维组织逐渐包裹,一般不需处理。PCI术中由于窦性心动过缓或者房室传导阻滞需要应用临时起搏器,临时起搏电极由于尖端较硬,操作不当有可能导致心肌穿孔。特别是急性下壁右室心梗,右室下后壁及心尖部局部心肌细胞变性坏死,心肌组织脆弱变薄,加上应用了大量抗凝药,极容易由临时起搏电极导致心肌穿孔,且出现心包压塞。本例患者临时起搏电极因为术后起搏功能不良,在床旁非透视条件下进行过起搏电极位置的调整,更增加了电极穿孔、心包压塞的几率。心包压塞最有效的处理手段就是立即心包穿刺置管引流心包积液,并酌情短期停用抗凝药。只要发现处理及时,绝大部分会恢复良好。所以处理的关键是在介入操作术中术后,医生的心中要有心包压塞并发症的意识,及时发现心包压塞,随时备好心包穿刺的抢救器材,才能避免延误抢救时间。
2.延迟出现心包压塞的原因
本例患者PCI术后40天再次出现心包压塞的原因:AMI后局部心肌坏死脆弱变薄,心肌穿孔后愈合功能差,加上应用双联抗血小板药物,局部穿孔心肌未能完全愈合,导致慢性渗血形成心包积液。另外本例患者合并血小板减少及明显凝血指标异常,局部穿孔处心肌更不易愈合。本例患者出现血小板减少及凝血指标异常的原因:肝脏是许多凝血因子合成的重要器官,肝功能损害可导致蛋白质合成能力下降、凝血因子合成减少,肝素酶合成减少,肝素灭活能力下降,血浆肝素含量升高,出现凝血功能障碍。肝功能损害,血清游离胆红素浓度升高时,会与血小板的膜脂质结合,而使其溶解或使其大量的被吞噬细胞吞噬,引起血小板质和量的异常。本例患者由于大量心包积液后出现右心衰竭,肝脏功能损害,出现继发性凝血指标异常和血小板数量减少,延缓穿孔心肌的愈合,增加心包慢性渗血,这样就形成恶性循环。
3.慢性心包压塞的处理
首先要立即行心包穿刺置管引流,减轻心包压塞的症状。因为患者的血红蛋白有持续下降,考虑患者局部心肌有微小穿孔导致慢性渗血,另外血性心包积液在1周内不断抽液后持续增长,根据心包积液的化验分析提示心包积液有10%为血液,其他为渗出性心包积液,考虑存在心脏损伤后综合征(PCIS)。处理上首先要考虑暂时停用抗凝药:本例患者采取停用阿司匹林,氯吡格雷减量,观察1周后无效。此时考虑外科手术修补的办法不可行,因为患者延迟出现的心包压塞是局部慢性渗血,局部心肌不一定有明确的孔道,很可能是弥漫性慢性渗血,外科手术缝补可能无从下手。
处理经验:延迟出现的慢性心包渗血、心包压塞需要完全停用抗凝药(阿司匹林和氯吡格雷),本例患者双联抗凝药停药3天后心包积血逐渐消失。当然,我们要权衡血栓与出血之间的风险效益比,否则有可能局部的心肌微小穿孔渗血永远不能自凝。长时间不愈合,会形成慢性窦道,处理会更加棘手。因为考虑患者延迟出现的心包压塞是局部弥漫性慢性渗血,外科手术缝补的策略可能不可行。另外,心包引流管外接负压引流器给予持续负压吸引,心包壁层和脏层紧密贴附,促进局部微小穿孔的愈合。还有,要重视肝脏功能的恢复,避免肝脏功能异常继发的凝血功能异常和血小板功能异常,从而导致持续性出血不能自凝。
来源:《规避陷阱:心血管疾病介入并发症防治攻略》
作者:韩雅玲 王祖禄 朱鲜阳
参编:丁世芳 王冬梅 王守力 王效增 王海昌
页码:350-352
出版:人民卫生出版社
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号


 会员登录
会员登录

