以溶血性贫血为首发表现的系统性红斑狼疮
患者,女性,21岁,未婚。
第一次住院(2007年3月20日入院):
主诉:乏力、胸闷、腹痛4天。
现病史:患者4天前无明显诱因出现明显乏力、胸闷,伴左上腹痛,持续性隐痛,食欲差,无恶心、反酸,无腹胀、黑便,无胸痛、咳痰。曾到消化科就诊,予“平胃舒”等药物口服治疗,腹痛症状好转,而乏力、胸闷症状有逐渐加重趋势。再次门诊就诊查血常规:血红蛋白(Hb)65g/L,门诊以“贫血原因待查”收入院。
既往史:无特殊。
体格检查:体温36.2℃,脉搏106次/分,呼吸18次/分,血压90/60mmHg。贫血貌,皮肤未见红斑、皮疹、出血点,眼睑无水肿,巩膜轻度黄染。双肺未闻及啰音,心率106次/分,未闻及杂音,心律齐。腹软,腹部无压痛及反跳痛,肝脾肋下未触及。双下肢无水肿。
治疗及转归
入院后每日监测血常规,血红蛋白进行性下降(49.2g/L、40.2g/L、37.2g/L),网织红细胞比例最高48%。尿常规:蛋白阴性,隐血阴性。总胆红素44.7μmol/L,非结合胆红素35.8μmol/L,Coomb’s 试验阳性,血沉(ESR)140mm/h,C 反应蛋白(CRP)阳性,类风湿因子(RF)阳性,补体C3 0﹒74g/L,补体C4 0﹒04g/L,免疫球蛋白IgG 29﹒34g/L,抗核抗体(ANA)1 ∶160,抗双链DNA抗体阴性。输血前化验:梅毒血清非特异性检测阳性,进一步检查梅毒血清特异性检测阴性。分别于本院输血科、市中心血站配血均失败,血型正反定型不和,主次两侧均发生强凝集,冷凝集素试验阳性。胸片正常。综上所述,考虑自身免疫性疾病导致的血管内溶血,病因高度怀疑系统性红斑狼疮(systemic lupus erythema tosus,SLE),给予甲泼尼龙500mg 静脉点滴,每日1次,连用3天,第三日同时给予大剂量丙种球蛋白25g 静脉点滴1次,应用钙剂、奥美拉唑等防治激素副作用,予抗生素预防感染。由于患者贫血进行性加重,住院第四日患者家属要求出院到北京诊治,同意患者转院。
出院诊断:①自身免疫性溶血性贫血;②系统性红斑狼疮。
病情分析
结合临床表现及辅助检查,此患者诊断自身免疫性溶血性贫血(AI HA)明确,AI HA 为一类疾病,有原发AI HA、继发AI HA之分。原发AI HA 无明确的病因,继发AI HA 可继发于下列疾病:①自身免疫性疾病:系统性红斑狼疮、类风湿关节炎、硬皮症、溃疡性结肠炎、自身免疫性甲状腺炎、异常球蛋白血症、自身免疫性肝病等;②肿瘤性疾病:淋巴瘤、白血病、浆细胞病、组织细胞增生症、某些实体瘤等;③感染:各种病毒感染、支原体肺炎、结核、亚急性细菌性心内膜炎、梅毒等。此患者为育龄期女性,溶血性贫血伴ANA 阳性、补体下降、血沉明显增快,故高度怀疑SLE 继发AI HA。关于SLE 的诊断标准,目前普遍采用的是1997年美国风湿病学会(ACR)拟定的诊断标准[1]。在ACR 的11条诊断标准中,此患者符合溶血性贫血、抗核抗体阳性两条,患者为首次就诊,无法判断梅毒血清试验假阳性是否持续6个月以上;追问患者似有关节疼痛病史,但不排除问诊的诱导作用,故此条标准不确定。其余如颧部红斑、盘状红斑、光过敏、口腔溃疡、浆膜炎、肾脏病变、神经系统病变均无确切证据,综上所述,11条诊断标准中符合2条,2条可疑。故本次住院虽高度怀疑,但不能确诊SLE。
第二次入院(2007年8月10日入院):
主诉:头痛1月余,眼睑水肿伴茶色尿1周。
现病史:前次出院后到北京某医院诊治,仍诊断为自身免疫性溶血性贫血,住院期间仍配血不成功,给予泼尼松30mg 每日1次及对症支持治疗,患者症状逐渐好转,血红蛋白逐渐上升。出院后继续口服泼尼松30mg 每日1次并逐渐减量,于2007年5月复查血红蛋白正常,停用泼尼松,2007年6月复查Hb 93g/L,再次口服泼尼松30mg 每日1次,并逐渐减量,入院前已减量至10mg 每日1次。患者于1月前无明显诱因出现右侧头痛,逐渐加重,伴双腕关节疼痛,无发热,无眼痛,无恶心、呕吐。1周前出现眼睑水肿伴茶色尿,尿量无异常,无尿急、尿频及尿痛,尿中无血块。来我院门诊,查尿常规:蛋白质+++,潜血+++;血沉66mm/h。补体C3 0﹒49g/L,补体C4 0﹒1g/L。血常规:血红蛋白87g/L。以“肾小球肾炎,系统性红斑狼疮,自身免疫性溶血性贫血”收入院治疗。
体格检查:体温37.1℃,脉搏80次/分,呼吸18次/分,血压90/60mmHg,眼睑轻度水肿。双肺未闻及啰音,心率80次/分,未闻及杂音,心律齐。腹软,腹部无压痛及反跳痛,肝脾肋下未触及,双肾区无叩痛。四肢关节无红肿,双下肢无水肿。病理反射未引出。
院内观察
入院后即给予泼尼松60mg/d 口服。查血常规:血红蛋白73g/L。尿常规:蛋白质+,潜血+,镜检红细胞0~1个/高倍镜;24小时尿蛋白定量0.2g(24小时尿量3000ml),乙肝及丙肝病毒标志物阴性。生化系列:丙氨酸氨基转移酶16U/L,天冬氨酸氨基转移酶28U/L,总胆红素39μmol/L,非结合胆红素33μmol/L,肌酐51.8μmol/L。补体C3 0﹒4g/L,补体C4 0﹒1g/L,免疫球蛋白IgG20.8g/L,抗核抗体(ANA)1 ∶640,抗双链DNA 抗体1 ∶10,抗Sm 抗体阴性,类风湿因子阳性,抗心磷脂抗体阴性。因患者头痛症状不缓解,且较剧烈,查头颅MRI 未见明显异常。进一步做腰椎穿刺,脑脊液外观清亮,白细胞9.6×10 9/L,脑脊液压力25cm H 2 O。脑脊液生化:蛋白质0.5g/L(参考值0.2~0.4g/L),葡萄糖3.0mmol/L(参考值2.5~4.4mmol/L),氯化物129mmol/L(参考值120~135mmol/L),脑脊液测抗核抗体1 ∶20。综上所述,患者有溶血性贫血,神经系统受累,抗核抗体及抗双链DNA抗体阳性,故明确诊断系统性红斑狼疮。因患者有明显的溶血,头痛较剧烈,给予甲泼尼龙0.5g 静脉点滴,每日1次,连用3天,同时给予环磷酰胺0.2静脉推注,隔日1次。应用甲泼尼龙第二日患者头痛明显减轻,尿色变浅,冲击治疗3日后,头痛症状消失,尿色清亮,之后多次复查尿常规均正常。
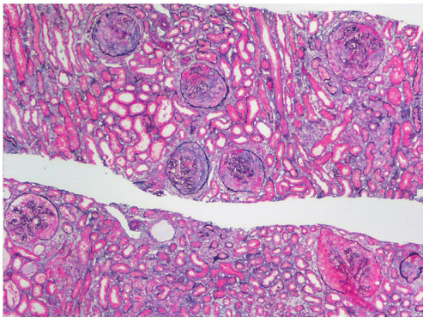
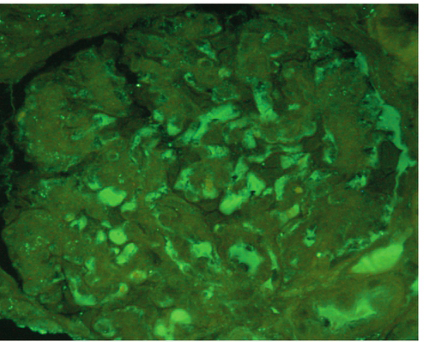
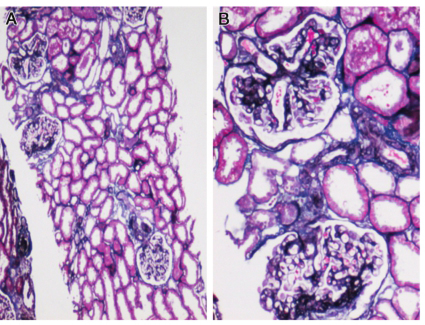
患者此次入院虽有尿化验异常,但结合临床,考虑尿化验异常的主要原因为溶血所致的血红蛋白尿,为进一步明确是否合并肾脏病变,行肾穿刺活检术。肾脏病理结果:光镜可见两条肾组织,全片共34个肾小球。肾小球细胞数轻度增多,可见节段性系膜增生和系膜基质增多。大部分毛细血管袢开放良好。肾小球基底膜(GBM)未见明显增厚。系膜区可见嗜复红物质沉积。肾小管上皮可见浊肿变性。肾内间质及小血管未见明显异常。免疫荧光:IgG、IgA、IgM、C3、C1q、Fi 弥漫颗粒状分布于系膜区及毛细血管袢。结论:系膜增生肾小球肾炎(轻度),结合临床与免疫荧光,符合狼疮性肾炎Ⅱ型。
诊断:①系统性红斑狼疮并自身免疫性溶血性贫血;②神经精神狼疮;③Ⅱ型狼疮性肾炎。
治疗及转归
应用环磷酰胺治疗总量至1.2g 时,复查肝功能丙氨酸氨基转移酶184U/L,天冬氨酸氨基转移酶79U/L,考虑环磷酰胺所致肝损害,由于患者为未婚女性,且甲泼尼龙冲击治疗后患者症状得到有效缓解,肾脏病理为Ⅱ型狼疮性肾炎,故停用环磷酰胺,继续口服泼尼松60mg/d 治疗。患者住院治疗3周,出院前一般情况良好,无头痛,尿色、尿量正常。血常规:血红蛋白100g/L。尿常规:正常;总胆红素13μmol/L,非结合胆红素7.7μmol/L。补体C3 0﹒4g/L,补体C4 0﹒2g/L,免疫球蛋白IgG 12﹒2g/L。
患者坚持门诊随访1年余,规律口服泼尼松治疗,未再发生明显溶血性贫血,尿常规基本正常。
讨论
SLE 是一种具有多系统损害及多种自身抗体的自身免疫性疾病,病因迄今不明。临床表现复杂,病情轻重不一,特别是早期或不典型的病例,无特征的临床表现,或仅有某些化验异常,给诊断带来一定的困难。
此患者在出现SLE 的临床表现半年之后才明确诊断,延误诊断的原因是患者第一次就诊不能满足美国风湿病学会(ACR)对SLE 的11条诊断标准的4条。上述分类标准对典型患者诊断的敏感性及特异性均较高,而对早期非典型患者的敏感性就较低,分类及诊断要求满足至少4条标准旨在保证分类诊断的特异性,满足越多,特异性越高,而不足4条标准者并不能排除诊断,如能够除外其他可能的继发性疾病,则应密切观察,随着病情的进展,部分患者可发展为典型的SLE。本患者由于未对SLE 及时作出诊断,首次病情缓解后,糖皮质激素治疗剂量偏小,减量速度快,造成病情反复,逐渐进展为较为典型SLE。临床工作中对年轻女性出现的症状不能用普通疾病解释时,特别是有多系统受累情况,要详细询问病史,并行相关的免疫学检查,必要时连续监测,以明确是否为SLE。
对SLE 来说,ACR 这11条标准敏感性及特异性亦各不相同。免疫学异常和高滴度的抗核抗体(ANA)更具有诊断意义。
ANA 的敏感性极高,在SLE 患者中的阳性率93%~100%,而特异性较低,高滴度ANA 是SLE 的诊断标准之一,低滴度的ANA 也可在感染、肿瘤中出现[2],甚至在正常老年人中也可出现低滴度的ANA 阳性。它可以在狼疮临床症状出现之前出现,因特异性不高,临床上常作为SLE 的筛选抗体。
抗双链DNA(dsDNA)抗体的特异性较高,敏感性中等。研究表明,该抗体与DNA 结合形成免疫复合物在肾小球基底膜沉积,或直接作用于肾小球抗原而造成SLE 患者的肾损害,因此抗dsDNA抗体与狼疮肾炎的发病及肾炎的严重程度有着极密切的关系[3],本患者肾损害轻,第一次入院抗dsDNA 抗体为阴性,第二次入院抗dsDNA 抗体1 ∶10 阳性,似乎印证了这一点。
抗Sm 抗体的特异性极高,几乎达100%,是SLE 的标志性抗体,而敏感性较低,其在SLE 中出现的比例约为30%。尽管其滴度可能随时间而改变,但如使用敏感的检测方法则很少发现该抗体完全消失,故可作为回顾性诊断指标[4]。近来研究发现该抗体如果与抗DNA 抗体同时出现者,其面部红斑、肾和血液系统损害及低补体血症的发生率明显增高,特别是抗Sm 抗体和抗dsDNA抗体同时阳性者发生肾脏损害的可能性明显增高,其预后比抗Sm抗体阴性者差[5]。
患者第二次住院虽尿常规显示尿蛋白及潜血阳性,但结合临床应首先认为是自身免疫性溶血导致血红蛋白尿的结果。尚不能诊断狼疮性肾炎(LN)。在肾脏病理明确为Ⅱ型狼疮肾炎后,进一步支持了SLE 的诊断。另外,目前SLE 的死亡除了本病病情发展因素外,治疗措施不当或治疗过度也是死亡的重要原因。此患者通过肾活检,明确诊断为Ⅱ型狼疮肾炎,属轻度肾损害,治疗不必联合应用免疫抑制剂,为治疗过程中患者出现肝功能受损后果断停用环磷酰胺提供依据,避免了治疗过度对患者的进一步损害。
本患者以自身免疫性溶血性贫血(AI HA)首发表现,临床较为少见。AI HA 是一组由于人体免疫功能紊乱产生红细胞自身抗体被附于红细胞膜上致使红细胞加速破坏的溶血性贫血。按其病因分为特发性及继发性两大类。有报道78例AI HA 中,继发性AI HA 为30例,其中并发SLE 22例,占AI HA 的28.2%,占继发性AI HA 的73.3%[6]。而在SLE 患者中,合并AI HA 者约占7%~15%[7]。SLE 合并AI HA 的机制主要是补体依赖或不依赖性抗体介导的红细胞损害。SLE 患者由于其体内的免疫功能紊乱,产生大量的多克隆免疫球蛋白和自身抗体,其中红细胞自身抗体与溶血有关[8]。红细胞自身抗体又分为温抗体及冷抗体。SLE 合并AI HA 的诊断要点:①临床上有溶血性贫血的表现和实验室证据;②抗人球蛋白试验(Coomb’s 试验)阳性或同时存在冷凝集素试验阳性;③同时或以后观察中逐渐出现典型的SLE 表现。以AI HA为首发或突出症状而就诊的SLE 患者,早期往往临床症状不典型,甚至也无明确的实验室指标,较易误诊为特发AI HA,应引起临床医师的高度重视。
SLE 合并AI HA 的首选治疗方法是应用糖皮质激素,且疗效明显,约96%有效[9]。糖皮质激素的应用原则应为“足量、持续、缓慢减量”,一旦突然撤药,抗体活跃,攻击自身红细胞,造成红细胞大量破坏,导致溶血危象。对急性发作、严重贫血的患者,治疗初期可采用“冲击疗法”,甲泼尼龙每次10~20 mg/kg,每日1次,连续或隔日冲击3天。激素治疗无效或需用较大剂量才能维持溶血不加重者,可加用免疫抑制剂或细胞毒性药物如环磷酰胺、硫唑嘌呤、甲氨蝶呤、酶酚酸酯及环孢素。静脉注射丙种球蛋白其机制为封闭巨噬细胞受体,抑制巨噬细胞对红细胞的结合和吞噬,并在红细胞表面形成保护膜,减少结合抗体复合物的红细胞被巨噬细胞吞噬,抑制自身免疫反应使抗红细胞抗体减少。该治疗效果明显,但其作用短暂、价格昂贵,一般仅用于激素治疗无效或激素禁忌的严重病例。其他还有血液净化、自体干细胞移植等方法。AI HA 时输血注意事项:因输血后可使溶血加速,贫血加重,从而可能发生急性肾衰竭,甚至危及生命,故应慎重。但严重贫血伴有循环衰竭或严重缺氧情况下,输注红细胞仍是抢救措施之一。
SLE 侵犯中枢神经系统,引起神经系统病变和精神障碍,即神经精神性狼疮(NPLE),其发病率约25%~75%,病死率为7%~40%[10],是SLE 的常见危急重症表现,也是仅次于继发性感染的SLE 第二大死因,可发生于SLE 的起病初始或病程中的任何阶段。1999年ACR 从基本的临床描述、诊断标准、重要的排除条件和确定方法等方面,细化了NPLE 常见的19 种症状的定义标准,提出了相关实验室、影像学检查和神经心理学测试的建议[11]。凡符合19 种神经精神表现之一并除外感染、药物等继发因素,结合影像学、脑脊液、脑电图等检查可诊断NPLE。脑脊液的检查对排除一些感染性脑病、脱髓鞘病变有重要意义,典型的NPLE 患者脑脊液改变为压力增高,细胞数和蛋白稍微增加,糖氯化物基本正常,此患者脑脊液改变即与之相符。
总结这一病例有助于提高对SLE 的诊断水平。临床既要有详尽的病史与系统的检查,也要有病理及免疫学资料,只有这两方面的有机结合才能提高临床诊断SLE 的准确性。
参考文献
[1]Hochberg MC.Updating the American Col ege of Rheumatology revised criteria for the classification of systemic lupus erythematosus .Arthritis Rheum,1997,40(9):1725 .
[2]I mran A,Neelam F,Tariq M.Incidence of circulating antinuclear antibod ies in cancer patients .Indian J Med Sci,2003,57(3):113‐116 .
[3]Riboldi P,Gerosa M,Moroni G,et al .Anti‐DNA antibodies:a diagnostic and prognostic tool for systemic lupus erythematosus .Autoimmunity,2005,38(1):39‐45 .
[4]Llorente MJ,Ji menez J,Gonzalez C,et al .Effectiveness of different meth ods for anti‐Sm antibody identification .A multicentre study .Clin Chem Lab Med,2005,43(7):748‐752 .
[5]Migliorini P,Baldini C,Rocchi V,et al .Anti‐Smand anti‐RNPantibodies . Autoimmunity,2005,38(1):47‐54 .
[6]董莉,杨国元,虞咏知,等.继发于系统性红斑狼疮的自身免疫性溶血性贫血22例.临床血液学杂志,2004,17(5):295 .
[7]Giannouli S,Voulgarelis M,Ziakas PD,et al .Anaemia in systemic lupus erythematosus:from pathophysiology to clinical assessment .Ann Rheum Dis,2006,65(2):144‐148 .
[8]Domen RE.An overview of immune hemolytic anemias .Cleve Clin J Med,1998,65(2):89‐99 .
[9]Gomard‐Mennesson E,Ruivard M,Koenig M,et al .Treat ment of isolated severei mmune hemolytic anaemia associated with systemic lupus erythe matosus:26 cases .Lupus,2006,15(4):223‐231 .
[10]Govoni M,Castellino G,Padovan M,et al .Recent advances and future perspectivein neuroimaging in neuropsychiatric systemic lupus erythe matosus .Lupus,2004,13(3):149‐158 .
[11]Hanly JG.ACR classification criteria for systemic lupus erythematosus:limitations and revisions to neuropsychiatric variables .Lupus,2004,13(11):861‐864 .
(陈超)
来源:《内科疑难病例.泌尿分册》
作者:杜新 齐卡
参编:陈光磊 余鹏程 徐德宇 毕礼明 刘伟
页码:56-70
出版:人民卫生出版社
- 评价此内容
- 我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号
 会员登录
会员登录

