一例缺乏典型临床症状的双肺结核病例诊治经验体会
24岁男性,1年前常规体检胸部X线片示异常,进一步检查胸部CT示双肺弥漫性增密影,呈铺路石样改变。1年来逐渐出现阵发性咳嗽,伴少量白痰。在外院行支气管镜检查,判断肺泡蛋白沉积症。2周后患者来笔者医院门诊就医,再次行支气管镜检查,门诊以肺泡蛋白沉积症收入院。如何诊治?
一、入院疑诊
(一)临床信息
【病史】
男性患者,24岁,1年前常规体检胸部X线片示异常,进一步检查胸部CT示双肺弥漫性增密影,呈铺路石样改变。起病初,患者无发热、咳嗽、咳痰及呼吸困难等症状。血常规、CRP、ESR、肺炎支原体抗体、3次痰找抗酸杆菌和肺肿瘤标志物均未见异常。1年来逐渐出现阵发性咳嗽,伴少量白痰。在外院行支气管镜检查,未见腔内异常,分别于肺右上叶和左下叶行支气管肺泡灌洗,灌洗液病理检查可见炎性细胞伴少量无形变性物,PAS阳性,结合临床表现判断符合肺泡蛋白沉积症。2周后患者来我院门诊就医,再次行支气管镜检查,支气管肺泡灌洗液涂片病理诊断示见多量纤毛柱状上皮细胞及少许组织细胞,组织细胞内似有蛋白性物,PAS染色为弱阳性。门诊以肺泡蛋白沉积症收入院。病程中,患者无心悸及胸前区疼痛,无腹泻、腹痛,无关节肿痛,无光过敏,无雷诺现象,无头晕、头痛,大小便正常,饮食及睡眠可,体重无明显增减。
患者既往身体健康,否认饲鸽以及动物接触史,否认烟酒嗜好以及药物过敏、长期药物服用史。
【体格检查】
体温36.8℃,心率100次/分,呼吸20次/分,血压135/78mmHg,动脉血氧饱和度(pulse oxygen saturation,SpO2)99%。神清、精神可,营养状况中等。气管居中,双肺呼吸音清,未闻明显干湿啰音。心律齐,未闻明显病理性杂音。腹软。全腹无明显压痛、反跳痛。双下肢无水肿。
【实验室检查】
血常规:WBC 12.3×109/L,N% 85%,Hb150g/L,PLT 291×109/L ;ESR 21mm/1h。
血气分析(吸氧 3L/min):pH 7.45,动脉血氧饱和度(arterial oxygen saturation,SaO2)99%,PaO2 142mmHg,PaCO2 31mmHg。
凝血及生化检查未见异常。
【影像学检查】
HRCT检查提示弥漫性簇性微结节聚集征以及广泛树芽征,呈地图状分布,纵隔淋巴结肿大 (图1)。

图1 不同病程阶段胸部HRCT表现
HRCT可见双肺弥漫性簇性微结节聚集征以及广泛树芽征,呈地图状分布(A),纵隔淋巴结肿大(B),并且随病程延长(10个月后)肺内类似病变有增多趋势(C)
(二)临床思辨
【临床特点】
1.患者为青年男性,病程1年余。
2.主要症状为渐进性干咳及气促,无明显阳性体征。
3.实验室检查显示血沉稍快,白细胞升高,中性粒系胞比例升高,其余无明显异常。支气管镜检查BALF病原学阴性,抗酸染色阴性;病理结果均提示PAS弱阳性。
4.影像学检查显示双肺弥漫性簇状分布微结节聚集,广泛树芽征形成,呈地图样分布,未受病变累及部位肺组织完全正常。
【思辨要点】
本例患者所患是感染性疾病还是非感染性疾病?
本病例影像学表现有两个特点:①双肺弥漫性微-小结节以及广泛树芽征形成;②病变未累及部位肺组织完全正常,病灶呈地图状分布。根据这两个特征,需要分析患者所患是感染性疾病还是非感染性疾病:患者病程1年余,为慢性过程。病灶呈缓慢增加,且临床症状渐显,表现为干咳和进行性气促。实验室检查结果提示白细胞升高、血沉稍快,结合影像学表现,首先要排除肺泡蛋白沉积症、弥漫性泛细支气管炎、结节病、尘肺、肺泡细胞癌等非感染性疾病。其次,依据病程长短考虑潜在感染性疾病:本病例表现难以用急性感染性疾病解释,如病毒性感染、真菌感染和吸入性感染等,可以排除此类感染性疾病,但不排除特殊病原体的感染。
因此,依据临床特点和影像学表现,对于本病例的诊断和鉴别诊断,需要排除或考虑以下疾病。
(1)肺泡蛋白沉积症(PAP):
是以肺泡及终末呼吸性细支气管内沉积富含脂蛋白样物质为特点的少见肺部疾病。依据其病因,可分为先天性、特发性和继发性。其中,90%以上PAP为特发性,且绝大多数患者体内存在抗粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)自身抗体,导致肺泡巨噬细胞成熟障碍,对表面活性物质的清除能力下降,使得表面活性物质在肺泡内积聚过多,发生肺泡蛋白沉积症。继发性PAP常见于职业粉尘吸入以及合并血液病患者。PAP临床症状包括咳嗽、咳痰、活动后气促,易合并感染。典型PAP的HRCT表现为磨玻璃影背景下,小叶间隔增厚交织形成铺路石样改变,或在肺泡实变与正常肺实质之间出现很明显的分界线,形成地图样分布(图2)。一旦根据临床和影像学资料,考虑PAP可能,需要依靠组织病理学活检和(或)支气管肺泡灌洗(BAL)确诊。75%临床怀疑为PAP者,可通过BAL检查确定诊断。病理检查发现肺泡腔内充满颗粒状或块状嗜伊红物质,PAS染色呈阳性,是确定PAP诊断的可靠方法。本例患者,HRCT表现病变呈地图样分布,广泛小结节状影以及树芽征,虽然两次支镜检查均有PAS染色异常,但肺活检组织病理不支持肺泡蛋白沉积症诊断。
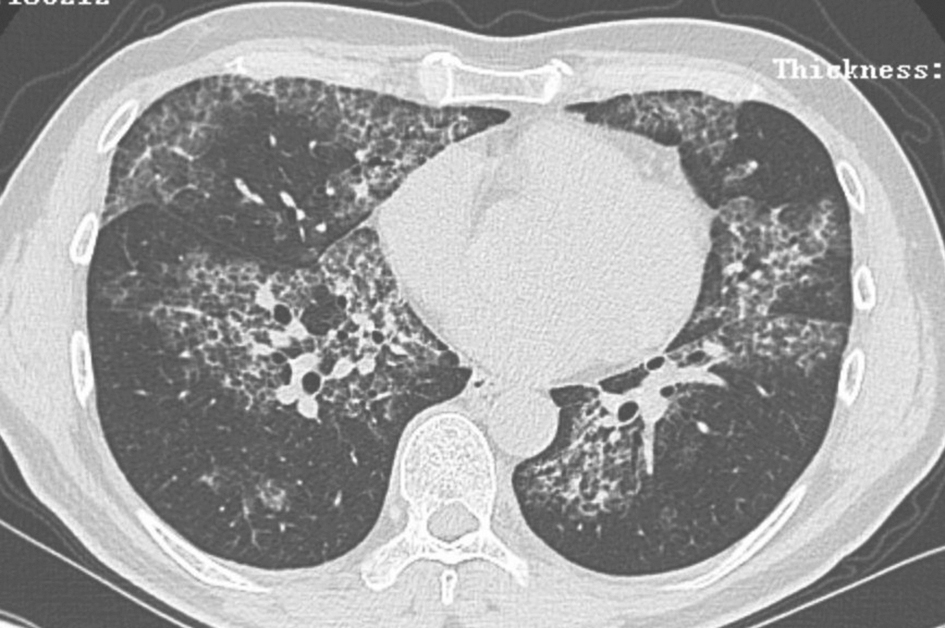
图2 肺泡蛋白沉积症胸部CT表现
男性患者,55岁,因活动后胸闷、气喘5年入院。胸部CT示两肺多发磨玻璃影,地图样分布,其内见铺路石征。行支气管镜检查,支气管肺泡灌洗液及病理符合PAP
(2)弥漫性泛细支气管炎(DPB):
是一种病因与发病机制不明的疾病,与呼吸性细支气管和鼻旁窦慢性炎症相关,组织学特征为大量泡沫状巨噬细胞聚集于细支气管和肺泡管内。DPB几乎只发生在亚洲,尤其是东北亚,如日本和我国。平均发病年龄在40岁左右,男女比例为2∶1。DPB临床症状包括咳嗽、咳痰和进行性气短,70%患者伴有慢性鼻旁窦炎。其HRCT表现包括以双肺中下肺分布为主的小叶中心结节影和树芽征,细支气管-支气管扩张,肺实质密度减低和血管减少(图3)。DBP在不同阶段,HRCT表现不同,疾病初期为微结节,逐步发展为细支气管扩张,晚期表现为囊状支气管扩张。依据典型的临床症状、体征以及影像学、阻塞为主的混合性通气功能障碍、鼻旁窦侵犯以及冷凝集试验阳性等证据,常可获得临床诊断。确诊依据组织病理。DPB典型病理表现为呼吸性细支气管内和小叶中心附近区域淋巴细胞和浆细胞聚集,泡沫样巨噬细胞在呼吸性细支气管壁、肺泡管附近和肺泡内沉积,同时可见淋巴组织细胞。本病例虽然表现为广泛微-小结节以及树芽征,但缺乏DPB阻塞性特征表现(如肺过度充气),而且患者也无鼻旁窦炎表现及咳嗽、咳痰和进行性气短,因此临床诊断DPB证据不足。
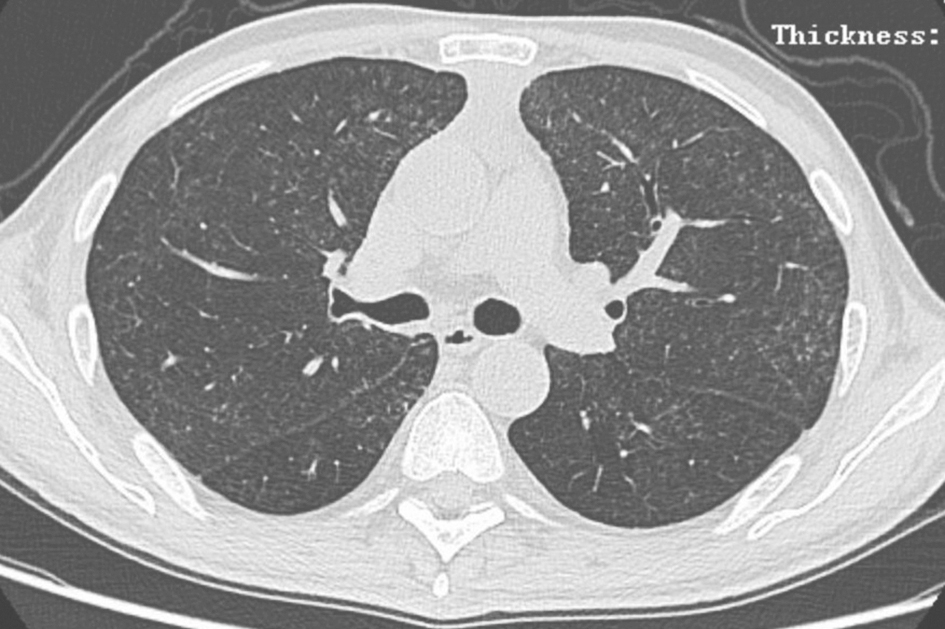
图3 弥漫性泛细支气管炎胸部CT表现
男性患者,58岁,因间断发热伴腹泻2个月余入院,既往有胸腺瘤手术史。胸部CT提示弥漫性小叶中心型结节影以及磨玻璃影。肺功能检测提示轻度混合性通气功能障碍
(3)肺结节病:
是一种病因不明且影响多个器官的全身性炎症性疾病,表现为非干酪样肉芽肿。90%以上病例有肺部累及,30%~50%患者可无症状,因常规体检发现肺门淋巴结肿大而就诊。最常见的临床主诉是呼吸困难、咳嗽、胸痛。全身症状包括乏力、消瘦以及虚弱不适等。约90%结节病患者在CT上可见肺门和纵隔淋巴结肿大。淋巴结钙化相对常见,可见于40%~50%持续性结节病患者。钙化常为局灶性分布,但也可弥漫分布或呈蛋壳样。肺内结节病HRCT显示,肺内小结节影主要分布在淋巴管周围,与支气管和肺动静脉毗邻,沿小叶间隔、叶间裂、胸膜下区分布(图4)。结节病是一种排除性诊断疾病,结合病理表现,需排除结核以及其他肉芽肿性疾病。依据临床及影像学改变,本例仍不能排除结节病诊断,但两次纤支镜检查结果未能提供诊断依据。
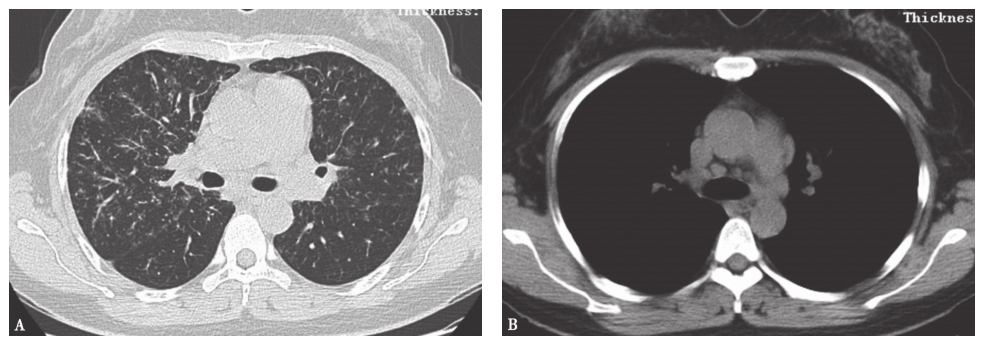
图4 结节病胸部CT表现
女性患者,45岁,因活动后气喘1年余入院。胸部CT提示沿淋巴管分布的小结节影累及叶间裂,小叶间隔增厚(A);纵隔淋巴结肿大且不具有融合倾向(B)。肺功能检查示通气功能基本正常,弥散功能轻至中度降低。支气管镜检查右肺支气管黏膜以及中叶TBLB病理示支气管黏膜组织部分区见上皮样肉芽肿形成,并可见多核巨细胞反应、肉芽肿性病变,抗酸染色、GMS染色、PAS染色均阴性
(4)矽肺(硅沉着病):
是持续暴露于大量可吸入性二氧化硅而引起的疾病,即可吸入的结晶硅酸盐进入肺部,导致肉芽肿和纤维化。矽肺的临床表现主要有三个类型,急性矽肺、速发型矽肺和典型矽肺,其临床表现取决于二氧化硅暴露的时间和浓度。急性矽肺是一种急性和渐进性矽肺,患者经常因呼吸衰竭而死亡。速发型矽肺病程相对较长,一般在5年内死亡。典型矽肺是最常见的表现形式,患者长期暴露于低浓度二氧化硅引起双肺缓慢的渐进性结节状浸润,主要分布于上肺。一般,患者持续暴露于硅尘10~20年才出现临床症状。与其他吸入性职业性肺病不同,矽肺患者的肺部病灶在其离开暴露环境后依然进展。矽肺是发生慢性炎症的结果,其机制涉及肺泡和巨噬细胞对吸入矽尘的吞噬作用及矽尘在肺间质中沉积。影像学可表现为大小不同的小结节,乃至大块纤维灶形成,即进行性巨块型纤维化(progressive massive fibrosis,PMF)。单纯矽肺小结节影通常边界清楚,直径为1~10mm,主要分布于肺上叶,常伴有钙化(图5)。大块纤维化灶常见于上肺区,边界光滑或不规则。另外一个较具特征性的影像学改变为淋巴结呈蛋壳样钙化。总的来说,诊断矽肺需具有明显二氧化硅接触或暴露史,并出现典型弥漫小结节等影像学表现。本例患者无相关的接触史,诊断依据不足,可排除该疾病。
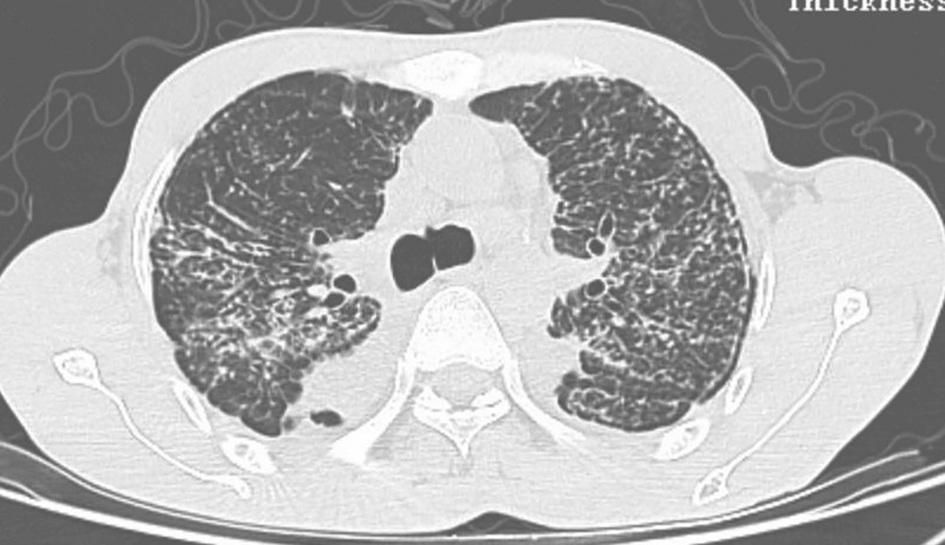
图5 矽肺胸部CT表现
男性患者,43岁,从事大理石加工工作约4年,因咳嗽、渐进性气喘8个月入院。胸部CT显示两肺沿淋巴管分布的小结节影、胸膜下线、小叶间隔增厚等;肺功能示中度限制性通气功能障碍和弥散功能障碍;经支气管肺活检见矽肺结节
(5)细支气管肺泡细胞癌(bronchioloalveolar carcinoma,BAC):
为腺癌的一个亚型。2004年世界卫生组织(World Health Organization,WHO)明确提出其诊断条件为肿瘤细胞沿着肺泡贴壁生长并且无间质、血管或胸膜浸润证据。2011年,国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)/美国胸科学会(American Thoracic Society,ATS)/欧洲呼吸学会(European Respiratory Society,ERS)联合发布了关于肺腺癌的国际多学科分类新标准,废除了BAC这一诊断名称,而将其以微浸润腺癌和原位腺癌替代。但由于其相对独特的影像学表现,本书仍以BAC代表该诊断。BAC的临床常进展较慢,多有黏液分泌亢进,咳大量白色泡沫痰。其影像学可表现为4类:单发结节型、多发结节型、单发实变型和多叶实变型。其中多发结节型可表现为双肺弥漫性大小不等的结节影,呈随机性分布(图6),须与本例相鉴别。本例患者影像学表现与BAC有较大区别,且临床症状为干咳、气促,故暂不考虑BAC诊断。

图6 肺黏液腺癌胸部CT表现
女性患者,63岁,因咳嗽、咳白色泡沫痰1个月余入院。胸部CT示沿支气管血管束分布的磨玻璃密度结节影,部分融合实变,在磨玻璃密度区域尚可见铺路石样改变。病理示黏液腺癌
(6)肺结核:
是由结核分枝杆菌引起的慢性传染性疾病。结核分枝杆菌是一种需氧不运动的无芽孢棒状杆菌,并对干燥、酸及乙醇有很强的抵抗力,在人群中主要通过患者咳嗽时产生的飞沫传播。活动性肺结核在细胞免疫低下人群(包括年幼或高龄者、营养不良者、肿瘤患者、使用免疫抑制剂治疗患者、HIV感染者、终末期肾病患者以及糖尿病患者等)发病率明显增加,临床表现从无症状到轻微症状(如干咳)或严重症状(如发热、体重减轻、咯血等)。结核典型的组织学表现为上皮样肉芽肿性炎,常有干酪样坏死,可见朗格汉斯巨细胞。结核的影像学表现多样,不典型病例影像学常给临床诊断带来困难。典型的结核影像学表现为在结核好发部位(如上叶尖后段、下叶背段)局灶性或斑片状不规则实变影,可合并空洞、钙化等改变。粟粒性肺结核与本例患者表现接近,表现为大小均一随机性分布的小结节影,沿支气管播散病灶形成小叶中心结节影。本例患者发病10个月,病灶进行性增多,症状隐袭,以小叶中心结节影和树芽征为表现,因此目前不能排除结核分枝杆菌感染。
二、诊治过程及确诊
(一)临床信息
根据临床资料和对疾病的深入分析,对本例患者的诊断主要在于鉴别肺泡蛋白沉积症和肺结核。再次支气管镜检查病理结果仍提示PAS染色弱阳性,并可见慢性炎症改变,难以确诊,但患者拒绝电子胸腔镜肺活检和试验性抗结核治疗,要求定期随诊观察。
在随访中,患者渐渐出现临床症状,表现为干咳伴活动后轻度气促,无明显咳痰,无发热,无明显胸痛,无咯血及痰中带血。
鉴于患者胸部影像学表现有明显进展,行电视辅助胸腔镜检查,分别钳取右肺上、下叶组织各一块,送病理检查。肺组织病理示细支气管黏膜下形成良好的上皮肉芽肿,朗格汉斯巨细胞包绕,中心有干酪样坏死(图7);组织抗酸染色阳性(图8)。病理确诊为肺结核。
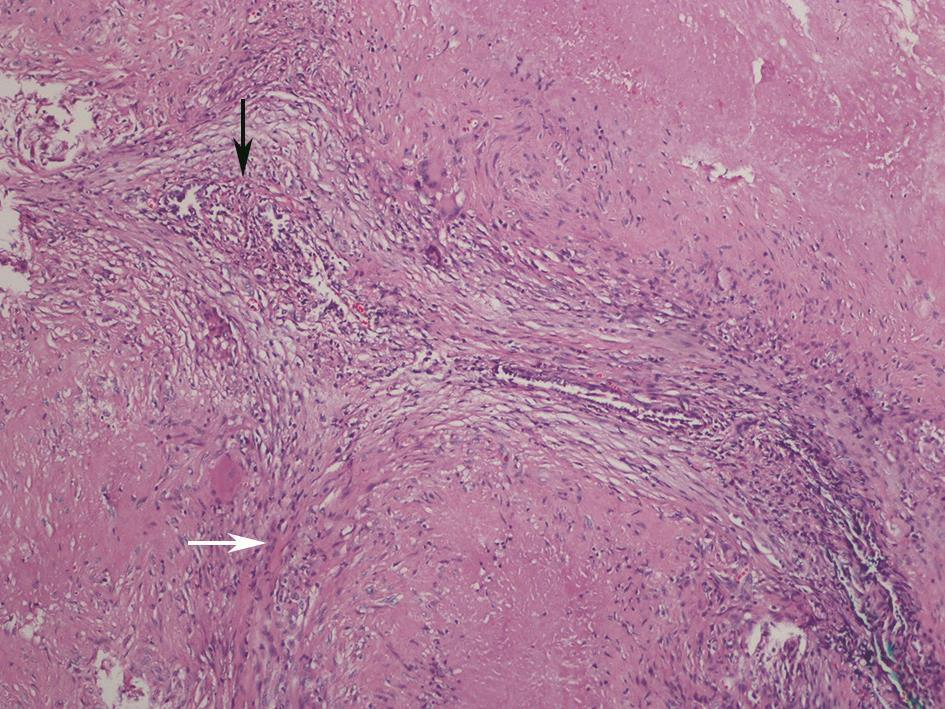
图7 肺组织病理表现
胸腔镜术后病理提示沿细支气管黏膜下(黑色箭头)分布多灶肉芽肿性结构(白色箭头),可见多核巨细胞反应,以及中心性干酪样坏死(HE染色,100×)
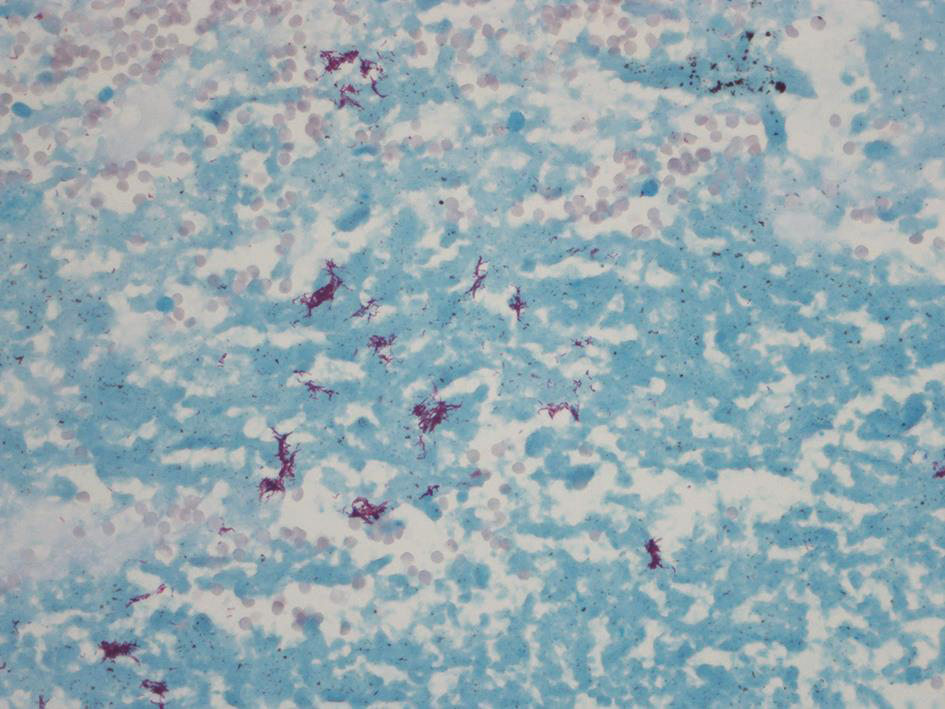
图8 肺组织抗酸染色呈
组织中可见抗酸染色阳性杆菌聚集(抗酸染色,1000×)
最后诊断:双肺结核。
患者在明确诊断肺结核后,转至当地胸科医院行抗结核治疗。电话随访,经6个月短程治疗后患者临床症状完全消失,影像学显示病变吸收。
(二)临床思辨
对于本例患者,在起病初,由于检查结果干扰(PAS染色异常)以及患者选择,酌情选择观察而非进一步检查以明确诊断,10个月后才经电视辅助胸腔镜检查获得确诊。
在我国,结核病是呼吸系统常见病。典型病例(如具有典型临床表现以及典型影像学表现的临床疑诊患者)常可得到明确诊断,但本例患者的临床表现以及影像学均不典型,给诊断带来难度,极易漏诊和误诊。
1.对于抗酸染色阴性者,有无其他病原学诊断措施?
患者在门诊以及纤支镜检查过程中,多次行不同标本的抗酸杆菌染色,均呈阴性,这是其未能及时确诊的原因之一。痰涂片显微镜检查以及痰和分泌物培养是诊断肺结核的常用工具,但结核分枝杆菌培养通常需要6~8周得到结果,限制了其作为第一线诊断工具的价值。在英国,约70%肺结核患者痰培养可得到阳性培养结果。我国的资料显示肺结核患者痰培养阳性结果为37.7%。因此,抗酸杆菌染色仍是最常用并且能有效诊断肺结核的工具。
我国是结核病高发国家,而等待结核分枝杆菌培养时间相对长,可能导致菌阳肺结核扩散等严重后果。因此,按照原国家卫生部结核规范诊疗程序,如果一个患者因临床症状和(或)影像学疑诊肺结核时,至少应进行3次以上包括清晨第一口痰在内的痰抗酸杆菌涂片检查。可以明确诊断肺结核的条件包括以下之一:①至少两次抗酸杆菌染色阳性;②痰培养阳性伴或不伴一次抗酸染色阳性;③病理诊断肺结核确立。本例患者最终经病理诊断,明确为肺结核。
有研究显示,原发性肺结核和继发性肺结核在病理表现上存在一定的区别。Hunter等人曾报道,原发性肺结核病灶结节中心由粉红色干酪样坏死聚集形成,高倍放大镜下可见坏死由类上皮样巨噬细胞和多核巨细胞包绕,边缘为淋巴细胞。而继发性肺结核的病理表现为中心为干酪样脂质坏死性肺炎,并且最终形成空洞。虽然原发性肺结核在健康成年人的发病率低至5%~10%,但是本例患者不能排除原发性肺结核的可能——其在长达1年之久的病程中,并未形成空洞性病灶。而且就传播速度而言,原发性肺结核较缓慢,也符合本例患者的临床特征。
2.本例“簇性微小结节聚集征”影像学表现是否有例可循?
树芽征由终末细支气管单个分叉起源的多个管道线性结构病变以及与之相连的小叶中心结节所组成,最初在肺结核患者的胸部CT中发现,现在已被认为可见于多种疾病的CT表现。根据Devaconda等描述,HRCT主要表现为树芽征的疾病包括感染性细支气管炎、广泛吸入性细支气管炎、弥漫性泛细支气管炎和一些先天性疾病(如肺囊性纤维化)等。最近,Miller等报道,仅有40.9%HRCT所见树芽征可找寻到病因,其中72%为感染性病因(如细菌和病毒)所致,肺结核是导致树芽征的最常见病因。结核性树芽征主要是由结核分枝杆菌沿气道感染播散形成,常伴随支气管壁增厚以及支气管扩张,小叶中心结节、实变、空洞以及胸腔积液形成等。本例肺结核患者呈现的影像学表现较为特殊,以簇性微结节聚集征为主,伴有纵隔淋巴结肿大。簇性微结节聚集征与树芽征的影像组成基本相似。树芽征为一个管道线性结构受累导致与之相连的两个小叶内间质受累,形成类似树芽状改变。簇性微结节聚集征则可能是由于终末细支气管所属更广泛的管道线性结构受累,导致其以下各分支因阻塞、液体潴留或炎性物质填充等。
2005年,Heo等在肺结核HRCT中描述了一种独特的影像学特征,类似于结节病的星云征,定义为“小结节聚集征”。结核病灶呈小结节聚集、融合,形成一个较大结节或实变样改变,可合并支气管壁增厚、树芽征等表现。本例患者所见微结节聚集更广泛、更清晰,呈现两肺弥漫性改变。2011年,Marchiori等人综述了HRCT上非典型分布的小结节表型以及鉴别,其中1例明确诊断为肺结核患者的HRCT表现为两下肺分布的非融合性微结节聚集影像,定义为“结节聚集征”。本例患者与其极为类似,但分布更为广泛,两肺肺叶分布无倾向性。“结节聚集征”作为HRCT表征描述,难以区分结节病和肺结核,但结核病结节聚集征无沿淋巴管分布特征,因此Marchiori等总结,对于出现非淋巴管分布的结节聚集征且纵隔淋巴结不大者,倾向于诊断肺结核,这与本例患者情况相似。因此,对于本病例,笔者初步描述为“簇性微小结节聚集征”。
3.为何本例患者会出现支气管肺泡灌洗液和组织PAS染色异常?
据文献报道,病理表现为肉芽肿的患者,其致病菌不限于结核,也可为真菌(占5%~20.4%),表现PAS染色阳性。真菌感染发生PAS反应阳性的原因是细胞壁中有富多糖物质,多糖也是结核分枝杆菌的重要组成,因此可能存在着一定的交叉反应。
精要回顾与启示
本例患者以渐进性咳嗽、咳痰、气短为临床表现,符合常见的间质性疾病表现。然而,仔细阅读患者胸部CT,发现有两个主要改变:①双肺弥漫性微-小结节以及广泛树芽征形成;②病变未累及部位肺组织完全正常,病灶呈地图状分布。树芽征可见于多种疾病,包括肺部感染性病变、吸入性病变、肺小血管性病变和细支气管病变等。感染性病变以及间质性病变均可有类似表现,某些征象有助于鉴别:例如,弥漫性泛细支气管炎除了树芽征以外尚有阻塞性肺疾病的肺功能表现,且伴有小叶中心型结节影,合并鼻窦炎等肺外表现;而感染性病灶,病程较急,伴有发热等表现。
不典型肺结核临床表现呈多样性、异质性,对临床有很大的挑战,由于诊断时间延长,可能会导致感染扩散,影响患者预后。因此,对于某些不典型病例,有必要采用侵袭性手段进一步探索病因。
参考文献
[1]BORIE R,DANEL C,DEBRAY MP,et al.Pulmonary alveolar proteinosis[J].Eur Respir Rev,2011,120:98-107.
[2]FAHIM A,MANN JS.Pulmonary sarcoidosis :diagnostic and treatment update[J].Expert Rev Respir Med,2014,4:493-501.
[3]LEUNG CC,YU IT,CHEN W.Silicosis[J].Lancet,2012,379:2008-2018.
[4]KERR KM.Clinical relevance of the new IASLC/ERS/ATS adenocarcinoma classification[J].J Clin Pathol,2013,66(10):832-838.
[5]GARDINER N,JOGAI S,WALLIS A.The revised lung adenocarcinoma classification-an imaging guide[J].J Thorac Dis,2014,Suppl 5:S537-546.
[6]WANG L,ZHANG H,RUAN Y,et al.Tuberculosis prevalence in China,1990-2010,a longitudinal analysis of national survey data[J].Lancet,2014,383:2057-2064.
[7]HEO JN,CHOI YW,JEON SC,et al.Pulmonary tuberculosis :another disease showing clusters of small nodules[J].AJR Am J Roentgenol,2005,184:639-642.
[8]MARCHIORI E,ZANETTI G,BARRETO MM,et al.Atypical distribution of small nodules on high resolution CT studies :patterns and differentials[J].Respir Med,2011,105:1263-1267.
[9]卫生部疾病预防控制局,卫生部医政司,中国疾病预防控制中心.中国结核病防治规划实施工作指南(2008年版)[M].北京:中国协和医科大学出版社,2008.
[10]VAN Deun A,PORTAELS F.Limitations and requirements for quality control of sputum smear microscopy for acid-fast bacilli[J].Int J Tuberc Lung Dis,1998,2:756-65.
[11]LEAHY AU,LIPMAN M,HETZEL M,et al.Do we need bacteriological confirmation of cure in uncomplicated tuberculosis [J]. Eur Respir J,2013,42:860-863.
[12]ZHU C,CUI Z,ZHENG R,et al.A multi-center study to evaluate the performance of phage amplified biologically assay for detecting TB in sputum in the pulmonary TB patients[J].PLoS One,2011,6:e24435.
[13]ROSSI SE,FRANQUET T,VOLPACCHIO M,et al.Tree-in-bud pattern at thin-section CT of the lungs:radiologic-pathologic overview[J].Radiographics,2005,25:789-801.
[14]DEVAKONDA A,RAOOF S,SUNG A,et al.Brochilolar disorders :A clinical-radiological diagnostic algorithm[J].Chest,2010,137:938-951.
[15]MILLER WT JR,PANOSIAN JS.Causes and imaging patterns of tree-in-bud opacities[J]. Chest,2013,144:1883-1892.
[16]IM JG,ITOH H,SHIM YS,et al.Pulmonary tuberculosis :CT findings-early active disease and sequential change with antituberculous therapy[J].Radiology,1993,186:653-660.
[17]HERRAEZ ORTEGA I,ALONSO ORCAJO N,LOPEZ GONZALEZ L.The “sarcoid cluster sign”.A new sign in high resolution chest CT[J].Radiologia,2009,51:495e9.
[18]TACK D,NOLLEVAUX MC,GEVENOIS PA.Tree-in-bud pattern in neoplastic pulmonary emboli[J].AJR Am J Roentgenol,2001,176:1421-1422.
[19]FRANQUET T,GIMENEZ A,PEATS R,et al.Thrombotic microangiopathy of pulmonary tumors :A vascular cause of tree-in-bud pattern on CT[J].AJR Am J Roentgenol,2002,179:897-899.
[20]MAJEED MM,BUKHARI MH.Evaluation for granulomatous inflammation on fine needle aspiration cytology using special stains[J].Patholog Res Int,2011:851524.
知识来源
人卫知识数字服务体系
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号


 会员登录
会员登录

