一例自身免疫性胰腺炎诊治经验分享
中老年男性,病史1个月,以食欲不振、消瘦为主要表现,超声检查提示胰腺体尾部增大、回声减低,淀粉酶、C反应蛋白升高,血沉增快。该患者所患何病?
一、病例介绍
1.患者基本情况
患者:男性,66岁。
主诉:食欲不振、乏力、困倦伴消瘦1个月。
现病史:1个月前,患者无明显原因出现食欲不振,进食量较前下降约1/2,伴乏力、困倦,体重下降约5kg,无腹痛、腹胀、恶心、呕吐或黑便,无反酸、胃灼热、腹泻、发热,无心悸、胸闷,未服药。发病以来,患者神志清、精神尚可,饮食差,睡眠一般,大小便未见异常。
既往史:患高血压病8年,服用非洛地平缓释片;患糖尿病5年,服用二甲双胍;22年前患急性黄疸型肝炎,治愈;否认结核传染病史。
个人史:吸烟20年余,每日约20支。
家族史:无特殊。
2.入院查体
神志清,精神尚可,营养中等,巩膜无黄染,睑结膜无苍白,浅表淋巴结未触及肿大,心肺未闻及明显异常。腹软,无压痛及反跳痛,腹部未触及包块,肝脏、脾脏肋下未触及,Murphy征阴性,移动性浊音阴性,肝区、双肾区无叩击痛,肠鸣音4次/min。双下肢无水肿。
3.入院辅助检查
血常规:白细胞计数6.36×109/L,红细胞计数4.31×1012/L,血红蛋白133g/L,中性粒细胞计数3.94×109/L,单核细胞计数0.22×109/L,嗜碱性粒细胞计数0.02×109/L,嗜酸性粒细胞计数0.46×109/L,淋巴细胞1.72×109/L,血小板计数229×109/L。血糖21.00mmol/L,糖化血红蛋白10.90%,尿糖3+。C反应蛋白11.4mg/L(正常参考值:0.068~8.2mg/L),红细胞沉降率51mm/第1h末(正常参考值:0~15mm/第1h末),降钙素原0.025ng/mL(正常参考值:0~0.05ng/mL),淀粉酶 181U/L(正常参考值:15~115U/L),脂肪酶307U/L(正常参考值:0~60U/L)。肝功能:丙氨酸氨基转移酶13IU/L,天冬氨酸氨基转移酶11IU/L,碱性磷酸酶105IU/L,谷氨酰转肽酶18IU/L,总胆红素15.1µmol/L,间接胆红素11.8µmol/L,总蛋白81.3g/L,白蛋白45.5g/L,白球比1.27。肾功能:尿素7.30mmol/L,肌酐117µmol/L,尿酸 361µmol/L。血脂:总胆固醇4.00mmol/L,甘油三酯 2.50mmol/L,高密度脂蛋白胆固醇0.90mmol/L,低密度脂蛋白胆固醇2.47mmol/L,载脂蛋白A-1 0.81g/L(免疫浊度法),载脂蛋白B 0.97g/L(免疫浊度法)。结明三项(结明试验、ICT-TB卡试验、快速TB卡试验):TB-DOT 阳性(+),TB-ChecK(1)(-),TB-Ig(-)。皮质醇:早8点12.93µg/dL(正常参考值:8.7~22µg/dL),下午4时4.75µg/dL(正常参考值:8.7~22µg/dL)。甲状腺功能:游离甲状腺素15.76pmol/L(正常参考值:7.9~14.4pmol/L),游离三碘甲状腺原氨酸4.62pmol/L,促甲状腺激素1.35mIU/L。肿瘤标记物:CEA、CA199、CA724、CA125、CA153、AFP、CA50、NSE正常,CY211 5.75ng/mL(正常参考值:0.1~2.38ng/mL)。肝胆脾胰彩超:胰腺体尾部体积增大、回声减低(范围约71mm×31mm),主胰管未见扩张,胆囊壁毛糙。
4.初步诊断思维过程
(1)入院时病情总结
该患者为中老年男性,病史1个月,以食欲不振、消瘦为主要表现,超声检查提示胰腺体尾部增大、回声减低,淀粉酶、C反应蛋白升高,血沉增快。
(2)入院时诊断思路
患者为中老年男性,出现食欲不振及消瘦1个月,超声检查提示胰腺体尾部增大、回声减低,很容易与胰腺癌的黄疸、腹痛、体重下降三大症状关联,但相关肿瘤指标CA199不高,不支持该诊断,需行增强CT、MR、EUS等鉴别。另一个可能的诊断是慢性胰腺炎。慢性胰腺炎临床主要表现为腹痛、消化不良、胰源性糖尿病、体重减轻等;超声检查见胰腺体积增大或萎缩、边缘不整,胰腺实质回声变化、团块、钙化,胰管扩张等。有15%的慢性胰腺炎患者可无腹痛或腹痛轻。故该病例亦不能排除慢性胰腺炎诊断。CT、MR、ERCP有助于诊断慢性胰腺炎。该患者TB-DOT阳性,故虽罕见,也不能完全排除胰腺结核的可能,胰腺组织穿刺病理有助于明确诊断。综上分析,下一步应行CT、MR、MRCP、胰腺组织穿刺病理进行鉴别。
(3)入院初步诊断:
①食欲不振待查,胰腺癌或慢性胰腺炎可能;②高血压病;③2型糖尿病。
5.后续检查
腹部CT:胰体尾部形态饱满,边缘毛糙,周围可见渗出影,密度不均匀,边缘欠清。左侧肾筋膜囊增厚。
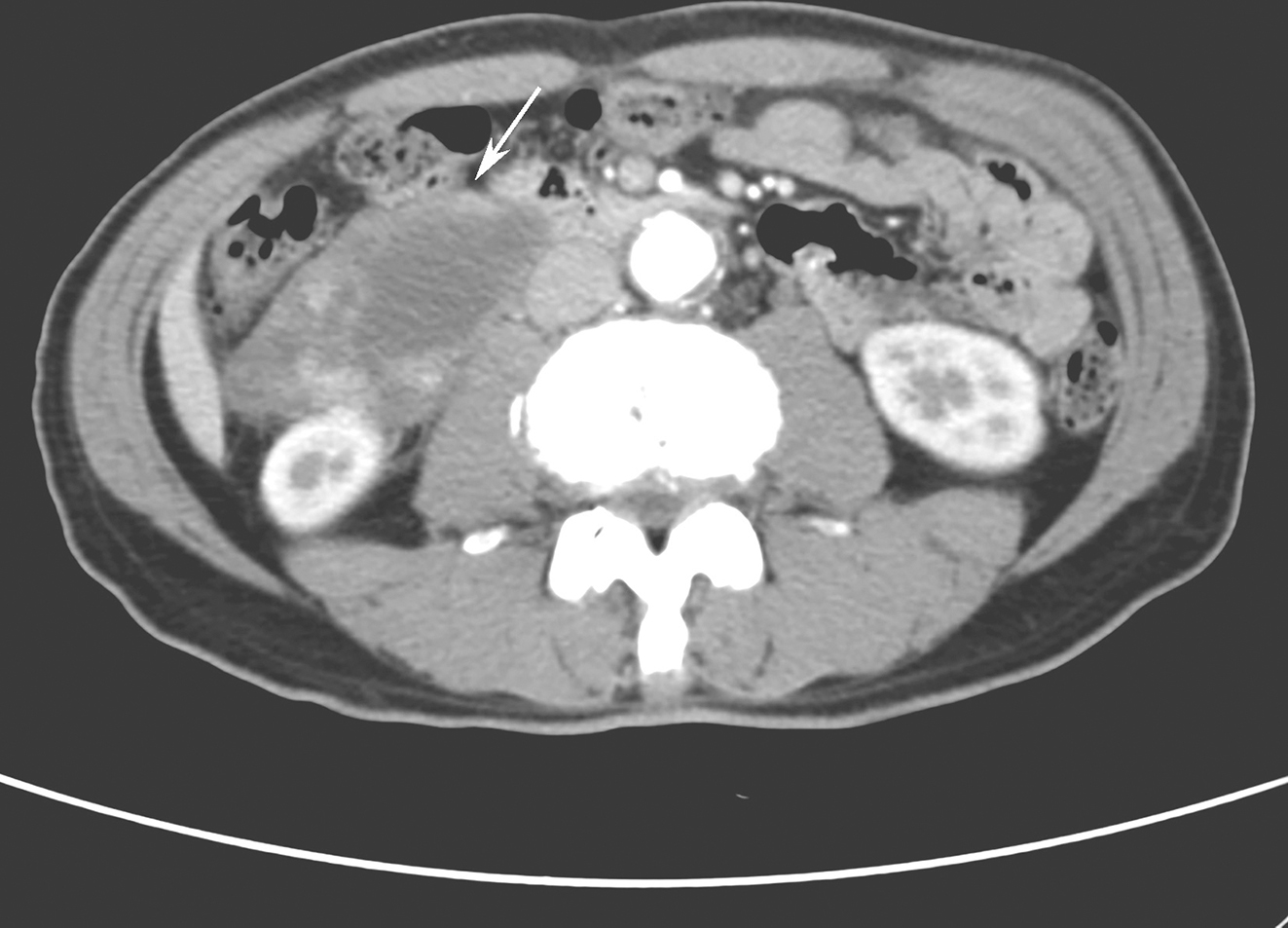
增强CT:胰腺体尾部体积增大,形态饱满,边缘平直,似呈腊肠样改变,周围可见少量渗出影,与左侧肾筋膜粘连,左侧肾筋膜囊增厚。增强扫描显示动脉期胰腺体尾部均匀强化,程度低于胰腺头颈部,静脉期持续渐进性强化,呈等密度改变,包绕脾静脉致脾静脉明显变窄,延时期体尾部强化程度高于头颈部,胰腺周围见多发直径小于7mm均匀强化结节。诊断意见:胰腺体尾部病变,伴周围渗出、淋巴结增大及脾静脉浸润,考虑肿瘤性病变可能,不除外自身免疫型胰腺炎。
磁共振平扫+增强:增强扫描显示胰体尾部、胰头部病变强化程度及节律近似,动脉期呈轻度不均匀强化,静脉期持续强化,信号强度与正常胰腺实质相近或略高,延迟期呈相对较高信号。胰管未见扩张。脾动脉、脾静脉局部被包绕,前者管壁僵硬,管腔局部轻度狭窄,后者局部显示中断。诊断意见:胰头部结节影,胰体尾部肿大,伴脾动静脉受累,多考虑自身免疫性胰腺炎可能(图1)。
图1 磁共振成像[弥散加权成像技术(diffusion weighted imaging,DWI)、增强早期+晚期、门脉期]
进一步完善检查:免疫球蛋白:IgM 0.46g/L(正常参考值:0.6~5.0g/L),IgA 2.51g/L,IgG 16.50g/L,IgG4 8.73g/L(正常参考值:0~2.01g/L);CA50 25.47U/mL(正常参考值:0~25U/mL);抗核抗体(核颗粒+核均质1∶100);抗髓过氧化物酶抗体IgG阴性;抗蛋白酶3抗体IgG阴性;抗线粒体抗体阴性;抗肝细胞溶质抗原1型抗体阴性;抗平滑肌抗体阴性;抗肝-肾微粒体抗体(1)阴性;nRNP/Sm阴性;Jo-(1)阴性;核小体阴性;SS-A阴性;SS-B阴性;SCL-(70)阴性;sm阴性;抗双链DNA(免疫印迹)阴性;抗着丝点抗体阴性;组蛋白阴性;核糖体P蛋白阴性;Ro-52阴性;心磷脂抗体阴性;抗蛋白酶3抗体IgG阴性;抗髓过氧化物酶抗体IgG阴性;抗RA33抗体15.90U/mL(正常参考值:0~20U/mL);抗环瓜氨酸肽0.5U/mL(正常参考值:0~5U/mL)。CT引导下胰腺穿刺病理:送检胰腺组织正常腺泡结构消失,残存导管上皮未见异型,间质弥漫炎细胞浸润伴纤维化,浸润炎细胞以浆细胞为主,符合IG4相关的自身免疫性疾病。免疫组化:CK上皮+,CgA胰岛+、Syn胰岛+、CD56胰岛+、Ki67 少量炎细胞 +、CD38 浆细胞+、CD138浆细胞 +、IgG4(+)、IgG(+),IgG4/IgG>40%,IgG4>10个。磁共振全身类PET成像未见胰腺外组织脏器累及。
6.最终诊疗思维过程
影像学表现在自身免疫性胰腺炎(autoimmune pancreatitis,AIP)的诊断中占有至关重要的位置。该病的影像学特点为胰腺呈弥漫性、局限性或局灶性肿大,典型者为“腊肠样”改变,部分不典型病理可出现局部肿块;主胰管弥漫性变细或局限性狭窄,病变累及胆总管下段时可造成局部呈陡然向心性狭窄;由于胰周积液、炎症或脂肪组织纤维化而出现胰周“鞘膜”征,增强时表现为动脉期密度略低,延迟期均匀强化。事实上,部分AIP的诊断与放射科医师的典型描述和有价值的提示密不可分。诊断AIP的标准还应包括IgG4水平及组织学证据。Ⅰ型AIP即IgG4相关性AIP,又称淋巴浆细胞硬化性胰腺炎(LPSP),病理表现:①大量浆细胞和淋巴细胞浸润,其中浆细胞每高倍视野可见大于10个IgG4阳性细胞,且IgG4/IgG大于40%;②独特的席纹状或漩涡状纤维化;③静脉周围淋巴细胞和浆细胞浸润导致闭塞性静脉炎。Ⅱ型AIP属非IgG4相关性胰腺炎,临床特征为胰腺体积增大,组织学无或极少见IgG4阳性浆细胞。血清IgG4>1350mg/L作为诊断的最佳截断值,其敏感性和特异性分别为97.0%和79.6%。此外,还应行全身PET扫描,明确是否累及胰腺外组织器官。
7.最终诊断
①自身免疫性胰腺炎Ⅰ型;②高血压;③2型糖尿病。
8.后续治疗方案
给予泼尼松治疗,初始剂量为30mg/d,疗程3~4周,以每1~2周减量2.5~5mg的速度逐渐减量,至每日5mg转为维持治疗,总疗程可达3年。
9.后续随访
治疗1个月后,磁共振检查与之前对比,提示胰头部结节影,胰体尾部肿大,范围较前缩小。
二、疾病诊疗难点
AIP的临床表现缺乏特异性,影像学描述提示该疾病的作用相当重要。AIP的超声表现为低回声胰腺实质内可见散在高回声区域,主胰管不规则狭窄,节段性病变通常表现为肿块型病灶,与胰腺癌的鉴别困难。对于难以鉴别的病例,可在服药2周后,通过血清学及影像学检查评估疗效,若疗效不佳,应将胰腺癌重新纳入考虑范围。
三、疾病知识回顾
AIP被认为是一种IgG4相关性系统性疾病,最早是由Yoshida等在1995年提出的,之后AIP及与其发病机制相类似的疾病逐渐被确立为一种独特的疾病谱。IgG4相关性消化疾病多数以AIP为基础病变,同时可伴有胆管、胆囊、肝门区等受累,其相关疾病包括AIP、IgG4相关性硬化性胆管炎(IgG4-sclerosing cholangitis,IgG4-SC)、IgG4相关性涎腺炎(IgG4-associated sialadenitis,IgG4-AS)、IgG4相关性自身免疫性肝炎(IgG4 associated autoimmune hepatitis,IgG4-AIH)。由于IgG4阳性浆细胞和淋巴细胞大量浸润伴随着纤维化,可同时或不同时发生弥漫性或局灶性器官肿大、包块形成或小结节性损害。AIP最常见或首发的症状多为阻塞性黄疸,多表现为波动性黄疸,同时可伴有腹痛或背部放射性痛、体重减轻或厌食等。糖尿病是较常见的并发症,尤其好发于Ⅱ型AIP,多伴有轻度至中度外分泌功能损伤。胰腺外表现有涎腺或泪腺肿大,因腹膜后纤维化或间质性肾炎、肾积水致腰痛,因肺部病灶致呼吸道症状等。
影像学表现:①CT:胰腺弥漫性肿大以及胰管轮廓消失是AIP的典型影像学表现。在T1加权成像上,受累的胰腺与肝脏相比,信号降低,同时由于纤维炎性病变累及胰周脂肪组织,其在CT上呈低密度影,而在T2加权成像上呈低信号影,包裹胰腺。②超声:低回声胰腺实质内可见散在高回声区域;主胰管不规则的狭窄(管腔直径<3mm)也是AlP的特征;节段性病变,通常表现为肿块型病灶,与胰腺癌的鉴别困难。
病理表现:Ⅰ型AIP即IgG4相关性AIP,又称LPSP:①大量浆细胞和淋巴细胞浸润,其中浆细胞每高倍视野可见大于10个IgG4阳性细胞,且IgG4/IgG大于40%;②独特的席纹状或漩涡状纤维化;③静脉周围的淋巴细胞和浆细胞浸润导致的闭塞性静脉炎。Ⅱ型AIP属非IgG4相关性胰腺炎,临床特征为胰腺体积增大,组织学无或极少IgG4阳性浆细胞。血清IgG4>1350mg/L作为诊断的最佳截断值,其敏感性和特异性分别为97.0%和79.6%。
四、参考文献
[1] 朱晓斐,邹多武. IgG4相关性消化疾病的研究进展. 中国胰腺疾病杂志,2014,14:57-61.
[2] 钱家鸣. 消化内科学. 2版. 北京:人民卫生出版社,2014.
专家点评
该病例根据患者生化指标以及入院腹部彩超结果拟定下一步辅助检查,进一步行磁共振及CT检查,提示自身免疫性胰腺炎可能,再进一步行自身抗体及IgG4检查,最后明确诊断,诊断思路正确,及时确诊并给予相应治疗,对临床有一定指导价值。对于胰腺炎患者,应高度警惕自身免疫性胰腺炎的发生。
患者为中老年男性,以食欲不振、消瘦1个月余入院,临床症状缺乏特异性。作者首先进行多项辅助检查初步排查:根据辅助检查结合影像学胰腺弥漫性肿大特征,将初步诊断锁定在胰腺病变,按照这个主要线索进一步分析和思考胰腺占位的性质是胰腺癌还是有其他原因,如常见的慢性胰腺炎,少见的胰腺结核等;之后根据诊断思路进行了一系列相关检查,如CT、MRI、MRCP、胰腺组织穿刺病理、免疫球蛋白、自身抗体、IgG4等,对上述疾病进行鉴别诊断,重点是胰腺癌的排查;最后综合分析得出了自身免疫性胰腺炎的初步诊断,并给予泼尼松治疗,在治疗1个月后复查MRI,发现胰头部结节影及胰体尾部肿大范围较前明显缩小。激素治疗反应进一步支持了原有诊断。这时自身免疫性胰腺炎Ⅰ型的最终诊断终于尘埃落定。
该病例总体对病变的分析比较到位,需完善的相关检查目的明确,但是对病情的总体评估不全面,对胰腺内外分泌功能评价不全,对糖尿病与本病的关系无探讨;治疗时除了以激素治疗为主导外,应注重细节的处理,如血糖的监控、胰酶的补充等;治疗后随访时间过短。
AIP是由自身免疫介导,以梗阻性黄疸、胰腺弥漫性肿大、胰管不规则狭窄、淋巴浆细胞浸润并纤维化为特征,激素治疗敏感的一种特殊类型慢性胰腺炎,可伴有胰外器官受累表现,好发于中老年人,以男性为多见。随着人们对该病的认识,其诊断率明显提高。AIP上一般缺乏急性胰腺炎的典型临床症状,症状轻微而胰腺形态学改变明显,有多种自身抗体存在,IgG4升高、球蛋白水平高,对激素治疗具有良好的反应性。对于AIP,从影像学、血清学、组织学和胰外损伤等方面综合考虑,并进行认真鉴别诊断,做出正确诊断应该不难,其中影像学表现占有主要地位,包括CT、MRI、EUS等提示胰腺弥漫性肿大。当发现胰腺特殊的影像学特点,应有诊断该病的敏锐性;除影像学外,病程的自限性以及治疗的效果对诊断也非常重要,有助于鉴别诊断。除外胰腺癌是诊断的难点,临床上,因胰腺肿大被误诊为胰头癌而进行胰十二指肠切除术或剖腹探查的情况时有发生。AIP常可累及胰外器官,加之激素治疗时间长,故在治疗过程中的疗效观察及不良反应监测极为重要。
系统性疾病累及消化道的病例很多,由于累及脏器多种多样,临床表现各异,缺乏敏感性和特异性高的抗体,临床诊断较难。因此,提高临床医师对AIP的认识和重视程度,可以避免误诊和漏诊。本病例的展示对临床指导价值较大。
点评专家:王江滨、王学红
知识来源
人卫知识数字服务体系
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号



 会员登录
会员登录

