四类罕见腹膜后肿瘤个案 背后有故事
以下列举四类笔者收治的罕见腹膜后肿瘤个案,希望以点代面,经验交流和总结。
(一)罕见的腹膜后促纤维增生性小圆细胞瘤个案
患儿:女,5岁。因阵发性腹痛3个月,加重2天,发现腹部包块1天入院。3个月前出现无明显诱因腹痛,当地对症治疗后缓解,未进一步检查。此后腹痛反复发作,入院2天前腹痛再次出现,疼痛较明显,不能忍受,次日到当地医院检查,B 超发现腹腔包块,遂就诊我院。体检:一般情况可,腹部稍膨隆,无腹壁静脉曲张,中上腹扪及约6cm×6cm大小包块,边界欠清,质地中等,基底固定,活动度差,无明显波动感,轻压痛,无肌紧张和反跳痛,无血管源性搏动。
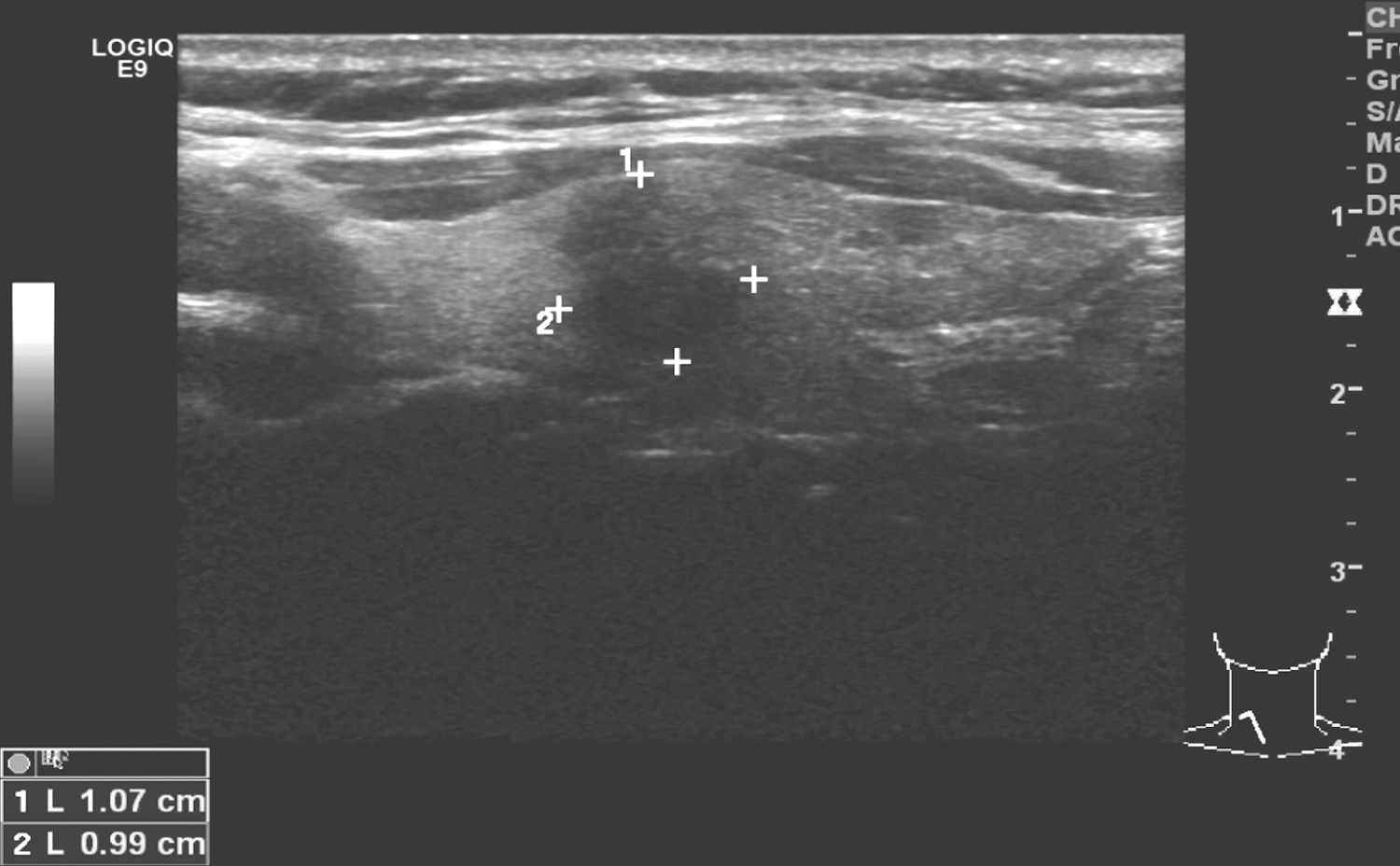
入院后血常规示:白细胞26.21 ×10 9/L,中性粒细胞百分比0.88;AFP:0.63ng/ml;尿VMA:21.49mg/24h;骨髓细胞学:刺激性骨髓象;彩色多普勒超声提示:右中上腹可探及一欠均质中等偏强异常回声肿块,大小约6.5cm×6.2cm×5.8cm,CDFI 于肿块内可探及较丰富的血流信号显示,该肿块与右肾紧贴,分界欠清晰,右肾位于肿块的前上方偏内侧。64 排增强CT示:右侧腹膜后肾脏后方见一形态欠规则的囊实性占位性病灶,上缘约平腰1 椎体水平,下缘达腰5 椎体上缘水平,大小约为64.4mm×67.1mm×42.4mm,增强后病灶实性部分强化,囊性部分无明显强化。右侧肾脏明显受推移向前方移位,双侧肾下极于腹中线相连,致双侧肾轴有旋转。腹膜后及腹腔内未见明显淋巴结肿大征象。CTA 示:右侧肾动脉稍向前移位,肠系膜下动脉于马蹄肾后下方向上跨过连接的双肾下极后进入腹腔。CT 诊断:1﹒右侧腹膜后肾脏后方形态欠规则的囊实性占位性病灶,性质待定;2﹒马蹄肾畸形(图23‐5‐1)。
IVP示:右侧肾盂,肾盏受压向外侧移位,提示右侧腹膜后占位性病变:两侧肾轴失常;右侧输尿管未显影。
手术所见:取右侧肋缘下切口,逐层进腹,见右侧腹膜后有一大小约8cm×7cm×6cm包块,位于右肾深面,腔静脉的浅面,与右侧肾动、静脉紧贴,肾周淋巴结无肿大,腹主动脉旁淋巴结无肿大,肾脏呈马蹄状,血供正常,肾血管及输尿管正常。肿瘤包膜基本完整,与周围粘连严重,小心分离粘连后,完整切除肿块,未处理马蹄肾。病理所见:大体观肿块大小约7﹒0cm×5.5cm×5.0cm,包膜较完整,切面出血坏死明显。镜下示:所送组织坏死明显,可见大量呈巢团状分布的变性坏死的肿瘤细胞间大量变性坏死的促纤维基质间隔,瘤细胞呈小圆形,核深染,胞浆少,边界不清,核仁及核分裂象未见。纤维组织中可见较多成纤维细胞。免疫组化染色:S‐100(-),NSE(-),Nestin(-),Syn(-),Des(-),TdT(-),CD3(-),CD20(-),NF(-),CD99(-),Vim(-),CD56(+),WT1 灶性(+),Ki67 阳性细胞数5%。病理诊断:(腹膜后)促纤维增生性小圆细胞肿瘤(DSRCT)(图23‐5‐2)。
图23‐5‐1 腹膜后促纤维增生性小圆细胞瘤CT 表现
术后随访:患儿术后继续化疗,目前已完成三个疗程化疗,复查未见复发和转移。
讨论:促纤维增生性小圆细胞瘤(desmoplastic smal round cel tumor,DSRCT)1989年Gerald 和Rosail 首次报道本病,并于1991年正式命名,是一种近来发现的罕见高度恶性小细胞肿瘤。目前DSRCT 的组织起源仍不清楚,DSRCT 病变多发于腹部,CT 表现呈软组织团块或结节影,边界清或不清,病变体积较大时,内部会有低密度坏死区,偶有斑片状钙化。DSRCT 恶性度高,目前无特效的治疗措施,主要采用手术切除辅以化疗。但多数肿瘤在就诊时已难以彻底切除,放化疗效果亦不理想,仅部分病例对化疗有反应。本病例正在治疗中,远期效果还需进一步随访观察。
图23‐5‐2 病理检查结果
(二)罕见的腹膜后卵黄囊瘤个案
患儿:女,1岁。因腹胀1个月加重10日入院。1个月前家长发现患儿腹胀明显,无特殊不适,到当地医院就诊,CT 检查提示:腹膜后神经母细胞瘤可能。腹胀加重,到我院就诊。体检:一般情况可,皮肤黄染,腹部膨隆,右上腹们及约10cm×8cm×7cm大小包块,质地硬,基底固定,无明显压痛,无血管源性搏动。
入院血常规示:血常规:WBC:11.65 ×10 9/L,中性比例:0.42。肝肾功:总胆红素217μmol/L,结合胆红素143μmol/L;AFP:>36 300ng/ml;尿VMA:1.45mg/24h。彩色多普勒超声提示:肝内占位性病变,边界欠清,大小约12.7cm×10.7cm ×8.6cm,CDFI 于肿块内探及较丰富的血流信号显示,肿块挤压肝门,肝门胆管轻度扩张。64 排增强CT 示(图23‐5‐3):右侧腹膜后见巨大团块影,大小约116.9mm ×93.6mm ×114.0mm,呈跨中线生长,边界较清,密度欠均,增强后明显不均匀强化,胰头向下移位,与肿块分界不清,其体尾部向前移位,肝脏明显受压,肿块周围肝右叶密度欠均,余未见明显异常密度。腹膜后及盆腔未见明显肿大淋巴结影。诊断:右侧腹膜后巨大肿块,考虑为神经母细胞瘤可能。CTA:腹主动脉、肠系膜上动脉等多支受推移、包绕,门静脉主干、下腔静脉、左肾静脉、肝中静脉受包绕,右肾静脉与肿块关系密切。
治疗预后:行肿瘤穿刺活检术,术后病检示:腹膜后卵黄囊瘤。现患儿已完成了三个疗程笔者制定的个体化新辅助化疗,第三次化疗前患儿一般情况可,黄疸消退明显,检查结果示:肝肾功无异常;AFP:13.1ng/ml;彩色多普勒超声示:包块明显缩小,大小约6.1cm ×4.0cm ×2.8cm,边界尚清,内为欠均质强回声及中等偏低回声混杂,CDFI 于其内血流信号稀少,该肿块紧贴腹膜后血管,部分切面包绕腹腔干,部分切面紧贴肝脏。目前正等待手术时机。
讨论:该患儿诊断过程较为复杂,B 超提示为肝脏肿瘤,CT 提示为腹膜后神经母细胞瘤,临床主要考虑为肝脏肝母细胞瘤,病理检查最终确定为腹膜后卵黄囊瘤。原发腹膜后侵犯如此之广的包血管卵黄囊瘤,在临床较为罕见。该例患儿容易误诊误治,必须先行病理确诊以后再行化疗。由于肿瘤与周围组织血管浸润严重,很难Ⅰ期切除,先进行新辅助化疗。目前患儿化疗效果好,待肿瘤缩小到满意程度,与周围组织血管界限清楚后再进行Ⅱ期手术切除治疗。
(三)罕见腹膜后包绕血管畸胎瘤个案
患儿:女,10个月。因发现腹部包块1个月入院。患儿1个月前在当地医院行腹部B 超检查发现腹部包块,无特殊不适,入我院。体检:一般情况可,腹部稍膨隆,右上腹可扪及一包块,约7cm×6cm,边界不清,质地硬,基底固定,活动度差,无明显波动感,无明显压痛,无血管源性搏动。
图23‐5‐3 腹膜后卵黄囊瘤CT 表现
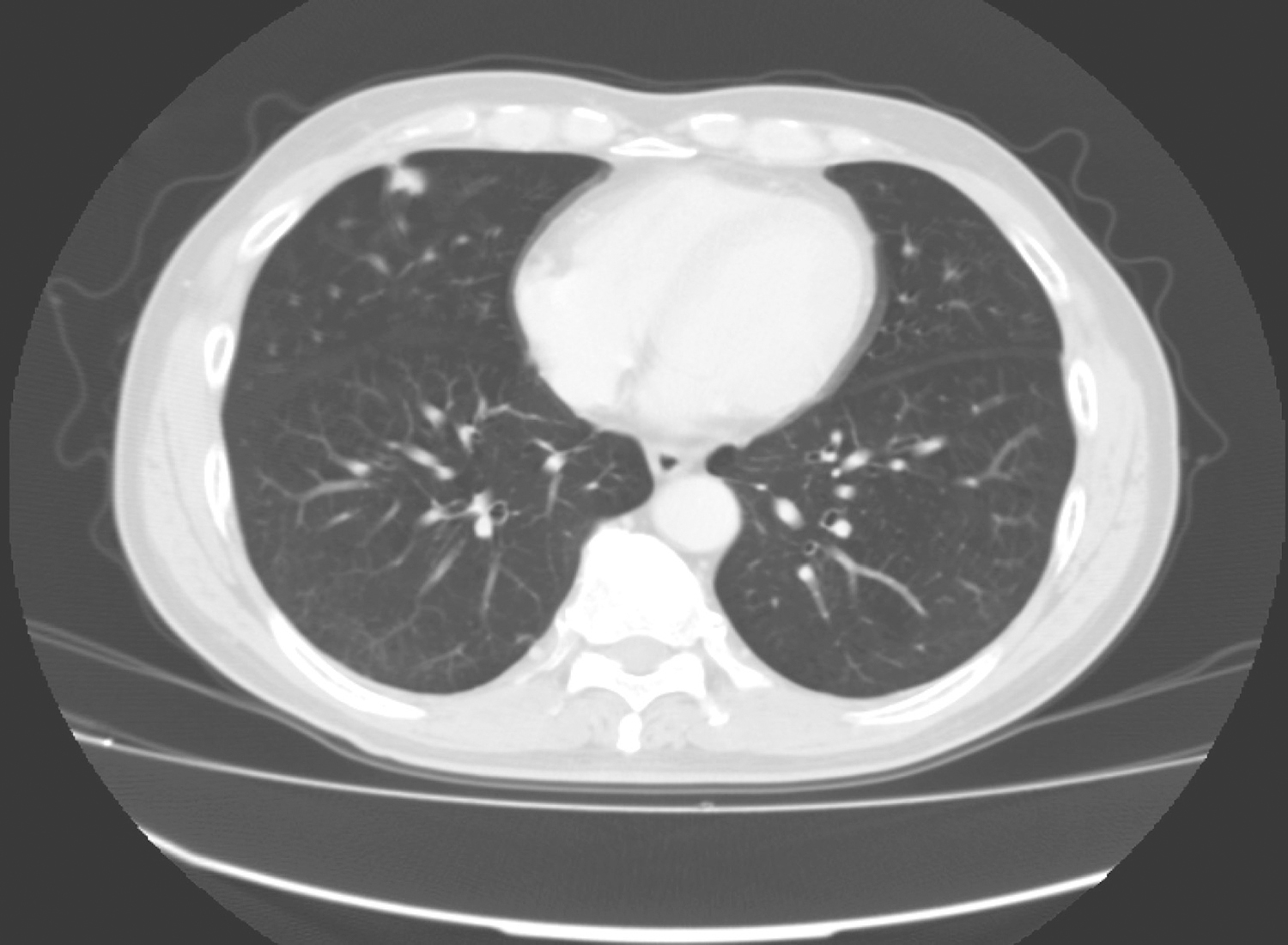
入院检查:血常规:WBC:12.64 ×10 9/L;AFP:8.2ng/L;64 排CT 增强示(图23‐5‐4):右侧腹膜后见一巨大形态欠规则混杂密度占位性肿块,上缘平第二肝门层面,下缘达右髂骨上缘水平,向前部分层面达腹前壁,向后与右肾相邻,向左部分达腹中线,其内见液性密度及脂肪密度。右肾受推移向下向外移位。增强后腹膜后未见明确淋巴结肿大征象。下腔静脉被推挤移位,部分段被包绕于瘤体中。诊断意见:右侧腹膜后占位性肿块,考虑畸胎瘤;下腔静脉被推移包绕。MRI 增强示:肝肾隐窝见巨大囊实性团块影,肿块大小约63.9mm×55.5mm×82.1mm,边界清楚。下腔静脉被瘤体推移向右,向上移位,并被包绕于瘤体中。右肾动脉受压向下移位,右肾静脉向后、向上移位,肠系膜上静脉及其主要分支向左向前移位。诊断意见:肝肾隐窝含脂肪包块,考虑畸胎瘤,邻近脏器及血管受压改变,下腔静脉被包绕。
术中所见(图23‐5‐5):选择右侧腹肋缘下横切口,逐层进入腹腔,探查肿瘤后切开肿瘤表面后腹膜暴露出肿瘤。可见肿瘤位于右侧腹膜后,大小约9cm ×6cm ×5cm,呈囊实混合性,包膜完整,瘤体呈哑铃型,下腔静脉及其属支,左、右肾静脉均不同程度嵌入瘤体内。仔细分离被肿瘤包绕的下腔静脉和左、右肾静脉与肿瘤间粘连;剥离肿瘤与肝、肾及腹腔壁层后方肌肉间粘连;完整切除肿瘤。病理诊断:右侧腹膜后良性畸胎瘤。术后腹部彩超示:下腔静脉,左、右肾动静脉血流无明显异常。患儿目前术后随访一年,未见复发。
图23‐5‐4 腹膜后包绕血管畸胎瘤CT 表现 A﹒腹主动脉;B﹒下腔静脉
图23‐5‐5 腹膜后包绕血管畸胎瘤的术中所见 A﹒箭头所示为剥离手术中的被推挤包绕的下腔静脉;B﹒箭头所示为部分剥离出的下腔静脉嵌入瘤体中的上部分;C﹒箭头所示为部分剥离出的下腔静脉嵌入瘤体中的下部分;D﹒箭头所示为完全剥离出的已严重变形的下腔静脉
讨论:腹膜后畸胎瘤在临床并不少见,但该例患儿有其特殊之处,下腔静脉与左、右肾静脉均不同程度包埋于瘤体中,下腔静脉明显受压变形,瘤体上端表面可见一凹陷,下腔静脉就从凹陷处包埋进去,对凹陷处的分离应倍加小心,应考虑到血管嵌入,因嵌入的血管常被压扁,肉眼下与筋膜难以区分,术中易把血管当成受牵拉的筋膜而被误切,因此可以从瘤体外沿正常血管路径向瘤体内追寻。手术切除是治疗良性畸胎瘤唯一有效的治疗方法,且多数学者主张越早越好。腹膜后包血管畸胎瘤一般位置较深,肿瘤体积较大,手术视野暴露不好,各种正常解剖结构移位,手术时应有足够大的手术切口,尽可能在直视下分离瘤体与血管粘连。分离血管时应小心,避免过分牵拉血管,引起血管损伤和出血。术前良好的CT、MRI、IVP 等影像学检查,对了解包块与下腔静脉、腹主动脉、肾动静脉及脾动静脉、以及与输尿管的关系,对做到手术时心中有数有很大的帮助。
(四)以腹股沟包块为首发表现的腹膜后神经母细胞瘤个案
患儿:女,2岁。因发现右侧腹股沟包块1个月,伴右下肢肿胀7天入院。1个月前家属发现右侧腹股沟包块,包块约花生大小,质地硬,有压痛,进行性增大,到当地医院对症处理无效,7天前患儿出现右腿疼痛,不愿下地活动,包块进行性增大,遂转来我院。入院后查体:右侧腹股沟区扪及大小不一肿大淋巴结多枚,已融合成团,质地中等,基底固定,活动度差,无明显波动感,有明显压痛,右下肢肿胀明显。
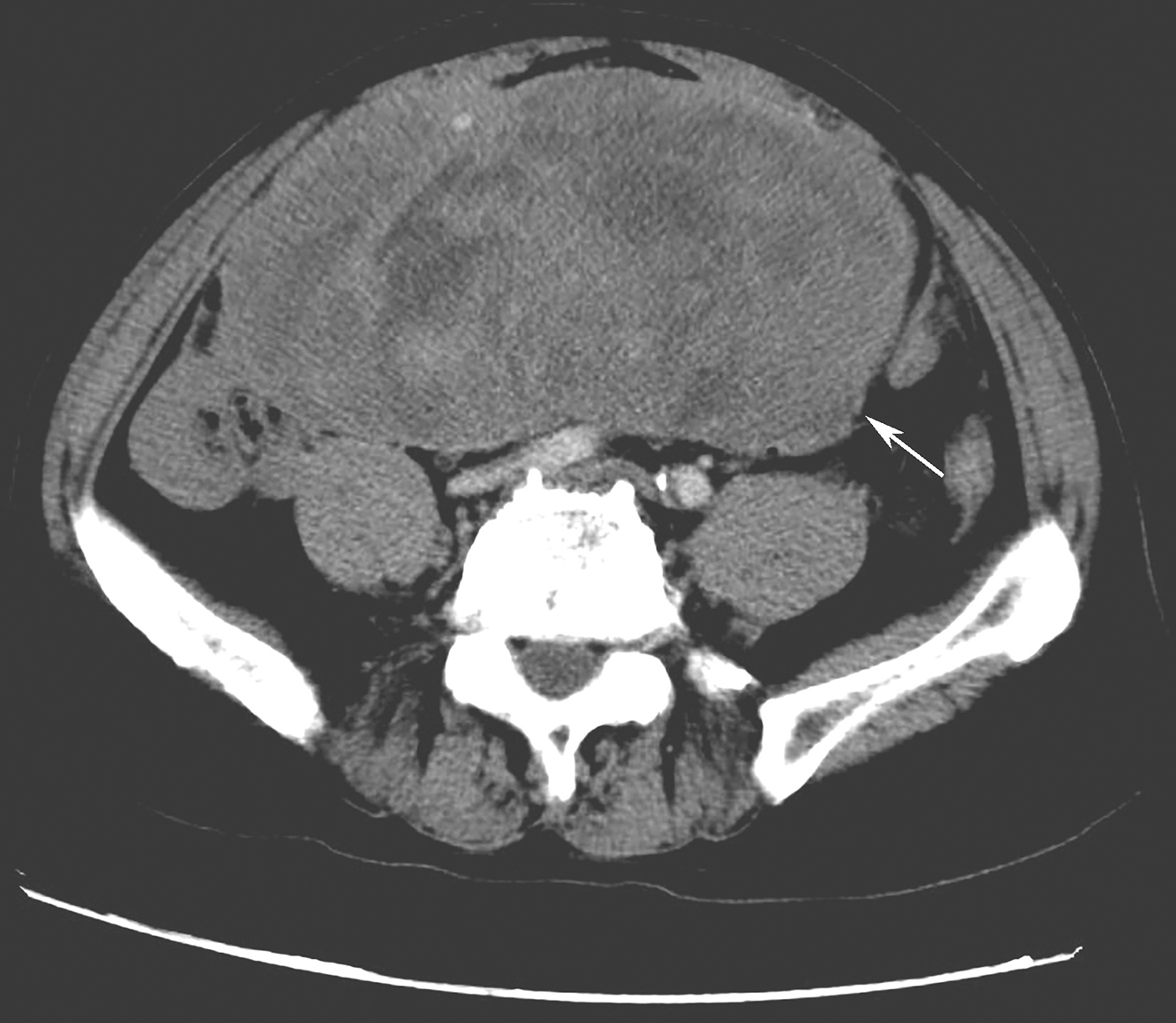
入院检查:血常规无明显异常;肝肾功:乳酸脱氢酶:2477.0U/L,余无异常;骨髓象显示:幼淋比例偏高占4.5%;彩色多普勒超声示:右腹股沟区淋巴结病变,其内未见明显液化。腹部淋巴结病变,以右下腹明显,其内未见明显液化。64 排增强CT 示(图23‐5‐6):腹膜后见多发大小不等结节样软组织影融合成团块样改变,其上缘约平右侧肾静脉入下腔静脉处(即腰2 椎体上缘水平),沿脊柱、腹主动脉、右侧髂总、髂内外动脉向下,达右侧腹股沟区域,该肿块与右侧腰大肌分界欠清,膀胱受压向左侧移位,左、右侧腹股沟区见多发结节样软组织影。右侧股骨上段骨质破坏,且见放射状骨针形成,围绕右侧股骨上段见软组织肿块影。CTA 示:腹主动脉、右侧肾静脉、髂动脉、右侧髂内外动脉均部分被肿块包绕推移,肿块上段节段下腔静脉受压变窄,于约平腰3 椎体水平以下下腔静脉未见明显显示。影像诊断:考虑神经源性肿瘤伴骨、淋巴结转移可能。
图23‐5‐6 以腹股沟包块为首发表现的腹膜后神经母细胞瘤的CT 表现
手术:进行右侧腹股沟区淋巴结切取活检术,术后病理诊断:(右腹股沟)淋巴结转移性神经母细胞瘤(图23‐5‐7)。
图23‐5‐7 以腹股沟包块为首发表现的腹膜后神经母细胞瘤的病理检查所见
治疗预后:患儿活检术后积极进行笔者制定的个体化方案化疗,5个疗程后复查64排增强CT 示(图23‐5‐8):腹膜后神经母细胞瘤化疗后复查(与化疗前相比较):腹膜后原多发大小不等结节样软组织影不见显示,仅于右侧肾上腺区见少许斑点状高密度钙化影,沿右侧髂内、外动脉周围原软组织肿块影明显缩小,右侧腹股沟区仍见软组织肿块影,右侧股骨中近段骨质破坏仍存在。第7个疗程化疗中同时针对右侧股骨残余病灶进行了一次高强度聚焦超声刀(HIFU)治疗,术后患儿恢复好,目前正在进行术后化疗中,继续随访观察疗效。
图23‐5‐8 以腹股沟包块为首发表现的腹膜后神经母细胞瘤化疗后的CT 表现
讨论:本例患儿首先以腹股沟区淋巴结肿大为首发症状,检查发现患儿腹膜后、盆腔、腹股沟区淋巴结和右股骨都存在巨大的原发灶和转移灶。笔者根据患儿的体质、内脏功能、肿瘤分期和对化疗的反应不同制定个性化的化疗方案,该患儿术前新辅助化疗效果好,化疗后肿瘤体积缩小90%,残余肿瘤组织由于与周围组织、血管关系密切,手术难以切除肿瘤,遂采用HIFU 治疗,以达到消除局部肿瘤组织的目的。对于腹膜后一些较为复杂的肿瘤,治疗上应采用多种方法相结合,如:化疗,放疗,手术,免疫治疗,HIFU 治疗、介入治疗等,能达到更佳的治疗效果。HIFU 治疗作为一种新型无创手术治疗手段,在神经母细胞瘤等实体肿瘤的综合治疗中将逐渐起着重要的作用。
(王 珊)
参考文献
1.张金哲.现代小儿肿瘤外科学.第2版.北京:科学出版社,2009.
2.蒋彦永,罗成华.原发性腹膜后肿瘤外科学.北京:人民军医出版社,2006.
3.李圆,王珊,王江波,等.多药耐药基因转染骨髓造血细胞移植小鼠的安全性研究.中华实验外科杂志,2008,25(5):658‐660.
4.祁江,叶亮,谭祥云.原发性腹膜后恶性肿瘤的诊断和治疗.医学临床研究,2009,26(1):84‐86.
5.刘洲禄,肖元宏,陈迪祥,等.儿童腹膜后肿瘤累及重要血管的手术处理.临床小儿外科杂志,2008,7(6):12‐14,17.
6.徐敏,陈其民,吴晔,等.儿童腹膜后肿瘤累及血管的外科治疗.中华小儿外科杂志,2007,28(4):178‐180.
7.潘东亮,李汉忠,毛全宗,等.罕见腹膜后肿瘤2例报道并文献复习.中国临床医药研究杂志,2004,126:53‐55.
8.Wang S,Zhang J,Li C,et al.Application of high‐intensity focused ultrasound for the treatment of vascular anom alies:an experimental study in acockscomb model.Eur J Pediatr Surg,2008,18(5):328‐333.
9.Kim YS,Cha SJ,Choi YS,et al.Retroperitoneal desmoplastic smal round cel tumor:pediatric patient treated with multimodal therapy.World J Gastroenterol,2009,15(33):4212‐4214.
10.Yamamoto H,Yamaguchi H,Aishima S,et al.Inflammatory myofibroblastic tumor versus IgG4‐related scleros ing disease and inflammatory pseudotumor:a comparative clinicopathologic study.Am J Surg Pathol,2009,33(9):1330‐1340.
11.Singh RR,Govindarajan KK,Bowen C,et al.Retroperitoneal cystic lymphangioma:a rare presentation in child hood,treated laparoscopical y.J Laparoendosc Adv Surg Tech A,2009,19(2):249‐250.
12.Hunter CJ,Ford HR,Estrada JJ,et al.Alpha‐fetoprotein levels correlate with the pathologic grad and surgical outcomes of pediatric retroperitoneal teratomas.Pediatr Surg Int,2009,25(4):331‐336.
13.Leclair MD,Sarnacki S,Varlet F,et al.Minimal y‐invasive surgery in cancer children.Bul Cancer,2007,94(12):10870‐10890.
14.Kim JJ,Valdes SO,Kertesz NJ,et al.Isolated junctional tachycardia in a patient with pheoch romocytoma:an unusual presentation of an uncommon disease.Pediatr Cardiol,2008,29(5):986‐988.
来源:《小儿腹部外科学》
作者:王 果 冯杰雄
参编:王维林 蔡威 郑珊 董蒨 夏慧敏
页码:564-572
出版:人民卫生出版社
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

