一例自身免疫性肝病合并炎性肠病诊治经验分享
41岁女性,反复皮肤、巩膜黄染10年,腹痛、腹泻7年,加重伴发热5天,病因到底是什么?
一、病例介绍
1.患者基本情况
患者:女性,41岁。
入院时间:2010年6月23日。
主诉:反复皮肤、巩膜黄染10年,腹痛、腹泻7年,加重伴发热5天。
现病史:10年前患者因黄疸于外院行肝脏穿刺,病理诊断为“原发性胆汁性肝硬化”,7年前因腹痛、腹泻,肠镜检查诊断为“溃疡性结肠炎”(图1),予保肝利胆以及柳氮磺胺吡啶、5-氨基水杨酸等抗炎治疗,症状迁延。4个月前,患者因“子宫肌瘤、右侧卵巢囊肿”于当地医院行“子宫次全切除、右侧卵巢囊肿及附件切除术”,术后1个月出现直肠阴道瘘及直肠狭窄,于外院置入直肠支架,腹痛改善。10天前,患者直肠支架脱落,腹痛加重,皮肤、巩膜黄染明显加重,并间断发热,遂收住入院进一步诊治。
既往史:8年前因胆囊结石行“胆囊切除术”,4年前行“ERCP+胆总管取石术”,其他无特殊。
个人史:否认肝炎、结核或其他传染病史,否认过敏史;否认饮酒史,否认滥用药物史;否认其他手术史,否认输血史。
家族史:否认高血压、糖尿病等家族史,家族中无类似疾病患者。
图1 2004年结肠镜示结肠黏膜散在充血、糜烂,血管纹理欠清
2.入院查体
3.入院辅助检查
(1)实验室检查:
(2)立位腹部X线平片:
(3)全腹部CT平扫+增强:
图2 立位腹部X线平片示肠梗阻
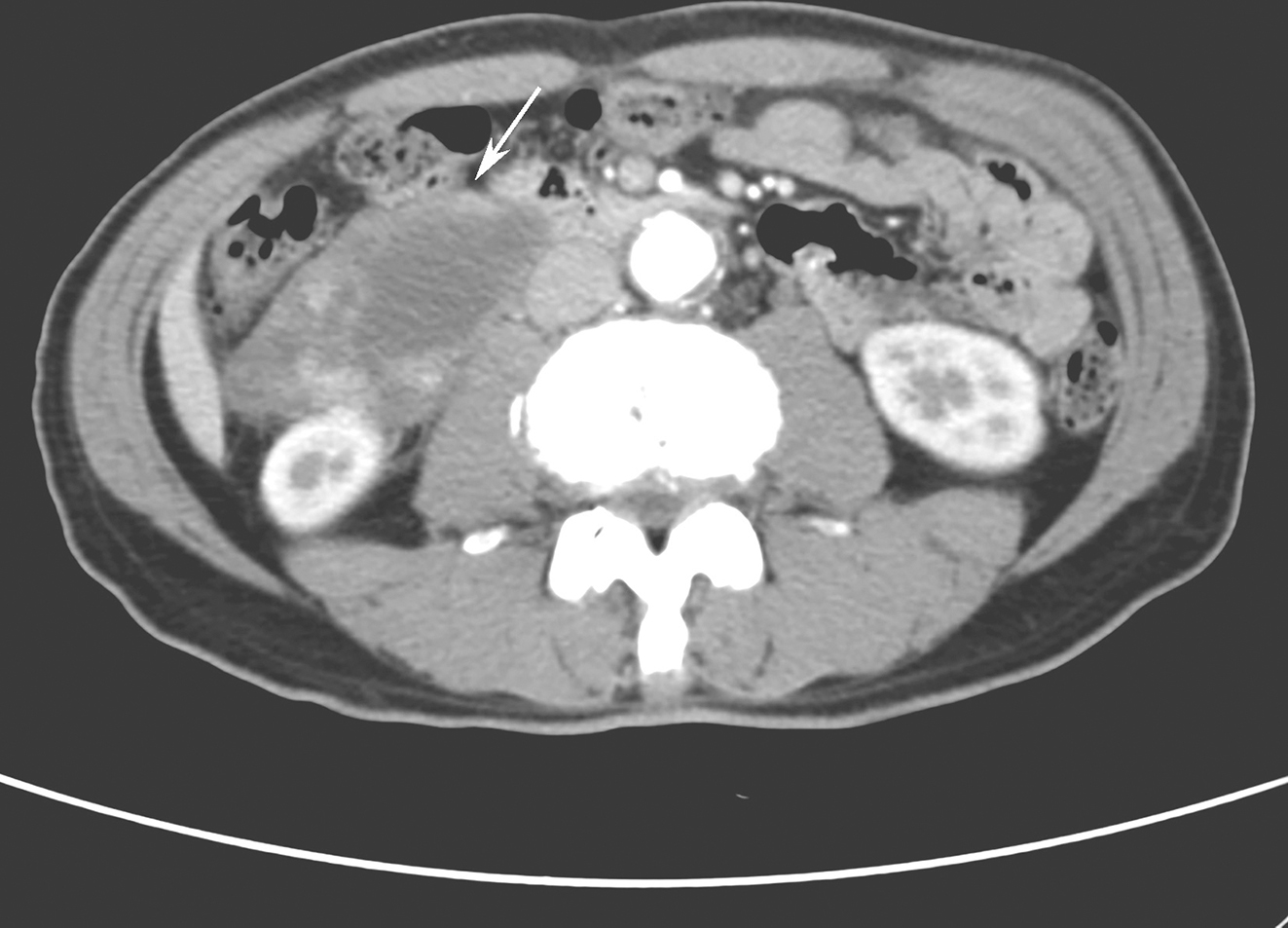
图3 全腹部CT平扫及增强
a. CT平扫示脾脏明显大;b、c. CT平扫及增强示升结肠局部管壁水肿明显,增强后强化,管腔狭窄
4.初步诊断思维过程
(1)入院时病情总结及诊断思路:明确。
(2)入院初步诊断:
原发性胆汁性肝硬化
结肠克罗恩病待排除
5.后续检查
(1)MRCP示胆囊切除术后,肝内外胆管弥漫性节段性狭窄及扩张,胆总管下段多发结石,脾明显大(图4)。内镜下逆行胆管造影(endoscopic retrograde cholangiography,ERC)显示肝内外胆管弥漫性节段性狭窄及扩张,胆总管多发结石(图5),行内镜下取石治疗术后黄疸明显减退,2天后患者再次出现阵发性脐周剧烈绞痛,并进行性加重,转外科手术治疗。
图4 MRCP示胆囊切除术后,肝内外胆管弥漫性节段性狭窄及扩张,符合原发性硬化性胆管炎诊断,胆总管下段多发结石
图5 内镜下逆行胆管造影示肝内外胆管弥漫性节段性狭窄及扩张,符合原发性硬化性胆管炎诊断,胆总管下段多发结石
术中发现下腹部盆腔及右上腹均有明显粘连;肝脏结节性硬化改变,于左外叶边缘切取小块留送病理学检查;脾脏体积大;结肠、盲肠及小肠扩张,肠壁增厚、水肿,升结肠近肝曲处触及质硬肿块,肠腔狭窄梗阻,局部浆膜受侵,远端横结肠、乙状结肠及直肠上段肠壁厚,僵硬,行“全结肠切除+回肠造瘘”术。切除结肠大体病理示肠壁炎症重,周围结缔组织增生明显,升结肠近肝曲病变致肠腔狭窄梗阻,其远端扪及一大小约2.0cm×1.5cm×1.5cm肿块,结肠黏膜见糜烂溃疡改变。
(2)进一步检查:组织病理示全结肠切除标本,结肠腺癌Ⅱ级,肿块2处,一处为缩窄型,大小4cm×3cm×1.5cm,浸润全层达浆膜外结缔纤维组织;另一处为隆起型,大小2cm×1.5cm×1cm,癌组织浸润黏膜下层紧邻浅肌层,上下切缘未见癌累及,肠周淋巴结见癌转移(1/10枚),周围结肠黏膜平坦,皱襞消失,散在大小不等的扁平隆起病灶,大小直径0.5~1.0cm,镜下见结肠黏膜层明显萎缩,伴多量淋巴细胞、浆细胞及少量嗜酸性粒细胞浸润,黏膜肌层增生肥厚,黏膜下层见纤维组织及脂肪组织增生,符合溃疡性结肠炎晚期改变(图6、图7)。肝活检标本示小块肝组织局灶肝细胞水肿变性及淤胆,汇管区少量慢性炎细胞浸润,纤维结缔组织增生并有向周围肝组织伸入趋势,但未形成典型假小叶(图 8)。
图6 结肠组织HE染色示结肠黏膜层明显萎缩,伴多量淋巴细胞、浆细胞及少量嗜酸性粒细胞浸润,黏膜肌层增生肥厚,黏膜下层见纤维组织及脂肪组织增生,符合溃疡性结肠炎晚期改变(200×)
图7 结肠肿块组织HE染色示腺癌,癌组织浸润黏膜下层紧邻浅肌层(200×)
图8 肝活检标本HE染色示小块肝组织示局灶肝细胞水肿变性及淤胆,汇管区少量慢性炎细胞浸润,纤维结缔组织增生并有向周围肝组织伸入趋势,但未形成典型假小叶(200×)
6.最终诊疗思维过程
该患者曾经被诊断为原发性硬化性胆管炎并发肝硬化(PBC)及溃疡性结肠炎(UC)。病程中曾因胆管结石行ERCP检查及治疗,本次患者再次出现胆管结石,通过MRCP及ERCP否定了PBC的诊断,而肯定了原发性硬化性胆管炎(PSC)的诊断。因为患者出现结肠狭窄及直肠阴道瘘,必然会导致对UC诊断的质疑,而考虑有无克罗恩病的可能。通过手术探查推翻了质疑,肯定了UC的诊断,同时确认了结肠癌导致直肠狭窄和直肠阴道瘘。该患者的病情及诊治过程跌宕起伏,最终得以明确为PSC合并UC,在此基础上并发结肠癌。
7.最终诊断
原发性硬化性胆管炎并发肝硬化,脾功能亢进,溃疡性结肠炎并发结肠癌。
8.后续治疗方案
术后患者接受保肝利胆治疗。
9.后续随访
术后半年随访,患者病情控制好,体重增加5kg,后失访。
二、疾病诊疗难点
本文报道了一罕见病例,患者为中年女性,10年前诊断为PBC,7年前诊断为UC,因出现直肠阴道瘘,通过相关检查诊断为原发性硬化性胆管炎PSC,通过手术探查,确诊并发结肠癌。该患者曾被诊断为PBC及UC,PBC是否会发展为PSC?溃疡性结肠炎如何导致肠腔狭窄及梗阻?是否溃疡性UC的诊断不对,而是CD?炎性肠病并发结直肠癌(colorectal cancer,CRC)的可能性,以及UC合并PSC时CRC发生的可能性是否会增加?这些都是本例诊疗难点。
三、疾病知识回顾
1.PBC是否有可能发展为PSC
PBC发展为PSC病例非常罕见。Arun等报道1例中年妇女17年来一直诊断为PBC,临床和生化检查均表现为胆汁淤积表现,再次收住院后MRCP检查发现,胆总管呈明显的良性节段性狭窄及扩张,类似于串珠样表现,提示PSC的诊断。该患者此后接受了胆总管支架置入治疗,并增加了UDCA的服用剂量,症状明显改善,生化指标也逐渐好转。因此,PSC可能在早期甚至较长时间内不能被准确诊断,或诊断为PBC。
2.PBC及PSC与UC合并
PBC极少合并UC。有报道,1例女性患者因UC行直肠结肠切除术后,随访中诊断了PBC,提示PBC也可能会合并UC存在。一项瑞典研究囊括了1500例UC患者,发现5%的患者血清ALP高于正常范围,通过ERCP检查发现,其中85%患者诊断为PSC,而且男性全结肠炎患者PSC发生率更高。
3.PSC和胆管结石
该患者共两次因胆管结石接受ERCP取石治疗。PSC患者是否更易发生胆管结石?PSC是由免疫介导的系统性炎症性疾病,可逐渐出现胆管纤维化和节段性胆管狭窄。文献报道,23/41(56%)例PSC患者存在胆管结石,其中7/23(30%)在胆管造影时漏诊,而通过胆管镜确诊。
4.UC及UC-PSC患者并发CRC
Eaden的Meta分析发现,UC患者在病程10年、20年、30年时发生CRC的概率分别为2%、8%和18%。一项对723例匈牙利UC患者(男女之比为380∶343)的研究发现,UC进展为CRC的平均年龄是50.9(27~70)岁(UC病程:16.5±8.2年),比匈牙利散发的CRC患者早近15岁。UC病程10年、20年、30年CRC的发生率分别为0.6%(95%CI 0.2%~1.0%)、5.4%(95%CI 3.7%~7.1%)、12.6% (95%CI 7.0%~18.2%)。IBD病程较长的患者,CRC发生率增加,如果合并PSC,肠黏膜异型增生及癌变的可能性更大。韩国一项研究显示,韩国UC患者合并PSC的发生率低于西方国家,与白人相似的是,CRC发生率及死亡率均明显高于UC患者。一项为期长达32年(1977~2009年)的对1849例UC患者的随访研究中,21例(1.1%)UC合并PSC患者,诊断UC1~5年、10年后、15年后、20~25年后PSC发生率分别为0.71%、1.42%、2.59%、3.35%;随访中还发现,21例UC-PSC患者中,3例(14.3%)患者发生结直肠新生物,3例(14.3%)患者死于PSC相关并发症。UC-PSC患者CRC发生率及死亡率均明显高于UC患者(P=0.036)。总之,PSC合并UC患者CRC的发生率高于单纯UC患者。
四、参考文献
[1] ARUN JEEVAGAN. Overlap of primary biliary cirrhosis and primary sclerosing cholangitis-a rare coincidence or a new syndrome[J]. Int J Gen Med,2010,3:143-146.
[2] OHGE H,TAKESUE Y,YOKOYAMA T,et al. Progression of primary biliary cirrhosis after proctocolectomy for ulcerative colitis[J]. J Gastroenterol,2000,35(11):870-872.
[3] OLSSON R,DANIELSSON A,JARNEROT G,et al. Prevalence of primary sclerosing cholangitis in patients with ulcerative colitis[J]. Gastroenterology,1991,100:1319-1323.
[4] AWADALLAH NS,CHEN YK,PIRAKA C,et al. Is there a role for cholangioscopy in patients with primary sclerosing cholangitis[J]? Am J Gastroenterol,2006,101(2):284-291.
[5] LUKAS M. Inflammatory bowel disease as a risk factor for colorectal cancer[J]. Dig Dis,2010,28(4-5):619-624.
[6] LAKATOS L,MESTER G,Erdélyi Z,et al. Risk factors for ulcerative colitis associated colorectal cancers in a Hungarian cohort of ulcerative colitis patients[J]. Orv Hetil,2006,29;147(4):175-181.
[7] YE BD,YANG SK,BOO SJ,et al. Clinical characteristics of ulcerative colitis associated with primary sclerosing cholangitis in Korea[J]. Inflamm Bowel Dis,2011,17(9):1901-1906.
专家点评
PSC是一种以胆管进行性炎症、增生和纤维化为特征的慢性胆汁淤积性肝病,最终进展到胆汁性肝硬化,多数患者伴随有炎性肠病,ERCP及MRCP是诊断PSC的金标准。需要注意的是,该病临床表现差别极大,并发症多,诊断时应注意以并发症为首发症状的患者,有5%患者胆管造影正常而具有PSC的组织学变化,即所谓的小胆管PSC,因此,排除PSC需慎重。该病例虽然病史较长,病情也比较复杂,但总的临床思路清晰,鉴别诊断合理,确诊证据充分,资料齐全,对提高临床能力有较大意义。
该病例病史较长,病情复杂,作者抽丝剥茧,最终明确诊断为PSC合并UC,在此基础上并发结肠癌,是一例很不错的病例。不足之处,作者应对10年前的肝穿刺病理重新读片,或许会获得不一样的结论。
近年来逐步发现,UC易合并胆道系统的疾病。作者对UC和各种胆道系统的疾病做了回顾性分析,提示我们在发现PSC的同时应考虑是否存在UC的可能。UC患者如果存在肝功能损伤,也需要考虑胆道系统的疾病。在这个病例中,如果10年前发现胆道系统疾病的时候做肠镜检查,肠道或许已经有UC的表现。这是个很不错的病例,提示临床医师在给一个疾病做诊断的时候,需要考虑全身其他系统的情况。
点评专家:刘玉兰、沈锡中
知识来源
人卫知识数字服务体系
- 评价此内容
- 我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号


 会员登录
会员登录

