男48岁,直肠癌根治术后3年,化疗后肝转移
病例介绍
主诉
直肠癌根治术后3年,化疗后肝转移。
现病史
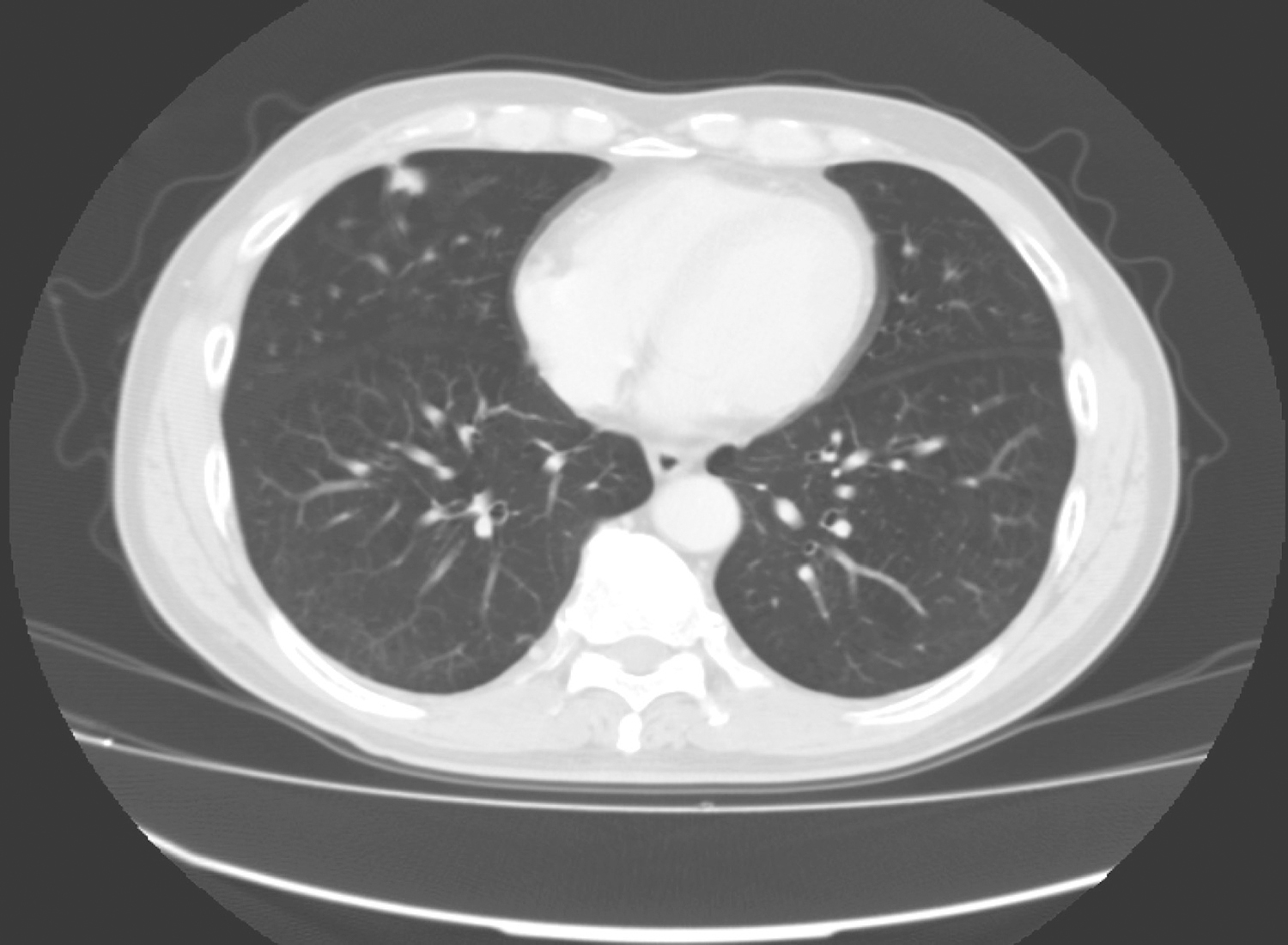
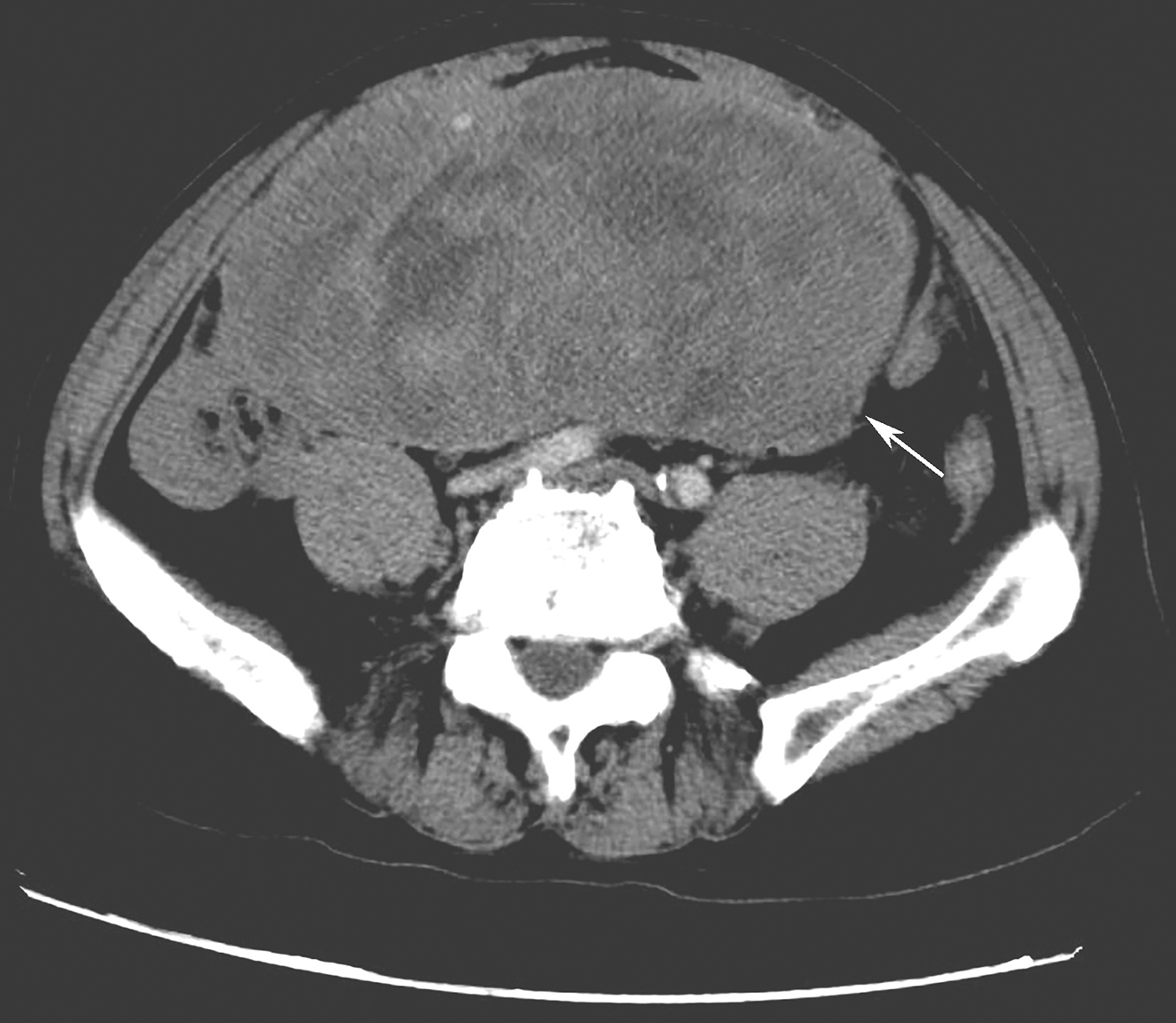
患者3年前因“直肠溃疡型癌”行经腹直肠癌根治术。术中见盆底腹膜反折处有3c m×4c m×2c m 的肿物,肿物距离肛门7c m。术后病理回报:(直肠)高分化腺癌,小部分为黏液腺癌侵及深肌层,大体溃疡型,体积为4c m×4c m×1c m,断端阴性。淋巴结未见转移:外膜面0/5,髂外动脉0/3,闭孔淋巴结0/2,直肠上动脉0/2,肠旁淋巴结0/1,肠系膜下动脉0/1,乙状结肠系膜中间0/4。术后予以L‐OHP+CF +5‐FU 化疗3周期、XELOX 方案化疗3周期,患者复查CT提示“肝转移”,拟行进一步诊治。
既往史
1985年患结核性脑膜炎,1998年行痔疮手术。否认高血压、冠心病、糖尿病等病史,否认肝炎、结核等传染病史。
家族史
无家族遗传病史。
个人史
生于原籍,无外地及疫区久居史。否认吸烟史,曾饮酒2年,白酒250g/天。现戒酒1年。
既往用药史
L‐OHP+CF+5‐FU 化疗3周期:
L‐OHP:200mg,d1;
CF:200mg,d1,d2;
5‐FU:3500mg,48小时泵入。
XELOX 方案化疗3周期:
L‐OHP:200mg,d1;
xeloda:3.0g,d1~14。
过敏史
否认食物、药物过敏史。
【体格检查】
一般状况:男性,48岁,发育正常,营养一般。神志清,查体合作。
生命体征:T 36﹒2℃;P 72次/分;R 21次/分;BP 120/80mmHg;
身高174c m;体重74kg;体表面积1.92m2;KPS 80分。
皮肤:全身皮肤黏膜无黄染,无皮下出血、皮疹,无肝掌及蜘蛛痣。全身浅表淋巴结未触及肿大。
五官:头颅无畸形,球结膜无水肿,巩膜无黄染,双侧瞳孔等大等圆,对光反应存在,无自发性眼震。耳鼻检查无异常。口唇无发绀,口腔轻度溃疡。咽无充血,扁桃体无肿大。
颈部:颈软,气管居中,甲状腺无肿大,无颈静脉怒张,未触及肿大淋巴结。
胸部:胸廓对称,无皮下气肿,胸骨无压痛,双侧呼吸动度对称,语颤正常,叩诊清音,双肺呼吸音清晰,未闻及干、湿性啰音。
心脏:心前区无隆起,心率72次/分,心律齐,心音有力,各瓣膜区未闻及病理性杂音。
腹部:未见瘀斑,无腹壁静脉曲张。腹肌不紧,无压痛、反跳痛。肝脾肋下未触及。无异常包块。移动性浊音阴性。肠鸣音正常。
四肢:脊柱、四肢无畸形,肌张力正常。双下肢无水肿。
神经系统:生理反射存在,双侧巴氏征阴性。脑膜刺激征阴性。
【辅助检查】
1﹒血常规 HGB 153g/L;WBC 7﹒97 ×109/L;ANC 4﹒53 ×109/L;PLT 223 ×109/L。
2﹒肝肾功能ALT 19U/L;AST 17U/L;TBIL 15﹒3μmol/L;Cr 97μmol/L;BUN 6﹒7mmol/L ↑。
3﹒肿瘤标志物CA72‐4 1﹒82μg/L;CA242 65﹒89μg/L ↑;CA 19‐9 76﹒41μg/L ↑;CEA 11﹒17μg/L ↑。
4﹒心电图正常,尿常规、便常规正常。
【入院诊断】
直肠癌术后化疗后肝转移
PS:高分化腺癌
CS:T2N0M0 ⅠB 期→Ⅳ期
【诊疗经过】
患者经入院检查及各项实验室检查,符合化疗标准。化疗方案为:伊立替康+5‐FU+恩度,给药方法如下:
伊立替康340mg iv d1
5‐FU 500mg 静脉推注d 1~2,5‐FU 1250mg,CI V 22h,d 1~2
CF 200mg iv d 1~2
血管内皮抑素15mg iv d1~14
辅助用药如下:
法莫替丁40mg iv d1~3
托烷司琼5mg iv d1~3
硫普罗宁200mg iv d1~3
庆大霉素48万I U +普鲁卡因0.24g+NS60ml 分次漱口
第2天,患者诉恶心,食欲差。给予甲氧氯普胺10mg+地西泮10mg +地塞米松5mg 肌内注射1次,止吐治疗。
第4天,患者仍诉恶心,呕吐,对症给予止吐三联好转,昨晚腹泻3次,予以洛哌丁胺口服后未再腹泻。
第5天,患者乏力食欲差,给予营养支持。
血常规测定示:HGB 153g/L;WBC 6﹒36 ×109/L;ANC 4﹒09 ×109/L;PLT 205 ×109/L。
第7天,患者诉胃部不适,对症给予如下治疗:
丙氨酰谷氨酰胺20mg + NS500 ml ivdrip qd
法莫替丁40mg + NS100ml ivdrip qd
奥美拉唑20mg po bid
第14天,患者体温正常,二便正常,复查血常规:HGB 131g/L;WBC 6﹒43 ×109/L;ANC 3﹒42 ×109/L;PLT 183 ×109/L。肝肾功能:ALT 30U/L;AST 11U/L;TBIL 7﹒5μmol/L;Cr 94μmol/L;BUN 3﹒4mmol/L。
患者顺利出院。嘱出院后定期复查血常规,按时返院治疗。
【出院诊断】
直肠癌术后化疗后肝转移
PS:高分化腺癌
CS:T2N0M0 ⅠB 期→Ⅳ期
病例特点与诊断要点
1﹒病史
中年男性患者,直肠癌根治术后3年,化疗后肝转移;术后病理回报:(直肠)高分化腺癌,小部分为黏液腺癌侵及深肌层,大体溃疡型,体积为4c m×4c m×1c m,断端阴性,淋巴结未见转移(0/18)。
2﹒查体
未见阳性体征。
3﹒辅助检查
(1)血常规基本正常。
(2)肝肾功能基本正常。
(3)肿瘤标志物部分异常升高:CA72‐4 1﹒82μg/L;CA242 65﹒89μg/L ↑;CA 19‐9 76﹒41μg/L ↑;CEA 11﹒17μg/L ↑。
(4)心电图正常,二便正常。
用药分析与药学监护
【用药分析】
患者术后证实为直肠高分化腺癌,术后行的L‐OHP、5‐FU 类药物为主的化疗6周期,目前出现肝转移,已进入晚期。从肝灶分布上看,由于分布弥散,暂不宜手术,治疗上以化疗为主,考虑以伊立替康为主的化疗方案。将伊立替康与De Gramont 方案联合,可以明显提高临床疗效,而且降低毒性。目前多主张采取双周疗法,可减少严重腹泻的发生,提高安全性。研究表明,对K‐ras 基因为野生型的结直肠癌患者化疗可联合西妥昔单抗。此患者经K‐ras 基因筛查,为突变型,不适用西妥昔单抗。拟行联合血管内皮抑素治疗。
1﹒FOLFIRI 方案的临床应用
多年以来,5‐氟尿嘧啶(5‐FU)和亚叶酸钙(CF)是仅有的治疗转移性结直肠癌的药物,有效率约20%~30%,中位生存期11~12个月。近年研发的药物(伊立替康和奥沙利铂)均与5‐FU 有协同作用,联合的化疗方案提高了治疗结直肠癌的有效率和生存期,FOLFOX 和FOLFI RI方案使中位生存期达到近20个月。靶向药物如贝伐单抗、西妥昔单抗的出现使晚期大肠癌的疗效得到进一步的提高。研究证实,IFL 方案联合贝伐单抗较IFL 方案疗效提高(有效率45%vs﹒35%,中位生存期20.3个月vs﹒15﹒6个月,PFS10.6个月vs﹒6﹒24个月)。转移性结直肠癌的患者2年生存率从25%升至30%~39%,总生存有了显著提高。
此患者已行K‐ras 基因筛查,为突变型,不适用西妥昔单抗联合用药,依据最新指南可联合抗VEGF 生物靶向药物,因该病例治疗时贝伐珠单抗国内尚未上市,故选用国产抗肿瘤新生血管药物重组人血管内皮抑素(恩度)治疗。该患者选用化疗方案为FOLFIRI +血管内皮抑素。
FOLFIRI 是伊立替康(CPT‐11)联合5‐氟尿嘧啶/甲酸四氢叶酸(5‐FU/CF)治疗转移性直肠癌的标准二线方案,伊立替康是细胞周期S 期特异性药物,是特异性DNA 拓扑异构酶抑制剂。5‐F U 为嘧啶类抗代谢药,在体内参与核苷酸的合成,阻断核苷酸的正常转化,从而抑制DNA 和RNA 的生物合成,也是细胞周期S 期特异性药物。两药联用可以在不同靶位抑制并杀灭肿瘤细胞。对于既往经奥沙利铂、羟喜树碱以及5‐FU 为主方案治疗失败的患者仍然具有一定的客观缓解率。在CPT‐11 和奥沙利铂治疗晚期大肠癌的两个大型临床研究N9741 和C89803 中,CPT‐11 联合静脉推注5‐FU(IFL 方案)所致的早期死亡事件明显增加,特别是在治疗的第3~4周。而由伊立替康与De Gramont 方案组成的双周方案(FOLFIRI 方案)安全性相对较好。随胆汁排出的CPT‐11 在肠腔形成活性物质SN‐38,导致腹泻,降低单次CPT‐11 的用量是防止严重腹泻的一个重要措施。CPT‐11 被羧酸酯酶转化为具有活性的SN‐38,后者又在葡萄糖醛酸转移酶(UGT1A1)作用下失去活性。研究显示UGT1A1 的遗传多态性与CPT‐11 的毒性有关。有报道研究者用CPT‐11 180mg/m2,5‐FU 425mg/m2 d1、2,q2w 治疗,发现Ⅲ~Ⅳ度腹泻仅6.3%,血液学毒性不明显,但其5‐FU 用量较小。
研究显示,FOLFIRI 方案安全性较好,多数患者能按预定计划足量、按时完成治疗,腹泻的发生比例不高,程度较轻,仅少数患者需要调整CPT‐11 剂量。用药前加强对患者宣教以及出现腹泻后及时处理仍然是必需和关键的措施。
5‐FU 在体内先转变为5‐氟‐2‐脱氧尿嘧啶核苷酸,后者抑制胸腺嘧啶核苷酸合成酶,阻断脱氧尿嘧啶核苷酸转变为脱氧胸腺嘧啶核苷酸,从而抑制DNA的生物合成。此外,通过阻止尿嘧啶和乳清酸掺入RNA,达到抑制RNA 合成的作用。5‐FU 持续滴注如De Gramont 方案和AI O 方案的有效率分别为33%和44%,比静脉推注的Mayo Clinic 方案(15%)的疗效明显提高,疾病进展时间(T TP)有所延长,存活时间增加,毒性反应更轻。因此,临床治疗中5‐FU 与CF联用时,持续滴注法已被广泛应用。在2010版NCCN 指南中,FOLFOX6 方案已作为一线推荐方案,其中5‐FU 首日给药400 mg/m2,静脉滴注完毕即开始给予2.4~3.6g/m2,静脉持续滴注48小时。同时,5‐FU 对RNA 也有轻微的抑制作用,抑制细胞增殖,这种作用与剂量呈明显依赖性,故临床也采取5‐FU 的静脉冲入和持续滴注同时应用。
CF(亚叶酸钙)是叶酸还原型的甲酰化衍生物,系叶酸在体内的活化形式。“解救”过量的叶酸拮抗物在体内的毒性反应,有利于胸腺嘧啶核苷酸、DNA、RNA 以至蛋白质合成。目前临床公认的CF 的剂量为200mg/m2,剂量大小对疗效的影响不大,过高的剂量缺乏研究依据。与5‐FU 合用时,应在输入5‐FU之前应用,以增强抑癌作用。
2﹒抗VEGF 生物靶向药物
血管内皮抑素是目前公认的最有效的血管生成抑制剂,它通过特异性地作用于新生血管的内皮细胞并抑制其迁移、诱导其凋亡,从而发挥抗血管生成作用,还可通过调节肿瘤细胞表面血管内皮生长因子(VEGF)的表达及蛋白水解酶的活性,多靶点发挥抗血管生成作用,间接导致肿瘤休眠或退缩。
国内研究提示,重组人血管内皮抑素与化疗联合用于治疗晚期直肠癌时具有协同作用,高于单纯化疗可以提高化疗的有效率。其原因可能与血管内皮抑素的作用机制有关:一方面特异性地作用于微血管内皮细胞,抑制迁移,诱导凋亡;另一方面使肿瘤血管正常化,改变肿瘤组织中血管迂曲,血流缓慢的状态,提高肿瘤组织中化疗药物的浓度,从而与化疗获得协同作用。
国内有针对晚期结直肠癌患者的治疗结果研究显示,重组人血管内皮抑素与化疗联合(分别联合奥沙利铂、伊立替康或卡培他滨)用于一线治疗的有效率为69.2%,而用于二线和三线治疗的有效率则明显降低,仅为16.7%,这一结果从另一方面支持了上述机制。血管内皮抑素本身的抗肿瘤作用有限,单用时并未观察到明显抗肿瘤活性,与化疗联合应用时可提高肿瘤组织中化疗药物的浓度,化疗药的有效率与联合治疗的有效率呈正相关。一线化疗敏感性好,有效率高,二、三线治疗时肿瘤组织出现耐药,敏感性差,有效率降低。该项研究提示血管内皮抑素可能更适合于一线治疗。
此患者化疗期间出现Ⅲ度消化道反应,出现腹泻,经对症治疗控制良好。化疗期间未出现骨髓抑制、皮肤过敏等不良反应。经心电监护,未见心脏毒性表现。
【药学监护项目】
1﹒心功能监护
该化疗方案使用的血管内皮抑素及5‐FU 均有心血管毒性,需考虑毒性叠加。使用血管内皮抑素期间应注意涉及心脏的不良反应,一般发生率为1%~10%,Ⅰ~Ⅲ期临床试验中,心脏不良反应主要表现为疲乏、胸闷、心慌,绝大多数不良反应经对症处理后好转,不影响继续用药,心肌缺血主要在用药2~7天内发生,因心脏反应而停用的患者仅占0.21%,表现为窦性心动过速,轻度ST‐T 段改变,房室传导阻滞等,在临床使用过程中定期检测心电图,对有心脏不良反应的患者应用心电监护。5‐FU 亦有潜在心脏毒性,偶见用药后心肌缺血,可出现心绞痛和心电图的变化。经证实发生心律失常、心绞痛、ST 段改变等不良反应时需停药。该患者既往无心血管疾病,在第1 疗程中也未见明显症状,此后疗程中,仍需考虑监控心功能。
2﹒预防口腔感染
5‐FU 输注过程中,偶见口腔黏膜炎或溃疡,该患者入院时口腔有浅表溃疡,及时用药控制,应避免发生大面积溃烂。
3﹒消化道反应
伊立替康引起的腹泻和(或)呕吐相关的脱水症状已有报道。5‐FU 引起恶心、食欲缺乏或呕吐。一般剂量下多不严重。患者使用托烷司琼控制呕吐,其间交叉使用止吐三联针甲氧氯普胺10 mg +地西泮10mg +地塞米松5mg,以地塞米松和地西泮增强甲氧氯普胺的止吐作用,取得良好临床效果。
4﹒监测有无腹泻
伊立替康引起的迟发性腹泻为剂量限制性毒性,在用药24小时后出现,发生率可达90%,在单药治疗中,所有听从腹泻处理措施忠告的患者中有20%发生严重腹泻,在可评估的周期内,14%出现严重腹泻。出现第1次稀便的中位时间为滴注后第5天;在联合治疗中,所有听从腹泻处理措施忠告的患者中有13.1%发生严重腹泻。出现腹泻必须及早应用止泻药洛哌丁胺,并补充大量液体。首次稀便出现后服洛哌丁胺4mg,以后每2小时服2mg。末次稀便后继续服用12小时。洛哌丁胺有导致麻痹性肠梗阻的危险,故连续用药不得超过48小时。与此同时,建议患者多饮水,促进药物代谢、排泄,必要时监测出入量。
5﹒急性胆碱能综合征
使用伊立替康单药治疗时,9%的患者出现短暂严重的急性胆碱能综合征,在联合治疗中仅为1.4%。主要症状为:早发性腹泻及其他症状,例如:用药后24小时内可发生腹痛、结膜炎、鼻炎、低血压、血管舒张、出汗、寒战、全身不适、头晕、视力障碍、瞳孔缩小、流泪及流涎等症状,可给予阿托品0.25mg ih 对症处理,之后在伊立替康使用之前预防性应用阿托品。
6﹒监测血象
中性粒细胞减少症是伊立替康剂量限制性毒性。中性粒细胞减少症是可逆转和非蓄积的;无论在单药治疗或联合治疗中,到最低点的中位时间为8天。在单药治疗中:78.7%的患者均出现过中性粒细胞减少症,严重病例占22.6%。通常在第22天完全恢复正常。通过血象监测,并适时对患者予以营养支持治疗,患者在院期间血象正常,但应密切注意定期监测。
7﹒给药说明
(1)血管内皮抑素的给药方法:单独给药时将本品加入250~500ml 生理盐水中,匀速静滴,时间为3~4小时。与NP 化疗方案联合给药:给予本品7.5mg/m2,qd,连续给药14天,休息1周,继续下1个周期治疗。临床推荐在患者耐受的情况下可适当延长使用时间,通常可进行2~4个周期。
(2)肠外营养用药顺序:在输入脂肪乳和氨基酸之前先输入葡萄糖,保证热量供给,可提高脂肪乳和氨基酸的作用。
(3)5‐FU 的联合用药:曾报道多种药物可在生物化学上影响氟尿嘧啶的抗癌作用或毒性:与甲氨蝶呤合用,应先给甲氨蝶呤4~6小时后再给予5‐FU,否则会减效;与CF 合用时,应先予CF 后用5‐FU,可增加其疗效,否则会减效;与抗病毒药干扰素‐α2b 合用,可显著增加5‐FU 的初始血药浓度,降低清除率;别嘌醇可减低5‐FU 的骨髓抑制作用。
思考题
贝伐单抗临床治疗应用有哪些注意事项?
贝伐单抗作为第一种应用于结肠癌临床治疗的分子靶向药物,其联合化疗一线治疗的地位在2010 新版《NCCN 指南》已经得到确认。迄今为止,全球已有包括转移性结直肠癌、非小细胞肺癌、转移性乳腺癌和转移性肾癌等肿瘤在内的500 000例患者接受过贝伐单抗的治疗,其安全性已经得到多个大型临床研究的证实。总的来说,贝伐单抗引起的相关严重不良事件的发生率较低,但对于极少数的患者,某些不良事件可能致命,如胃肠道穿孔和动脉血栓。因此,在临床应用中尚有以下问题值得注意:
(1)高血压作为贝伐单抗最常见的相关不良反应,发生率为8%~67%。在所有的临床研究中尚无因高血压致死的病例报道。由于高血压的发生可增加其他不良反应如血栓、蛋白尿及出血的风险,因此,临床应用贝伐单抗时,需要重点关注相关高血压的预防和治疗。高血压的发生风险与年龄、剂量等因素有关。因此,临床需要更多的关注高龄(>65岁)和接受大剂量贝伐单抗治疗患者的血压情况。
(2)贝伐单抗引起的另一常见不良反应为无症状性蛋白尿。总的发生率在低剂量组(每次贝伐单抗<10mg/kg)为21%~41%,在高剂量组(每次贝伐单抗>10mg/kg)为18%~63%,重度蛋白尿(CTC 3~4 级)的发生率低于3%。但是在肾细胞癌中,3~4 度蛋白尿发生率较高,为6.5%~7%。Choi 等报道,黑种人接受贝伐单抗治疗后,高血压和蛋白尿的发生率为50%,高于白种人的33%。而在疗效上,黑种人的临床获益率为67%,而白种人仅为33%。影响蛋白尿的危险因素主要包括既往高血压病史或在使用贝伐单抗过程中出现相关的高血压、糖尿病病史,以及针对肾细胞癌的治疗等。贝伐单抗引起肾损伤是不可逆的。国外推荐的贝伐单抗治疗期间出现蛋白尿的处理方法为:定期检测尿常规或24小时尿蛋白定量。如贝伐单抗每2周给药1次,则每月检测;如贝伐单抗每3周给药1次,则每次给药前检测;出现1 级蛋白尿可继续贝伐单抗治疗;出现2~3 级尿蛋白,需行24小时尿蛋白定量检测,24小时尿蛋白≤2g,可继续贝伐单抗治疗;24小时尿蛋白>2g,暂停贝伐单抗治疗;24小时尿蛋白持续>2g超过3个月或出现4 级蛋白尿(肾病综合征),需永久性停用贝伐单抗。
(3)贝伐单抗的使用进一步增加了血栓栓塞的风险,而血栓栓塞是导致肿瘤患者死亡的主要原因之一。Scappaticci 等对5个贝伐单抗临床试验、共1745例肿瘤患者的Meta 分析显示,含贝伐单抗组的动脉血栓事件发生率为3.8%,对照组为1.7%;贝伐单抗组脑血管意外的发生率为2.3%,心肌梗死的发生率为1.4%,而对照组分别为0.5%和0.7%。分析表明,风险因素主要与肿瘤类型有关,结直肠癌静脉血栓的发生率最高,为19.1%,肾癌发生率最低,为3%。另外,既往曾有动脉血栓栓塞史的患者(P<0.001)或年龄大于65岁的患者(P =0.01),应用贝伐单抗后发生动脉血栓栓塞的风险增高。因此,对于曾患动脉血栓和年龄大于65岁的这两类高风险因素的患者,应慎用贝伐单抗。
(4)贝伐单抗导致的出血事件可发生于治疗的任何时期,主要包括两类:一类是轻度的皮肤黏膜出血,大多为鼻出血、牙龈出血或阴道出血,发生率为20%~40%;另一类是肿瘤相关的出血,较少见,多发生于肺鳞癌及转移性结直肠癌,有时为重度,可致死亡。在报道的所有临床研究中,3~5 级出血事件的总发生率为0.4%~5.0%。肿瘤相关的出血,则往往与肿瘤原发病灶的类型及浸润深度相关,其他高危因素还包括抗炎药物/抗风湿药物治疗、抗凝治疗、既往放疗、动脉粥样硬化和中枢神经系统转移。鉴于目前还没有充足的证据说明贝伐单抗在围术期应用的安全性,2010版《指南》推荐应在术前6周停用贝伐单抗,术后6~8周后方能开始使用贝伐单抗。
(5)贝伐单抗治疗各类适应证肿瘤时,胃肠道穿孔的发生率为0.3%~2.4%。其中,转移性结直肠癌患者的胃肠道穿孔发生率可达2%。胃肠道穿孔严重病例中,约有1/3 可导致致命的后果。研究表明,贝伐单抗引起的相关胃肠道穿孔与贝伐单抗的剂量有关。剂量为每周2.5mg/kg 的风险比为1.61;而剂量为每周5 mg/kg 的则为2.67。穿孔风险与肿瘤的分期也有关。其中,结肠癌患者接受贝伐单抗治疗后,胃肠道穿孔的风险最高,风险比为3.1。而转移性结肠癌的风险比值进一步升高为3.68。转移性结肠癌风险比升高的原因可能与肿瘤沿肠道生长的位置、既往肿瘤放疗野的炎症反应、手术或内镜对局部的创伤、既往局部放疗史等有关。FDA 对贝伐单抗引起的相关胃肠道穿孔的处理中明确警示,一旦出现胃肠道穿孔,将永久停用贝伐单抗。
(6)目前,在对贝伐单抗相关生物标志进行了密集的研究中尚未发现可预测贝伐单抗疗效的生物标志物,这对其临床应用产生一定影响。
(7)早期的BOND‐2 研究提示,西妥昔单抗与贝伐单抗一起联合化疗应用有很好的疗效。但随后的PACCE 研究和CAIRO2 研究均显示,EGFR 单抗与VEGF 单抗联合应用并无生存优势,且增加毒副作用。新版《指南》明确反对这种联合应用。
(8)使用注意事项:使用前按5 mg/kg 的剂量抽取药量,稀释到总体积为100 ml 的0.9%氯化钠注射液。应肉眼观察有无颗粒物质和变色。稀释后的贝伐单抗溶液应在2~8℃环境中保存,最长可达8小时。贝伐单抗不应使用糖溶液配制或与糖溶液混合。贝伐单抗注射液应保存在2~8℃的冰箱中,避光保存。
首次用药应在化疗后静脉输注90分钟以上。如果第1次输注耐受良好,第2次输注可为60分钟以上。如果60分钟也耐受良好,以后的输注可控制在30分钟以上。
来源:《肿瘤》
作者:孙淑娟 张志清
参编:张鉴 雒琪 宋晓坤 沙丹 张文
页码:194-203
出版:人民卫生出版社
- 评价此内容
- 我要打分
近期推荐
热点文章
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

