老爷爷反复咳嗽咳痰2年余 先查出结肠癌又查出肺癌
66岁男性,因“反复咳嗽、咳痰2年余,再发加重3天”入院,此前曾行“乙状结肠癌根治术”。此次受凉后咳嗽咳痰为哪般?
【病情介绍】
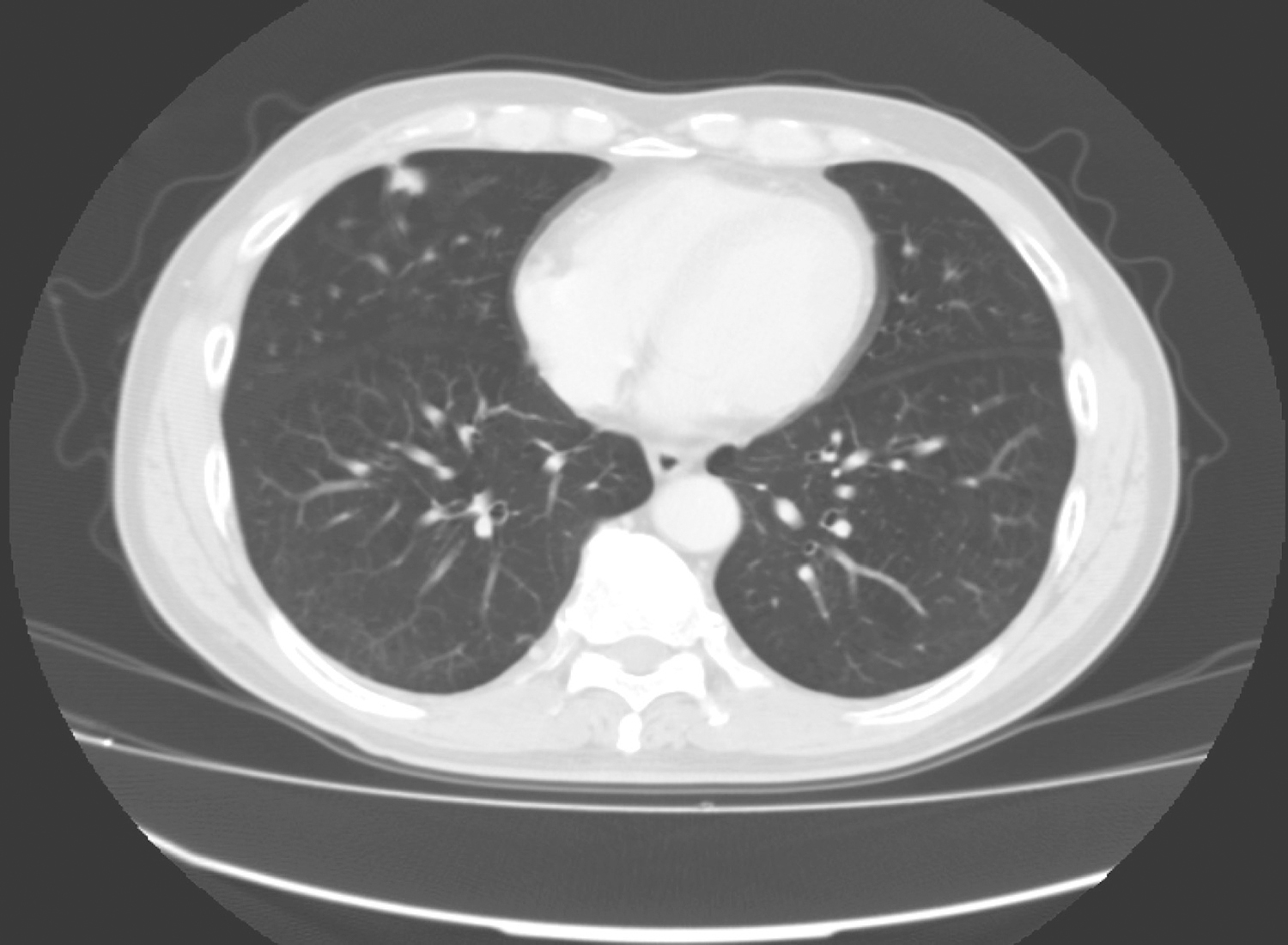
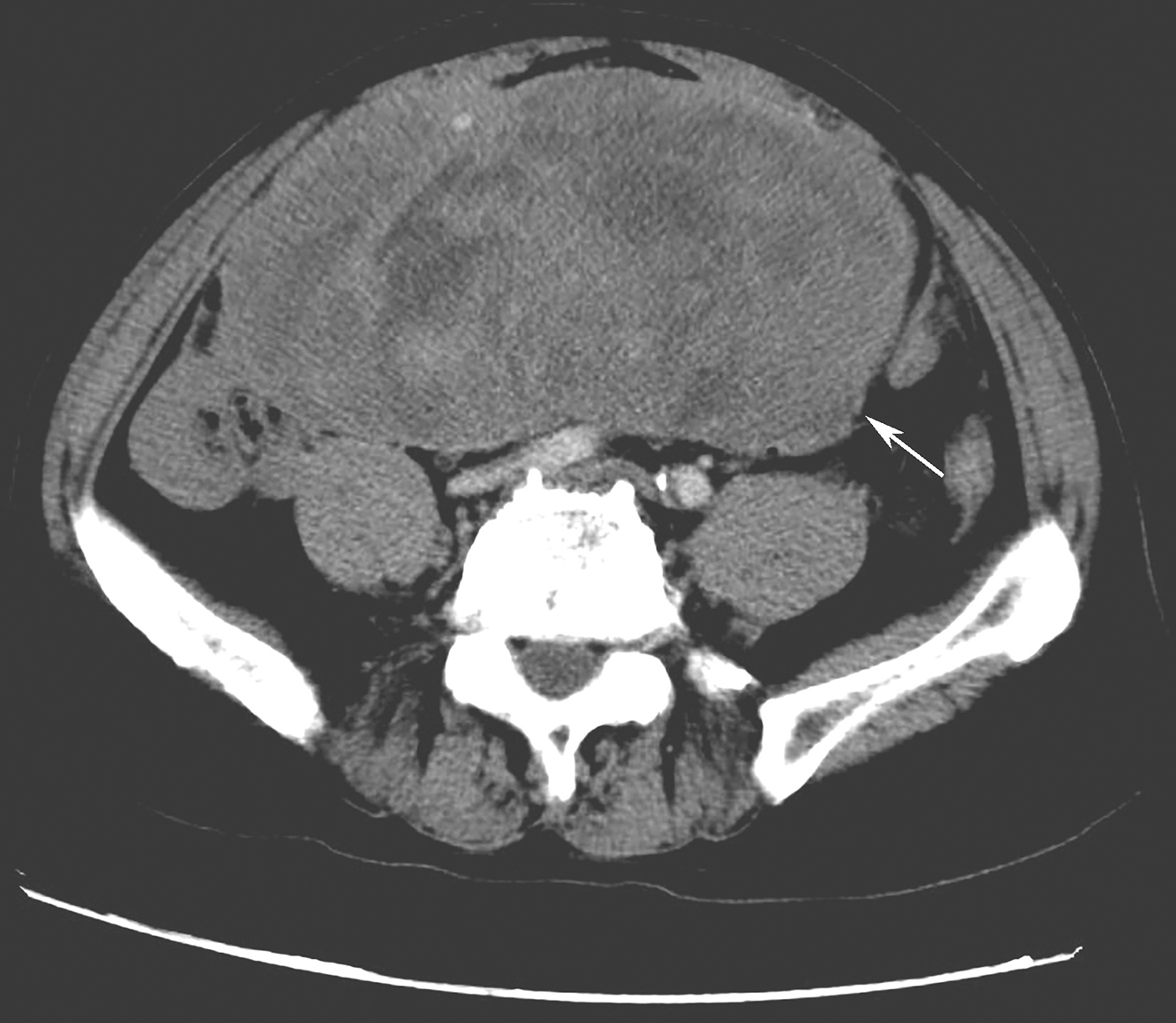
患者,刘某,男,66岁。因“反复咳嗽、咳痰2年余,再发加重3天”于2014年3月7日入院。自2012年以来,患者无明显诱因出现反复咳嗽、咳痰,多为白色泡沫痰,咳嗽剧烈时伴胸闷、气喘不适,间断高热,多次在外院住院治疗,每经抗感染及止咳祛痰等对症治疗后病情可缓解,出院后患者咳嗽、咳痰症状仍反复。自2012年起病以来,患者多次行肺部CT(图1~图4)检查提示“左下肺大片状及右上叶片状阴影”,行抗感染治疗后右肺上叶稍吸收,左下肺片状影吸收欠佳。2013年8月考虑患者“肺结核”不能排除,在本市结核病医院,查T-spot(+),后给予三联抗结核(异烟肼+利福平+乙胺丁醇)治疗2个月,咳嗽、咳痰未见明显好转。2013年11月曾因咳嗽、咳痰加重入我科,给予抗感染(左氧氟沙星)及继续抗结核(异烟肼+利福平+乙胺丁醇)治疗,期间患者因大便潜血(+)行肠镜检查,提示“乙状结肠直肠新生物”,病理检查示“乙状结肠腺癌”,于2013年12月8日转普外科行“乙状结肠癌根治术”。此次入院前3天,患者受凉后再发咳嗽,咳白色泡沫痰,量较多,偶为粉红色泡沫痰,咳嗽剧烈时感憋气、胸痛,无畏寒、发热,无恶心、呕吐,无双下肢水肿等不适。
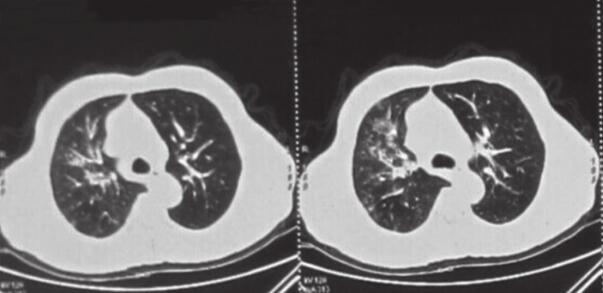
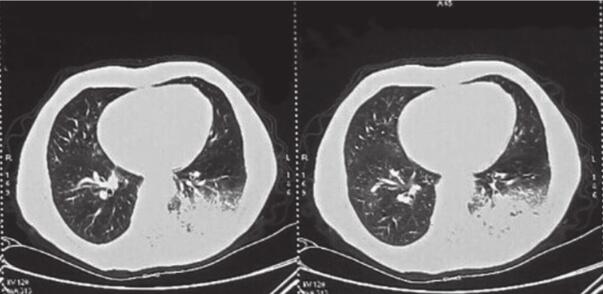
图1 2013年1月7日右上肺(A)及左下肺(B)
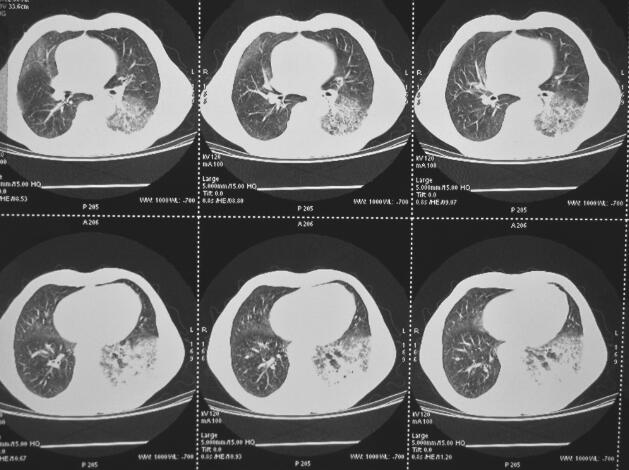
图2 2013年8月27日肺部CT
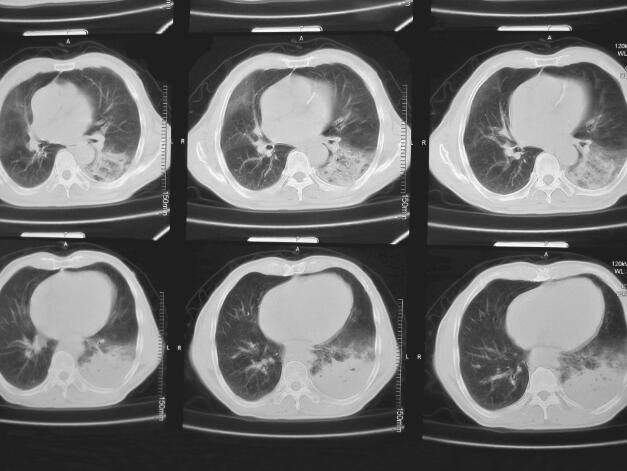
图3 2013年10月21日肺部CT
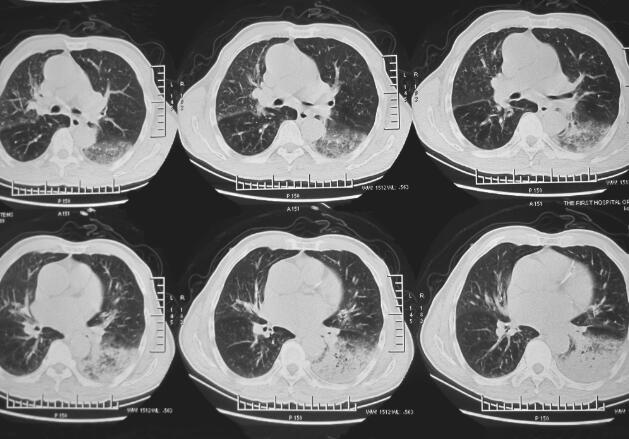
图4 2013年12月17日肺部CT
既往有高血压20余年。2008年因“冠心病、心肌梗死”行“冠脉支架植入术”。无糖尿病、慢性胃炎等慢性病史,无肝炎、结核、疟疾等传染病史。患者出生于宜昌,无粉尘、毒物放射性物质接触史,无疫区接触史,无食生鱼、生肉史。无手术输血史,无食物、药物过敏史预防接种史不详。无烟酒嗜好。已婚,配偶及儿女体健,家族史无特殊。
【诊治经过】
入院后检查:生命体征平稳,慢性病容,桶状胸,双肺呼吸音粗,双下肺可闻及散在湿性啰音,余无明显异常体征。2014年3月7日血常规:N% 75.9%↑,PLT 92×109/L↓。红细胞沉降率60mm/h↑。CRP 244.80mg/L↑。肝功9项:ALB 32.9g/L↓,肾功能、电解质等生化未见异常。肺功能示FEV1 1.41L、FVC 2.31L、FEV1实/预计值% 47.3%、FEV1/FVC 61.16%,提示重度阻塞性通气功能障碍,最大通气量重度下降;舒张试验阴性。2014年3月10日痰涂片革兰染色:革兰阳性球菌(+),革兰阴性杆菌未见。痰培养:普通培养无致病菌生长,提示真菌(++)。痰涂片找真菌:检出酵母样真菌。痰涂片找抗酸杆菌:未找到抗酸杆菌。201年3月17日血G试验、GM试验均阴性。肿瘤标志物:CEA 4.80ng/ml、SCCAg 0.59ng/ml、NSE 2.92ng/ml均正常范围。
入院后给予抗感染(左氧氟沙星+头孢哌酮舒巴坦+伏立康唑)、祛痰等治疗,咳嗽、咳痰,间断发热等症状改善不明显。2014年3月7日肺部CT(图5)提示慢性支气管疾病肺气肿,伴双肺感染,左下肺不张。2014年3月11日支气管镜检查提示支气管腔内未见明显异常,左下叶黏性分泌物较多。保护性毛刷刷检培养无致病菌生长。2014年3月19日CT引导下经皮肺活检送病原学检查及病理检查提示黏液腺癌,组织培养无致病菌生长。
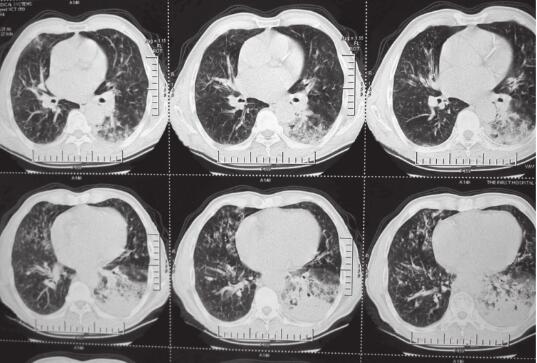
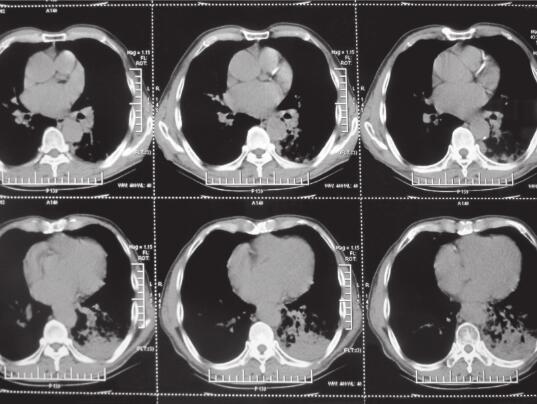
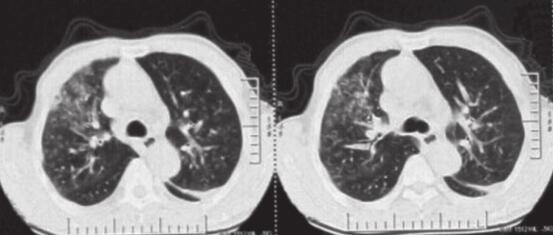
图5 2014年3月7日肺部CT提示左下肺大片状及右上叶片状阴影
【最后诊断】
1. 肺黏液性腺癌。
2. 结肠腺癌术后。
【治疗和转归】
患者家属拒绝行手术治疗及放化疗等姑息治疗,患者于2014年6月底去世。
【重要提示】
1. 老年男性,病程已达2年余。
2. 主要表现为慢性咳嗽、咳大量黏痰,间断发热,胸闷、气促,查体双下肺可闻及散在湿性啰音,肺部CT检查提示慢性支气管疾病,肺气肿,伴双肺感染,左下肺实变并部分肺不张。
3. 反复给予多种广谱抗生素治疗,效果不佳。
4. 已于术后行病理检查明确诊断有“乙状结肠腺癌”病史。
【讨论】
肺黏液性腺癌(mucin-producing adenocarcinoma of the lung,MPA)属于肺腺癌的一种特殊亚型,其组织学特点是肿瘤内含有丰富的黏液,具有独特的临床病理特征和免疫表型。
(一)分型
根据2004年WHO组织学分型规定,肺腺癌可分为混合型、腺泡样型、乳头状型、细支气管肺泡癌型、腺癌伴黏液分泌型及一些变异型。2011年国际肺癌领域重新定义了肺腺癌的分类标准,该领域由国际肺癌研究协会/美国胸科学会/欧洲呼吸学会(IASLC/ATS/ERS)联手,并在Journal of Thoracic Oncology杂志上公布。MPA相当于原分类中的黏液性细支气管肺泡癌,又可分为2种病理类型,即黏液细胞癌(印戒细胞癌)和黏液腺癌,其中印戒细胞癌约占MPA的10%~50%。
(二)组织学特点
其组织学特点是肺泡内可见大量黏液,并可溢出细胞,形成大小不等的黏液池,即“黏液湖”,可见成堆或散在的癌细胞漂浮其中。肉眼见癌细胞呈灰白色、湿润、半透明胶冻状具有独特的临床病理特征和免疫表型。目前关于MPA的病因及发病机制没有专门的深入研究,一般认为与普通型肺腺癌相同。
(三)临床表现
MPA多见于中老年患者,男∶女约为1∶1,周围型多于中心型,是否与吸烟有关还有待进一步研究。其临床症状无特异性,以刺激性干咳、血痰、咳白色黏痰、发热及胸痛为主或无任何症状。反复长期咳白色黏痰可能是本病的主要临床症状。
(四)诊断
PET/CT可准确显示病灶、孤立性肺结节及可疑的病变区域,在确定临床分期有较高的价值;但PET/CT在诊断MPA有较大的局限性。因此,诊断MPA时,胸部CT明显优于PET CT。其CT表现主要为团块影及结节影,可有毛刺征及分叶征,也有文献报道在病灶内发现大量钙化点。诊断MPA的金标准是病理学检查。
(五)鉴别诊断
黏液腺癌常好发于消化系统,原发于肺部并不常见。诊断MPA时应注意是原发于肺部的肿瘤还是消化道肿瘤肺部转移。判定MPA的原发脏器部位主要依据病理免疫组化,研究发现甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)、细胞角蛋白-7(cytokeratin-7 CK7)及细胞角蛋白-20(CK20)有助于原发性肺黏液腺癌与转移性腺癌的鉴别。原发于胃肠道的黏液腺癌高表达CK20,阴性表达TTF-1、CK7,而原发性肺黏液腺癌高表达CK7和TTF-1。Rossi等研究表明不含印戒细胞的MPA预后较好,并通过分析病变组织病理免疫组化判断预后,但其相关程度有待于大样本的进一步研究。
(六)治疗与预后
治疗方案主要包括手术切除、化疗和放疗。
1.标准手术方式
肺叶切除术+系统性纵隔淋巴结清扫术。
2.化疗
常用以铂类药物为基础的联合化疗方案,如TP、GP等。
3.放疗
在MPA患者的治疗效果尚不清楚。
4.靶向治疗
目前尚没有专门针对MPA的相关研究。
整体预后较其他亚型肺腺癌差,可能的原因是MPA有更高的转移率,包括肺内转移、血行转移和淋巴转移等。
【评述】
由于MPA是少见的肺部恶性肿瘤,至今国际上没有确切的MPA发病率统计,其临床表现具有一定的隐匿性和特殊性,易误诊为肺部其他病变。回顾上述病例,可以挖掘出清晰的诊断线索。首先,患者有反复咳嗽、咳白色黏痰,伴间断高热、胸痛等病史,行影像学检查提示“左下肺大片状及右上叶片状阴影”,反复给予多种广谱抗生素抗细菌、结核及真菌等治疗,症状及影像学表现均无明显改善,难以用“肺部感染”及“肺结核”来解释,在此期间患者因大便潜血(+)行肠镜及病理检查示“乙状结肠腺癌”,尽管血肿瘤标志物及支气管镜检查均未见异常,仍不排除“肺部肿瘤”的可能;若是恶性肿瘤,其来源是原发还是肠道转移,这是临床上判断预后及拟行治疗必须明确的问题。
最终在CT引导下经皮肺穿刺活检并送检组织行病理学检查明确诊断为MPA;根据免疫组化得到结论:肺部病灶为原发的恶性肿瘤。本例患者确诊时已为肿瘤晚期,其家属拒绝行手术治疗及放化疗等姑息治疗,由于MPA的预后较其他亚型肺腺癌差,该患者的生存期仅有3个多月。
MPA发病率很低,易误诊、漏诊,同一部位反复发生的肺炎常提示支气管腔内的病变,应考虑MPA的可能。病的最初诊断常为其他呼吸道疾病,如慢性支气管炎、肺炎、肺结核、肺不张及胸腔积液等疾病,但只要我们对本病的临床表现和诊断标准有了清晰的认识,从病史、临床表现、体征、影像学及组织病理学等方面是不难进行鉴别,并最终得以正确诊治的。
(倪吉祥)
参考文献
1. Travis WD,Brambilla E,Noguchi M,et al. International association for the study of lung cancer/American Thoracic Society/European Respiratory Society international multidisciplinary classification of lung adenocarcinoma. Thorac Oncol,2011,6:244-285.
2. Kish JK,Ro JY,Ayala AG,et al. Primary mucinous adenocarcinoma of the lung with signet-ring cells:a histochemical comparison with signet-ring cell carcinomas of other sites. Hum Pathol,1989,20(11):1097-1102.
3. Babak VG,Desbrieres J,Tikhonov VE. Dynamic surface tension and dilational viscoelasticity of adsorption layers of a hydrophobically modified chitosan. Colloids and Surfaces. A,Physicochemical and Engineering Aspects,2005,255(1-3):119.
4. Popat N,Raghavan N,Mclvor RA. Severe bronchorrhea in a patient with bronchioloalveolar carcinoma. Chest 2012,141:513-514.
5. Sawada E,Nambu A,Motosugi U,et al. Localized mucinous bronchioloalveolar carcinoma of the lung:thin section computed tomography and flurodeoxyglucose positron emission tomography findings. Jpn J Radiol,2010 28:251-258.
6.Murai T,Hara M,Ozawa Y,et al. Mucinous colloid adenocarcinoma of the lung with lymph node metastasi showing numerous punctate calcifications. Clin Imaging,2011,35(2):151-155.
7. Lau SK,Desrochers MJ,Luthringer DJ. Expression of thyroid transcription factor-1,cytokeratin 7,and cytokerati 20 in bronchioloalveolar carcinoma:an immunohistochemical evaluation of 67 cases. Mod Pathol,2002,15:538 542.
8.Rossi G,Murer B,Cavazza A,et al. Primary mucinous(so-called colloid)carcinomas of the lung:clinicopathologic and immunohistochemical study with special reference to CDX-2 homeobox gene and MUC expression. Am J Surg Pathol,2004,28(4):442-452.
(环球医学编辑:余霞霞)
来源:《呼吸疑难少见病例解析》
作者:林江涛
页码:6-12
出版:人民卫生出版社
- 评价此内容
- 我要打分
近期推荐
热点文章
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

