18岁男子查体发现右肺肿块无呼吸道症状 不料是罕见恶性肿瘤
18岁男性,因“查体发现右肺肿块1个月余”入住呼吸内科。一般情况无异常,无呼吸道症状。该患者所患何病?
【病情介绍】
患者,男,18岁,工人,因“查体发现右肺肿块1个月余”于2012年12月20日就诊于山东省立医院,入住呼吸内科。一般情况无异常,无呼吸道症状。既往体健,吸烟史3年,约10支/日。否认家族肿瘤病史。
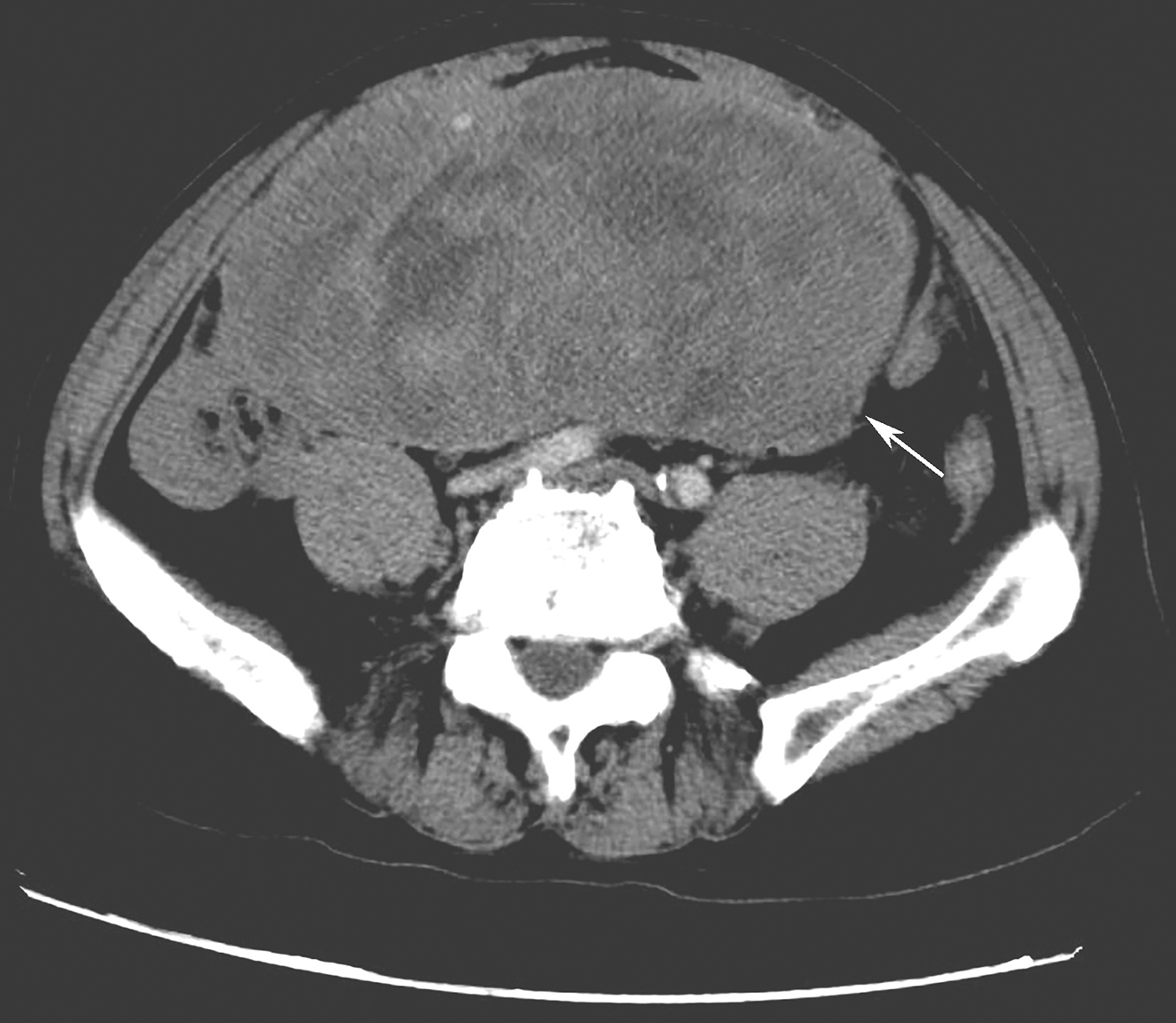
辅助检查:2012年11月13日胸部正侧位片示:右肺心膈角处见一椭圆形密度增高影,约4.5cm×6.4cm大小,边缘光滑,侧位片示前缘与胸膜关系密切,后上缘有一尖角与斜裂相连。右下肺膈顶下方可见一小结节影,侧位显示不清(图1-1)。2012年11月15日胸部CT平扫+增强示:右肺中叶内侧段可见大小约5.7cm×5.0cm软组织肿块,有浅分叶,增强扫描呈中度强化,边缘清晰,双肺多发大小不等结节灶,边缘清晰,大者直径约1.0cm,段及段以上支气管通畅,双肺门及纵隔内未见异常肿大的淋巴结。双侧胸膜未见增厚。未见胸腔积液图1-2)。
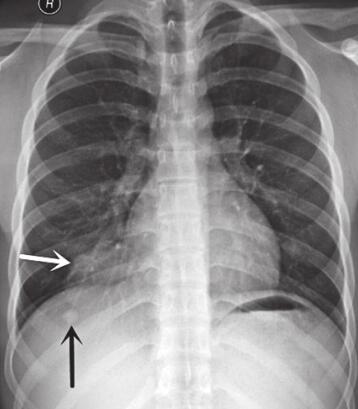

图1 2012年11月13日胸部正侧位片
右肺心膈角处见一椭圆形密度增高影,约4.5cm×6.4cm大小,边缘光滑(图A白色箭头),其前缘与胸膜关系密切,后上缘有一尖角与斜裂相连(图B黑色箭头)。右下肺膈顶下方可见一小结节影(图A黑色箭头),侧位显示不清
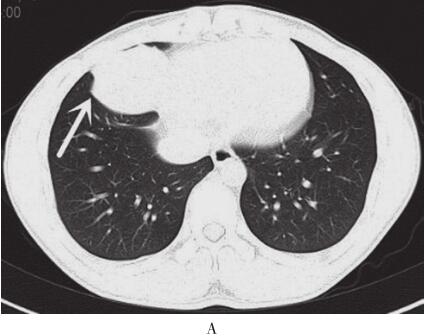
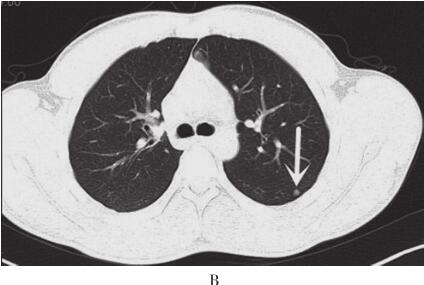


图2 2012年11月15日胸部CT平扫+强化
A.右肺中叶内侧段可见大小约5.7cm×5.0cm软组织肿块,有浅分叶,边缘清晰;B、C.双肺可见多发大小不等结节灶;D.肿块增强扫描呈中度强化
【诊治经过】
入院后检查:体格检查:T 36.5℃,P 100次/分,R 16次/分,BP 135/63mmHg,指脉氧99%。青年男性,口唇无发绀,气管居中。胸廓无异常,叩诊双肺呈清音,听诊双肺呼吸音清,未闻及异常。心、腹(-)。双下肢无水肿。无杵状指(趾)。
男性肿瘤标志物:癌胚抗原:42.22ng/ml(参考范围:0~10ng/ml),甲胎蛋白、总前列腺特异抗原、游离前列腺特异抗原、游离/总前列腺特异抗原、糖类抗原50、糖类抗原12-5、糖类抗原15-3、糖类抗原19-9、糖类抗原24-2、糖类抗原72-4、非小细胞肺癌相关抗原、神经元特异性烯醇化酶、胃蛋白酶原I、胃蛋白酶原、胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ比值、鳞状细胞癌抗原均未见异常。
排除肺穿刺禁忌后,于2012年12月11日行MR引导下经皮肺穿刺活检术。病理示:(右肺肿块穿刺活检)组织形态较符合肺母细胞瘤(双相型)。免疫组化:CK(+),S-100(+),P63(+)(部分),CD99(+),MyoD1(-),AFP(-),HMB45(-),MelanA(-),Syn(-),CgA(-),CD56(-),TTF-1(-),NapsinA(-),Vim(+),Ki-67(+)(10%)(见文末彩图1-19-3)。病理切片经山东多家三甲医院会诊均符合肺母细胞瘤(双相型)的诊断。
【最后诊断】
肺母细胞瘤(双相型)。
【治疗和转归】
本病属于罕见病,恶性程度高,无确切有效的治疗方法,预后极差。考虑患者已双肺转移,无手术机会,化疗效果差,患者及家属放弃治疗,回当地医院保守治疗观察,1年后死亡。
【讨论】
肺母细胞瘤就是一种罕见的肺部原发恶性肿瘤,约占肺部原发恶性肿瘤的0.25%~0.5%。1945年,Barrett和Barnard首次报道了肺母细胞瘤,1961年,Spencer报道了3例类似病例,并对此肿瘤重新分类,首次将其命名为“肺母细胞瘤(pulmonary blastoma,PB)”。目前,肺母细胞瘤可分为3类:经典的双相型肺母细胞瘤(classic biphasic pulmonary blastoma,CBPB)、分化良好的胎儿型腺癌(well differentiated fetal adenocarcinoma,WDFA)和胸膜肺母细胞瘤pleuropulmonary blastoma,PPB)。CBPB是肺母细胞瘤中唯一的双相型类型,其特点是具有由类似于胎儿腺癌的恶性原始上皮成分和间叶成分构成的组织学异质性,是3种类型中最常见的PB。在WHO 2004年版肺肿瘤组织学分类中,CBPB为成分界于多形性肉瘤或肉瘤成分之间的癌,已归入肺肉瘤样癌。
目前,PB的病因与发病机制仍未明确。临床表现多无特异性,主要表现为咳嗽、咳痰、痰中带血、咯血、胸痛、胸闷气促、呼吸困难、发热等,但厌食、体重下降、疲劳、乏力、肺部多发感染、自发性气胸、胸腔积液及神经症状等也有报道。大部分患者可有长期大量吸烟史。约41%的患者可无任何临床症状和体征,肿块多通过健康查体时发现。CBPB和WDFA的发病率大致相同,均可发生于各个年龄段,发病年龄可从0~80岁,约80%的CBPB患者多发生于成年人,主要见于40~50岁的成人,约有20%则可发生于20岁以下。
PB影像学表现缺乏特异性。病灶多位于肺内周边部靠近胸膜的圆形或类圆形的孤立性肿块影,边界较清晰,直径一般>5cm。多见于右肺上叶。肿块较大时,边界多较光滑,少见分叶征。肿块较小时,可有分叶征。也可表现为双肺多发结节影及胸腔积液,但较少见。偶见肺门及纵隔淋巴结肿大。陈薇等报道了45例成人型肺母细胞瘤患者均未见毛刺,而张金娥等报道的1例患者病灶可见毛刺,影像学表现酷似肺癌,可能是PB的生物学行为类似于肺癌,具有一定的浸润性。大多数肿块密度均匀,少见钙化,部分肿块内可见空洞、液化坏死灶及壁结节,胸部CT较胸片显示更为确切。
病理和免疫组化为确诊肺母细胞瘤的金标准。成人型PB的肿瘤多为位于肺内周边部靠近胸膜的单发的直径>2cm的肿块,可累及胸膜。肿块边界清晰,无包膜,但可有假包膜。肿瘤质软,伴出血和坏死,切面灰黄或灰白色。少数位于肺中央的病灶切面可见支气管断面。镜下观CBPB类似于胎儿腺癌的恶性原始上皮成分为呈管腔样排列的单层立方状细胞,CBPB的恶性原始间叶成分为圆形或短梭形的幼稚间叶细胞。可见黏液样变性。部分病例间质可见原始间叶细胞向骨、软骨及横纹肌肉瘤的灶性分化成分,个别可分化为卵黄囊或恶性黑色素瘤成分。免疫组化可见原始上皮成分标志物CK、CEA、EMA、PAS、MNF 116、TTF-1、NSE、CgA、Syn等阳性,原始间叶成分标志物vimentin、Desmin、S-100蛋白、AFP和α-SMA等阳性。
PB的临床表现无特异性,诊断主要依靠病理形态及免疫组化表现,病史、临床表现、实验室检查及影像学检查对诊断及分型有一定帮助作用。临床上需要与结核球、周围型肺癌及炎性假瘤等相鉴别。
PB高度侵袭性,易浸润、转移,治疗的关键为早期诊断、及时治疗,其主要治疗方法为手术切除肿块及淋巴结清扫术。术后可辅助放、化疗。PB对化疗不敏感,当前用何种化疗药物及方案尚无定论。1998年,CUT-LER等研究了文献中的468例PB,结果表明:甲氨蝶呤、阿霉素、环磷酰胺、博来霉素、5-氟尿嘧啶、依托泊苷、长春新碱等,无论单药或是联合使用,效果均不理想,且中位生存期仅14.7个月。而新的药物如长春瑞滨、紫杉醇类、吉西他滨、喜树碱类等疗效也不确切。Mulamalla等报道1例索拉菲尼(多吉美,sorafenib)治疗CBPB伴肾转移患者2个月,肾脏肿瘤明显缩小,并获得肾切除的机会,表明该药对PB有效,但由于是个案报道,仍有待于进一步研究。有学者研究报道,化疗药物CD117抑制素对CD117阳性的PB患者有一定疗效。
PB的预后极差,类似于癌肉瘤或肉瘤样癌。决定PB预后的主要因素包括肿瘤的原发部位、直径大小、病理类型及转移情况。PB的原发部位愈靠近胸膜,则预后愈差。PB的直径愈大,尤其是肿瘤最大直径>5cm者,则预后愈差。PB病理类型的预后情况:WDFA好于CBPB,前者的10年生存期约为后者的4倍,CBPB好于PPB。若PB合并胸膜、纵隔淋巴结等部位转移者,则预后愈差。66%的PB患者多于确诊后2年内因肿瘤复发、多部位转移等而死亡。PB5年生存率约仅为16%。
【评述】
目前,在人类所患疾病谱中,肿瘤的发病率及死亡率仍居高不下,严重危害着人类的健康。而肺脏是肿瘤最常见的发生部位及转移部位之一。约95%~98%的肺部恶性肿瘤为原发性支气管肺癌,而约0.8%~2%的肺部恶性肿瘤为少见的肺部原发性恶性肿瘤。由于这些少见肺部恶性肿瘤无特殊的临床表现、实验室检查及影像学检查,早期不易确诊,常易误诊为其他肿瘤,如原发性支气管肺癌等。一般均经手术才能确诊,也可经皮肺活检或经支气管镜肺活检确诊。但与原发性支气管肺癌起源于支气管上皮及腺体不同的是,大部分少见肺部恶性肿瘤起源于肺间质内,因而在种类、病理学、诊断学、治疗及预后等方面也有其特点。
肺母细胞瘤(PB)是一种组织起源尚有争议,结构类似于早期胎儿肺的恶性肿瘤,侵袭程度高且极为罕见,约占肺部原发恶性肿瘤的0.25%~0.5%。PB临床表现、实验室检查、影像学检查均无特异性。病理检查及免疫组化是确诊PB的金标准。治疗首选手术切除肿块及淋巴结清扫术,术后可辅助放、化疗,但疗效不确切。由于PB具有恶性程度高,侵袭性高及术后易复发和转移等特点,预后极差。本例患者为青年男性,无临床症状,发现即为晚期。由此提示我们,无症状的肺部肿块影,无论年龄,均应积极取得组织病理学诊断证据,以免导致肿瘤的误诊。
(姜淑娟)
参考文献
1. 刘又宁. 现代临床医学内科进展-呼吸内科分册. 北京:科学技术文献出版社,2006:61.
2. Nakata K. Revision of Clinical Guidelines for DPB. Annual Report of the study of diffuse lung disease in 1998. Tokyo:Grant-in Aid from the Ministry of Health and Welfare of Japan,1999:109-111.
3. Matsuno O,Ueno K,Hayama Y,et al. Deterioration of asthma in a patient with diffuse panbronchiolitis(DPB)after macrolide therapy. J Asthma,2010,47(4):486-488.
4. Manivel JC,Priest JR,Watterson J,et. al. Pleuropulmonary blastoma the so-called pulmonary blastoma of childhood. Cancer,1988,62(8):1516-1526.
5. Larsen H,Sorensen JB. Pulmonary blastoma:a review with special emphasis on prognosis and treatment. Cancer Treat Rev,1996,22:145-160.
6. LeMense GP,Reed CE,Silvestri GA. Pulmonary blastoma:a rare lung malignancy. Lung Cancer,1996,15:233-237.
7. Koss MTW,Moran C. Pulmonary sarcomas,blastomas,carcinosarcomas and teratomas. 5th ed. New York:Mcgraw Hill,1996.
8. 陈薇,刘怀军,高国梁,等. 肺母细胞瘤的影像学诊断及鉴别诊断. 河北医药,2003,6(25):436.
9. 张金娥,梁长虹,赵振军. 肺母细胞瘤的临床和影像学分析. 广东医学,2005,26(7):979-980.
10. Cutler CS,Michel RP,Yassa M,et al. Pulmonary blastoma:case report of a patient with a 7-year remission and review of chemotherapy experience in the world literature. Cancer,1998,82(3):462-467.
11. Mulamalla K,Truskinovsky AM,Dudek AZ,et al. Pulmonary blastoma with renal metastasis responds to sorafenib. J Thorac Oncol,2007,2(4):344-347.
12. Hansen T,Bittinger F,Kortsik C,et al. Expression of kit(CD117)in biphasic pulmonary blastoma. Novel data on histogenesis. Lung,2003,181:193-200.
13. Sekine S,Shibata T,Matsuno Y,et al. Beta_Catenin mutations in pulmonary blastomas:association with morule formation. J Pathol,2003,200(2):214-221.
(环球医学编辑:余霞霞)
来源:《呼吸疑难少见病例解析》
作者:林江涛
页码:79-83
出版:人民卫生出版社
- 评价此内容
- 我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

