老年女性腹胀1周余 误诊为妇科肿瘤实则为…
56岁女性,1年前出现尿频,10~13次/d,阴道无异常流血流液,无尿急及尿痛,无腹痛、发热。6天前出现中下腹胀痛,妇科彩超及腹、盆腔CT提示右侧盆腔巨大肿物,考虑为妇科肿瘤。为明确肿物性质,指导下一步诊治,遂行“开腹探查术”,却发现……
【病例摘要】
患者,女性,56岁,于2015年6月就诊于笔者单位妇科门诊,自述1年前出现尿频,10~13次/d,阴道无异常流血流液,无尿急及尿痛,无腹痛、发热。6天前出现中下腹胀痛,于外院行超声检查,发现右侧盆腔占位性病变,考虑卵巢肿瘤,今为求进一步诊治来笔者单位。
既往史及家族史
高血压病史2年,最高175/95mmHg,口服氨氯地平治疗,1片/d,血压控制在120/85mmHg,否认肝炎、结核等传染病史,否认心脏病、糖尿病史,否认外伤史,否认食物及药物过敏史,无输血史。
体格检查
神志清楚,巩膜无黄染,无贫血貌,双肺听诊呼吸音清,心率80次/min,腹软,下腹部轻微压痛,无反跳痛及肌紧张,肝脾肋下未及,肠鸣音未闻及,移动性浊音(-),双下肢无水肿,四肢活动良。妇科检查:外阴发育正常,已婚型,阴道畅,黏膜无充血,阴道内有少量分泌物,无异味。宫颈肥大,居中,子宫前位,缩小,质硬,形态略不规则,活动可,右附件区可触及一12cm大小包块,质硬,活动度稍差,压痛。左附件区未触及明显异常。
辅助检查
血常规:白细胞8.38×109/L,红细胞4.0×1012/L,血红蛋白 119g/L,血小板351×109/L↑,中性粒细胞百分比59.4%,淋巴细胞百分比32.6%。
血生化:未见异常。
肿瘤标志物:CA125 21.85U/ml。
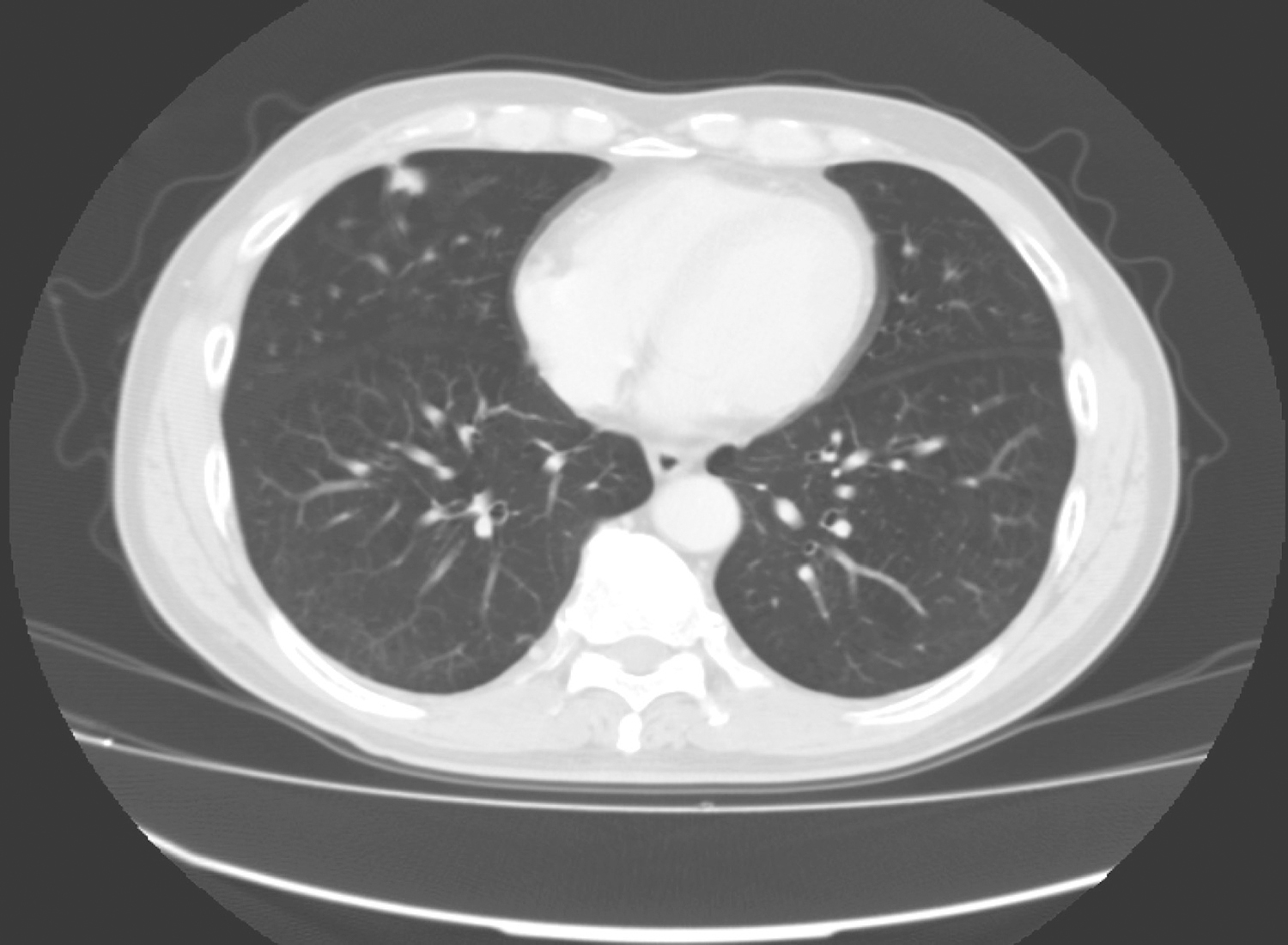
妇科彩超:子宫大小约3.7cm×3.5cm×3.2cm,回声均匀,内膜厚0.3cm。左卵巢显示不清。右侧盆腔可见低回声包块,范围约16.8cm×12.6cm×11.4cm,形态不规整,边界不清,未见包膜,内见多个不规则无回声区,较大者3.3cm×2.8cm,彩色血流丰富,可探及动静脉频谱。盆腔见游离无回声区,深约1.2cm。提示:绝经后子宫、右侧盆腔占位性病变。术前CT(图1)。
图1 术前CT结果
初步诊断
1. 右侧盆腔占位性病变:卵巢肿瘤?
2. 高血压2级 中危
【治疗过程】
(一)病例分析
患者为老年女性,腹胀1周余,妇科彩超及腹、盆腔CT提示右侧盆腔巨大肿物,考虑为妇科肿瘤。为明确肿物性质,指导下一步诊治,遂行“开腹探查术”。
(二)治疗方案
患者入院后给予积极术前准备后,行开腹手术治疗,术中于盆腔偏右侧可见直径16cm大小实性肿物。探查腹腔,肝、脾、胃、膈肌表面光滑,大网膜正常,可见肿物来源于小肠,与阑尾、结肠及腹壁粘连。操作:置开腹器,护肠巾排垫肠管,松解粘连后,逐步切除肿物送冷冻病理报小肠GIST,后再行小肠部分切除术。
(三)术后病理及基因检测
术后病理:(小肠)胃肠间质瘤,改良NIH危险度分级:高危。
免疫组织化学染色:CD117(+),CD34(+),DOG-1(+),SMA(-),S-100(-),Ki67(Li:10%),核分裂象11个/50HPF。
基因检测:c-KIT外显子11突变。
【预后】
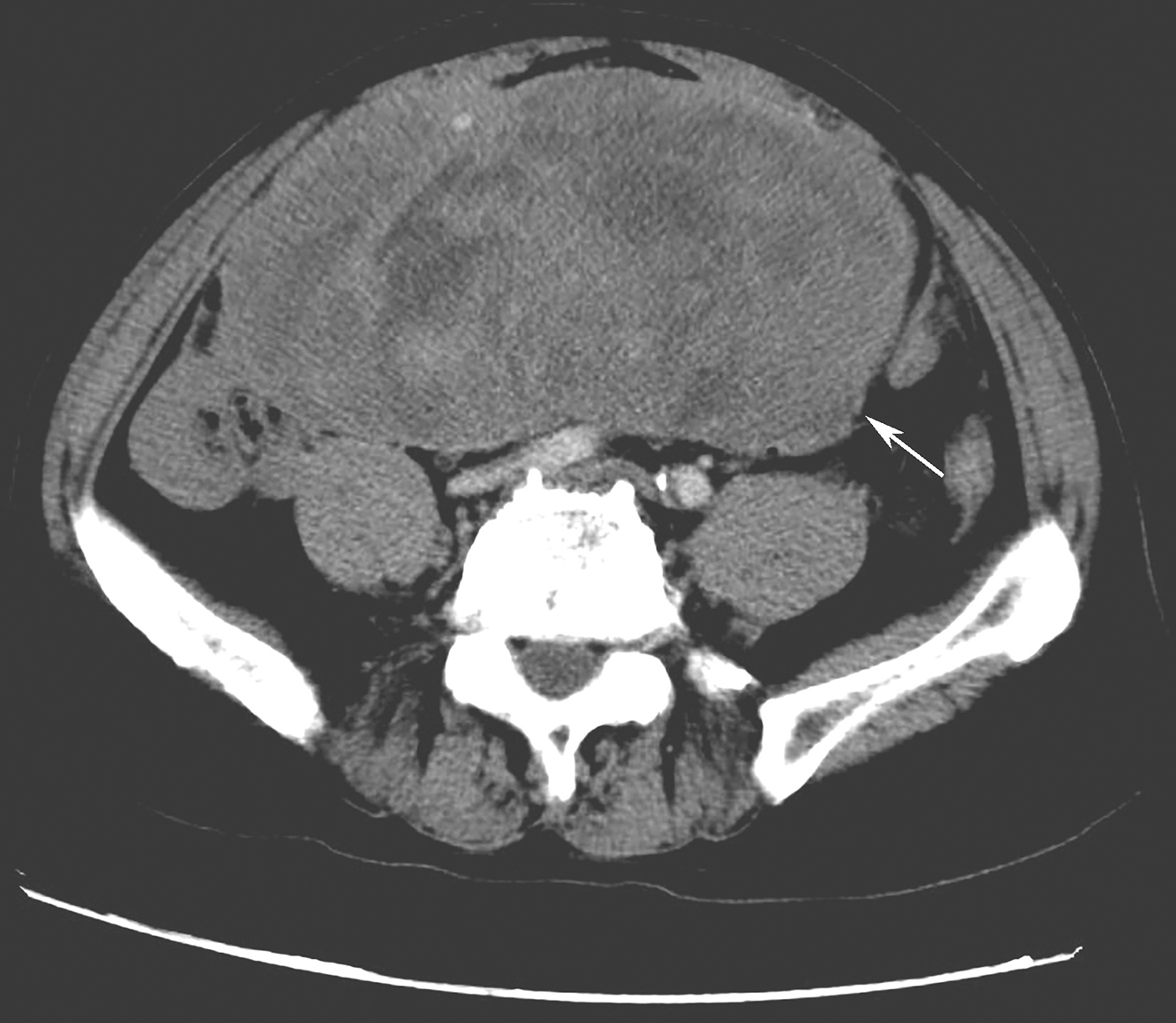
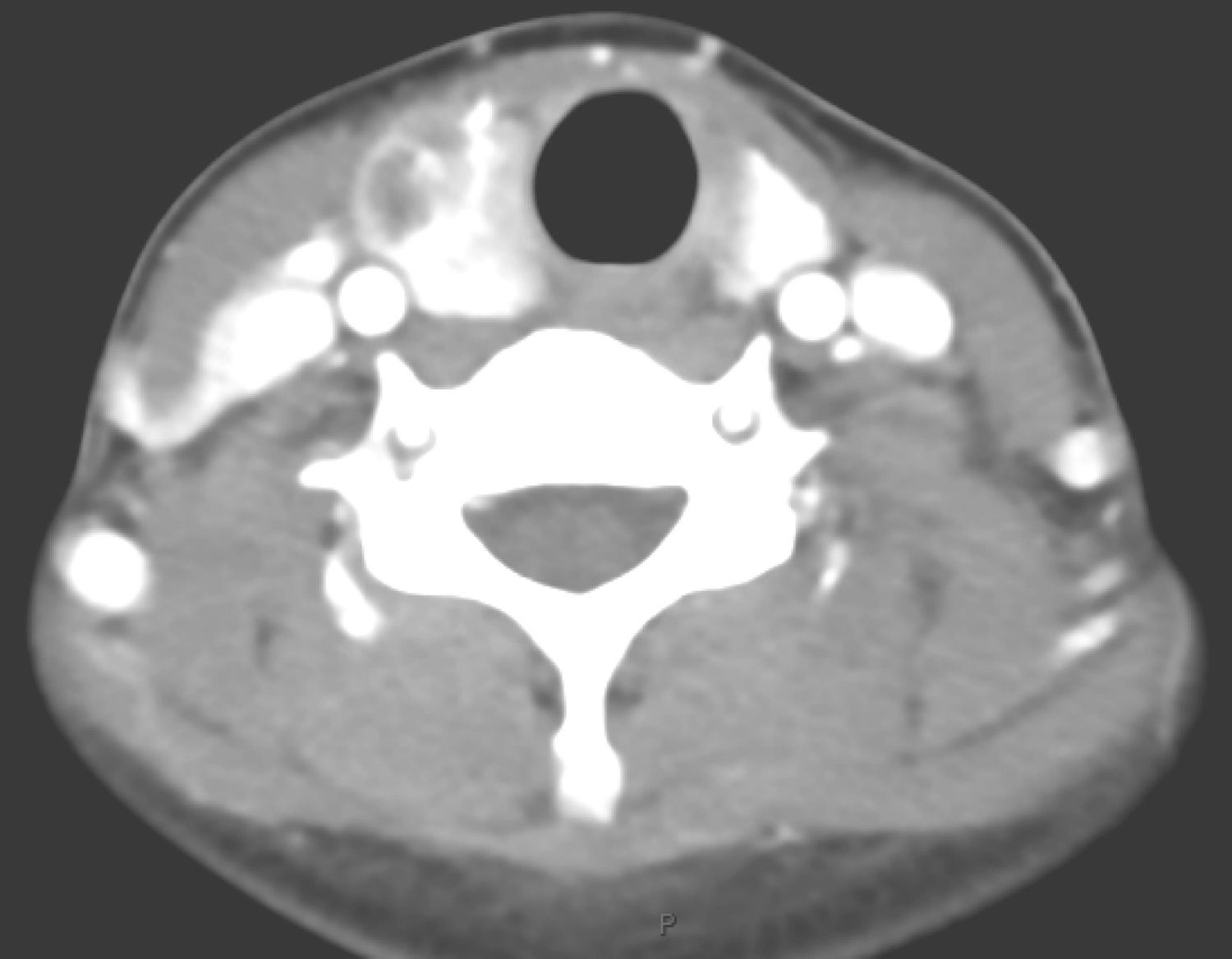
患者术后基因检测为c-KIT基因外显子11突变,给予伊马替尼400mg/d治疗,术后定期复查。17个月后,患者肿瘤原位复发(图2),考虑肿瘤耐药,向患者家属交代后选择再次手术治疗,术中见大网膜与腹膜及小肠广泛粘连,仔细分离粘连,见腹腔无腹水,所及盆腔、腹膜未见转移结节,继续探查,见肿瘤位于小肠系膜根部,肿物直径约10cm,肿物为囊实混合性,游离肿物所在小肠系膜根部腹膜,切除部分腹膜将肿物完整游离,切除肿物,继续探查,局部仍可见3枚大小不一结节,逐一予以切除。术后病理诊断小肠间质瘤,基因检测结果提示c-KIT基因外显子11、13突变,其中外显子13突变类型为V654A。患者术后继续服用伊马替尼400mg/d,3个月后肿瘤再次局部复发(图3),给予更换舒尼替尼37.5mg/d治疗。患者服用舒尼替尼治疗后,肿瘤退缩,目前仍在密切随访中(图4)。
图2 术后辅助治疗17个月复发
图3 二次手术后复发
图4 换用舒尼替尼3个月后复查CT结果
【经验与体会】
本病例开始误诊为妇科肿瘤,由于CT及超声的局限性,盆腔肿物往往很难判断其来源,小肠胃肠间质瘤经常被误诊为卵巢占位或子宫肌瘤。妇科子宫肌瘤手术通常要求在保护肠道尽量不受损伤的情况下,先行肿瘤切除。但小肠来源的胃肠间质瘤多数侵及小肠全层,在保证小肠不受损伤的情况下,很难保证肿瘤不破裂而完整切除肿瘤。该例患者在开腹探查后,未能及时判断肿瘤的来源,先按妇科肿瘤处理,将肿瘤切除,病理结果考虑胃肠间质瘤(小肠来源),再行肠管切除,极大地影响患者的预后。因此在妇科盆腔肿物的手术过程中,一旦发现肿瘤来源于肠管,有条件的医院应尽量由胃肠外科医师实施手术,行包括病变肠段在内的手术切除,避免发生肿瘤的医源性破裂。
患者术前CT提示盆腔肿物,肿瘤较大,且呈分叶状,手术切除困难。术前可考虑先行穿刺取病理明确诊断,如为胃肠间质瘤,可考虑先行术前治疗,待肿瘤缩小后,再行包括所在肠段在内的肿瘤切除。但遗憾的是该例患者没有在术前做出正确的判断,并错误地估计了手术难度,这也提示我们多学科讨论的重要性。对于巨大盆腔肿物的患者,术前应组织包括普外科、泌尿科、妇产科、肿瘤内科、影像科、内镜科等在内的多学科讨论来制订个体化的治疗方案,确保患者获得最佳的治疗效果。
患者在服用伊马替尼17个月后,出现肿瘤复发,考虑发生伊马替尼继发耐药。大部分的继发耐药是由于基因的二次突变造成的,该患者二次手术后的基因检测结果显示为c-KIT基因外显子11和13的突变,其中外显子13突变为V654A。相关文献报道这一类型的突变为耐药突变,根据《中国胃肠道间质瘤诊断治疗共识(2017年版)》应尽早更换二线药物治疗,但由于患者在二次手术后拒绝应用二线治疗药物,因此肿瘤切除后迅速复发,这也提示了基因检测对于继发耐药患者后续治疗的指导性作用,我们应该根据基因检测的结果合理选择用药,这样才能更好地提高患者的无复发生存时间以及总生存时间。
(撰稿人:寇有为 陈鑫莹)
【专家点评】
高金波
教授、主任医师、硕士研究生导师
华中科技大学同济医学院附属协和医院胃肠外科副主任
中国医师协会结直肠肿瘤专业委员会机器人专业委员会委员
中国医师协会结直肠肿瘤专业委员会器官功能保护专业委员会委员
中国医师协会外科医师分会经肛门全直肠系膜切除术专业委员会委员
部分来源于低位小肠或肿瘤较大的GIST常下坠至盆腔内,与子宫或附件粘连,症状及检查结果常与妇科疾病相似,易与某些卵巢及子宫肿瘤混淆,造成误诊。本例患者右侧附件可触及大小约12cm肿块,妇科B超提示右侧盆腔占位性病变,极易误诊为妇科肿瘤。因此盆腔肿块的鉴别诊断应考虑到GIST,必要时多次B超联合CT、肠镜等检查以明确盆腔包块性质,提高术前诊断率,以免误诊而错过最佳的治疗时机。
本中心回顾性数据显示:13年间误诊为妇科肿瘤的38例GIST中,33例来源于空肠,术后按改良NIH危险度分级均为高危。其5年无病生存率和特异性生存率分别为37.0%、48.3%,两者都明显低于其他高危女性GIST组,这提示此类GIST恶性程度高于普通高危女性GIST,因此适当延长该部分患者伊马替尼术后辅助治疗时间可能对其预后更有益。
【参考文献】
[1] WADA N, KUROKAWA Y, TAKAHASHI T, et al.Detecting Secondary C-KIT Mutations in the Peripheral Blood of Patients with Imatinib-Resistant Gastrointestinal Stromal Tumor.[J]. Oncology, 2016, 90(2): 112-117.
[2] GOUNDER M M, MAKI R G. Molecular basis for primary and secondary tyrosine kinase inhibitor resistance in gastrointestinal stromal tumor [J]. Cancer Chemother Pharmacol, 2011, 67(Suppl 1): S25–S43.
[3] 中国临床肿瘤学会胃肠道间质瘤专业委员会. 中国胃肠道间质瘤诊断治疗共识(2017年版)[J]. 肿瘤综合治疗电子杂志, 2018, 4(1): 31-43.
(环球医学编辑:常路)
来源:《胃肠间质瘤典型病例诊治与解析》
作者:陶凯雄 曹晖
页码:292-296
出版:人民卫生出版社
- 评价此内容
- 我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

