内镜经黏膜下隧道肿瘤切除术切除食管胃肠间质瘤一例
内镜经黏膜下隧道肿瘤切除术(submucoal tunneling endoscopic resection,STER)是利用内镜治疗技术在消化道黏膜层与固有肌层间建立一条管状人工隧道,并利用该隧道进行黏膜下层、固有肌层、浆膜层直至消化道外的诊疗操作。相对于胃,食管只有外膜而无浆膜覆盖,使得内镜食管黏膜下剥离术(ESD)治疗来源于食管固有肌层的黏膜下肿瘤引起食管穿孔的风险增加,而隧道内镜技术巧妙之处在于切除固有肌层病变后,能用钛夹封闭黏膜层,从而保证黏膜层完整,拓宽了内镜治疗的适应证。此外,STER具有术后患者恢复快,胸腹腔继发感染、消化道漏发生率低和手术时间短等优点。
(一)病例摘要
患者,男性,51岁,于2016年11月因“右上腹痛2天”就诊于当地医院,行胃镜检查提示:食管中段隆起性病变,慢性糜烂性胃炎。予以对症支持治疗后症状无明显改善。
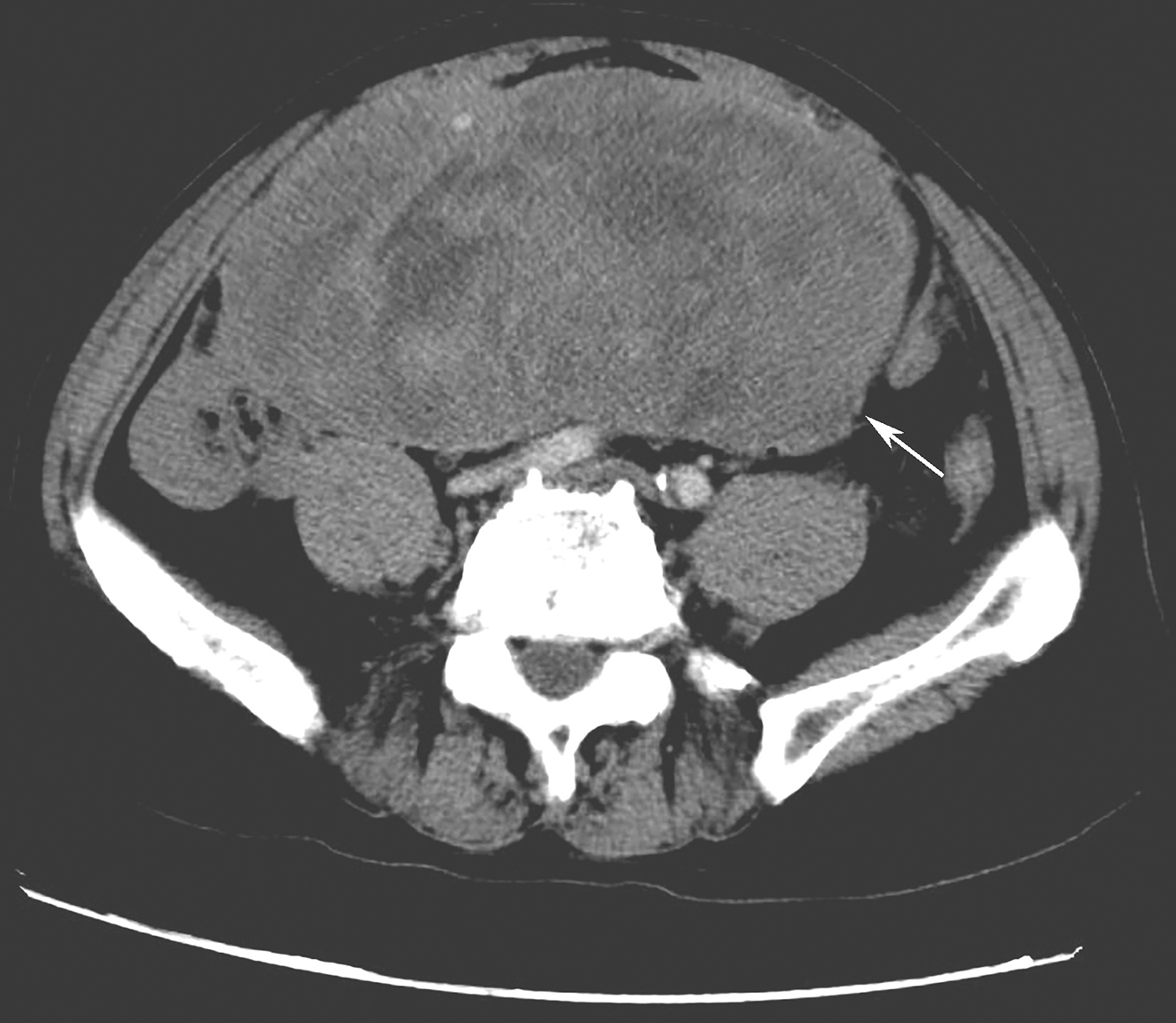
2016年11月于华中科技大学同济医学院附属协和医院门诊行胃镜检查示:距门齿33cm见约1.1cm隆起,表面光滑。超声内镜示(图1)病变位于固有肌层,低回声,边界清晰,大小约1.1cm×0.7cm。遂以“食管固有肌层隆起性病变”收入消化内科。
既往史及家族史:2012年因胆囊炎行胆囊切除术,否认药物过敏史;父母已故,家族中无类似病史。
体格检查:皮肤黏膜无黄染,唇黏膜无苍白,浅表淋巴结未触及。腹部平坦,对称,全腹软,全腹无压痛,无反跳痛,无肌紧张,全腹未及包块。肝区无叩击痛,移动性浊音阴性。听诊肠鸣音4~6次/min,未闻及气过水声。双下肢无水肿。
辅助检查:
-血常规及血生化未见明显异常。
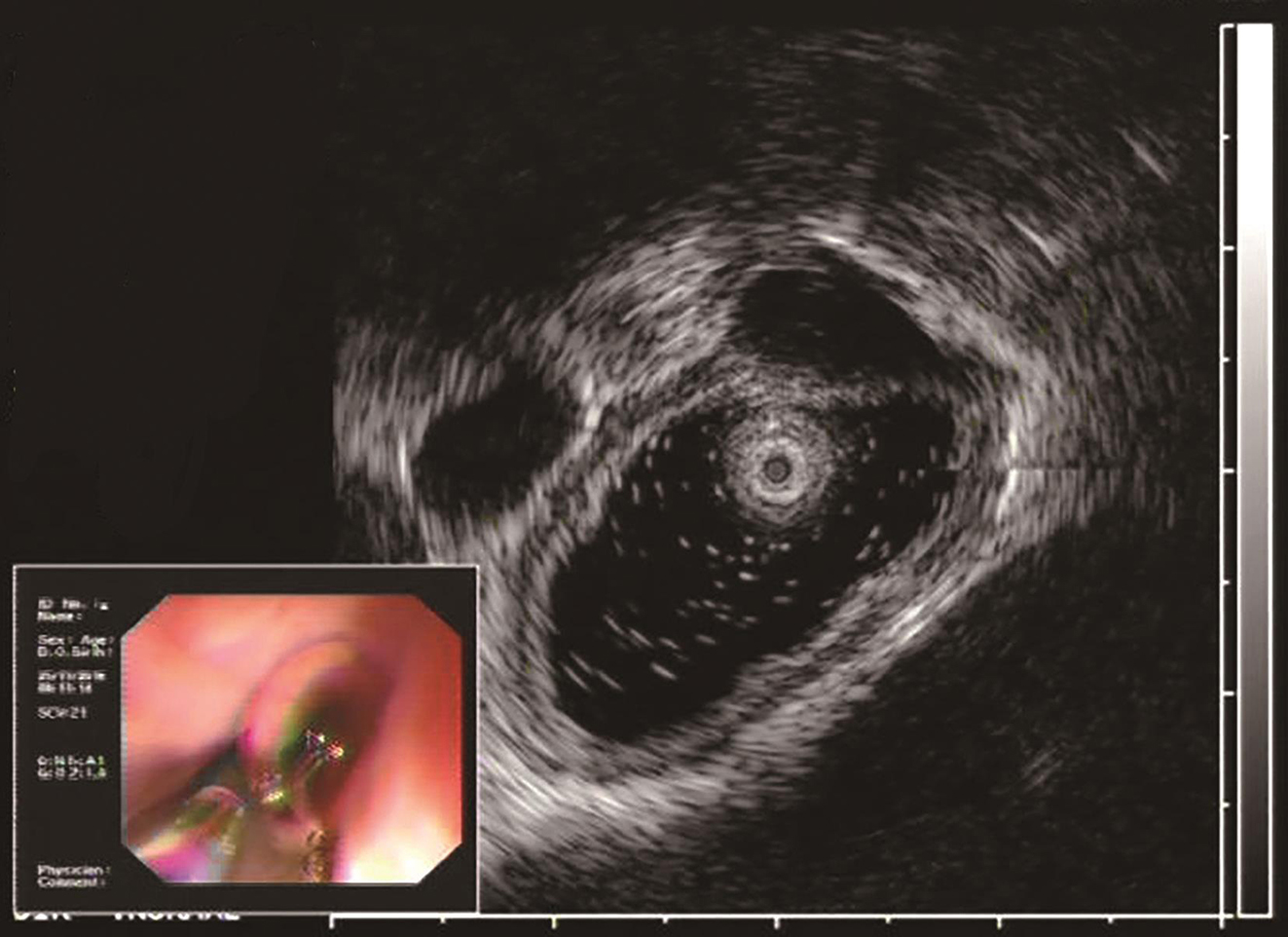
图1 超声胃镜检查
-2016年11月行食管平扫+三维CT示:食管距门齿30cm处见1cm肿物,凸向腔内生长。余未见异常。
初步诊断
食管固有肌层隆起性病变:胃肠间质瘤(gastrointestinal stromal tumors,GIST)?
糜烂性胃炎
胆囊切除术后
(二)治疗过程
1.病例分析
患者为中年男性,以“右上腹痛半个月”就诊。初步诊断:食管固有肌层隆起性病变,GIST?虽然瘤体较小(1.1cm×0.7cm),超声胃镜提示无边界不规整、溃疡、强回声及异质性等不良因素,但瘤体部位特殊,故建议患者可考虑行手术切除或密切随访。患者手术意愿强烈。经多学科会诊(multi-disciplinary treatment,MDT),考虑到外科开胸手术和胸腔镜手术创伤较大、恢复慢,且存在定位不准的缺点;经口隧道内镜技术在保持食管结构完整的基础上可完整剥离切除肿瘤,STER对患者获益更大,遂行“内镜下食管隆起性病变STER”。
2.治疗方案
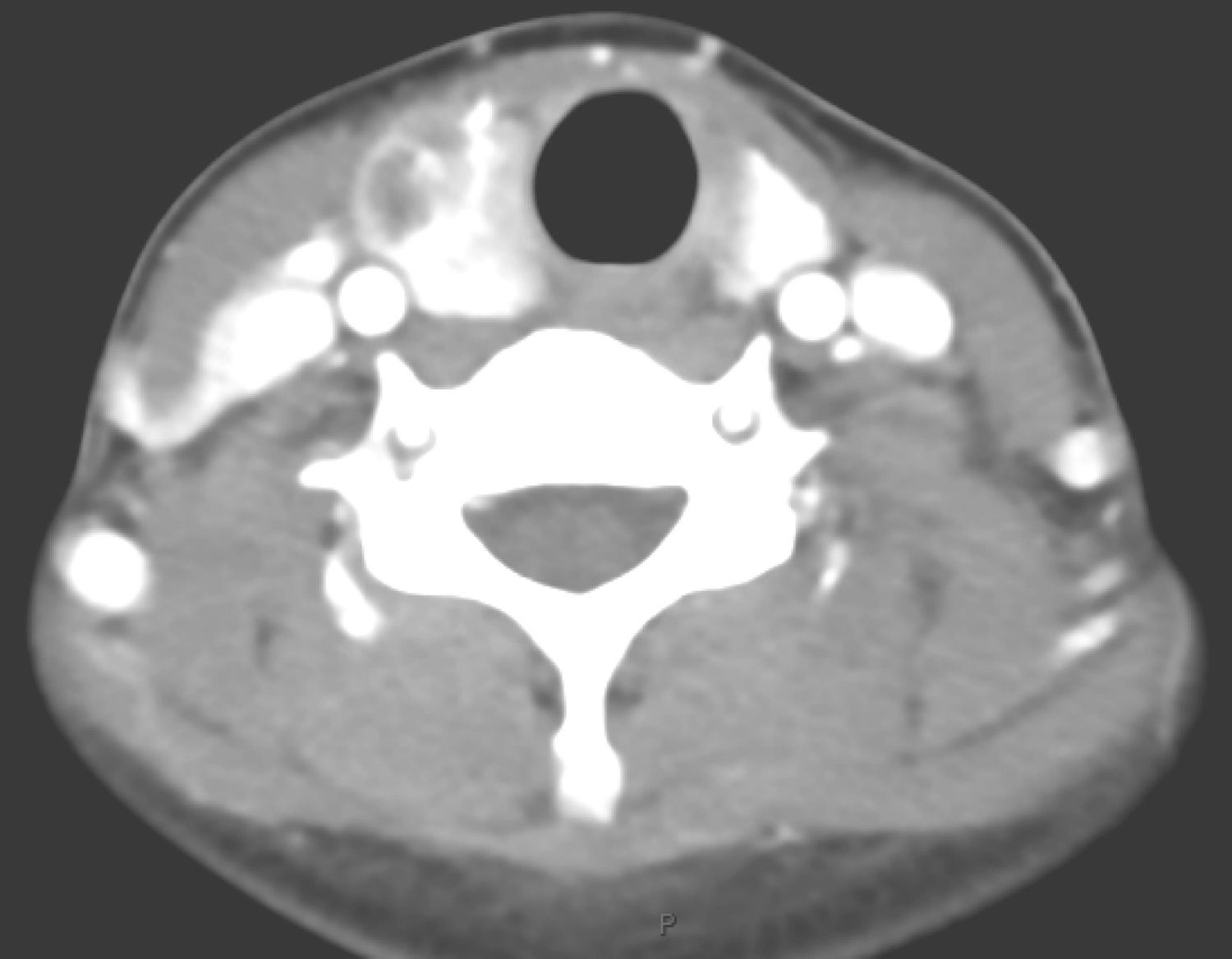
患者于2016年12月1日行“内镜下食管隆起性病变STER”,胃镜探查见食管距门齿33cm处扁平黏膜下隆起。手术步骤如下:①患者气管插管后全身麻醉,取左侧卧位。②镜身前端安装透明帽,冲洗并吸净食管腔内残渣及黏液。于瘤体周围黏膜下注射少量靛胭脂定位,并标记至肿瘤近口侧4~5cm处,作为切口。③予生理盐水、靛胭脂和肾上腺素混合液进行反复黏膜下注射,使切口处黏膜隆起(图2A)。应用Hook刀切开黏膜,内镜进入黏膜下逐步分离,在固有肌层和黏膜下层形成一纵行隧道。分离范围应超越瘤体2cm,充分暴露瘤体(图2B)。④使用Hook刀完整分离瘤体,注意保护肿瘤包膜完整,避免损伤食管外膜(图2C)。⑤取出瘤体后,反复冲洗,清理出血点,钛夹封闭黏膜切口。术后常规放置胃肠减压管。手术时间65min,术中出血15ml。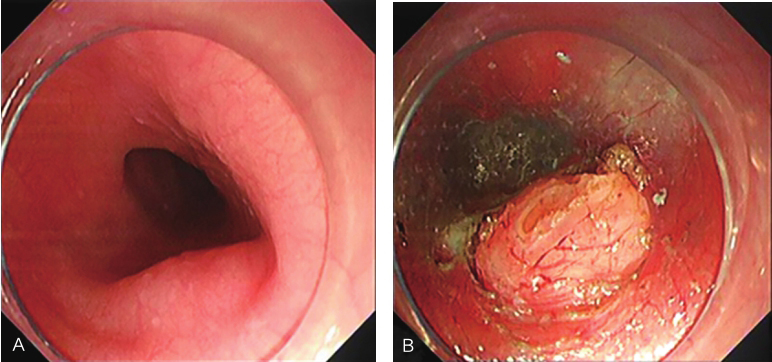
图2 内镜下食管隆起性病变STER
A.食管黏膜下肿物;B.建立隧道,暴露肿瘤;C.完整剥除肿瘤
3.术后病理及基因检测
-病理诊断:(食管)GIST(1cm×1cm×0.6cm),核分裂象0~1个/50HPF。改良NIH危险度分级:极低危。
-免疫组织化学染色:CD117(+),CD34(+),SMA(-),S-100(-)。
-基因检测:c-KIT基因外显子11发生突变,突变类型为p.V559D;PDGFRA基因外显子12、18为野生型。
(三)预后
术后禁食1天,第2天拔除胃肠减压管和导尿管并进流质饮食,第3天进半流质饮食。患者于术后3天恢复出院。根据术后病理报告,改良NIH危险度分级为极低危,术后未行辅助治疗。截至2018年9月,随访24个月,患者黏膜愈合良好,未出现食管狭窄、吞咽困难等并发症,无肿瘤复发或转移。
(四)经验与体会
食管GIST仅占全部GIST的0.66%,多发生于远端食管。根据肿瘤的直径、位置和性质,可选择内镜下剜除术、经黏膜下隧道内镜切除、腹腔镜下或者胸腔镜下切除术。但是其手术适应证的选择还没有相应的共识和规范。Robb等认为应结合肿瘤大小选择手术方式,肿瘤直径<20mm,首选ESD或者STER;肿瘤直径20~65mm,首选传统开胸或胸腔镜下肿瘤摘除术;肿瘤直径65~90mm,首选肿瘤摘除术或食管切除术;肿瘤>90mm或者肿瘤表面出现溃疡,则无论肿瘤大小,首选食管切除术。《中国消化道黏膜下肿瘤内镜诊治专家共识(2018版)》指出,STER技术可适用于起源于固有肌层、直径<5cm的食管及胃SMT。《胃肠间质瘤规范化外科治疗中国专家共识(2018版)》表明根据肿瘤直径、位置和性质,在有经验的医疗中心开展(食管)GIST STER是安全可行的。
STER切除(食管)GIST主要的优势有:应用隧道内镜技术,直视下进行固有肌层肿瘤的切除,可避免损伤周围的组织和脏器,预防严重并发症的发生;STER选择在瘤体上方4~5cm 处切开黏膜,建立黏膜下隧道,使肿瘤切除部位的黏膜层保持完整,而在非肿瘤切除部位的隧道入口关闭创面,保证了术后缝合黏膜切口后可以完全恢复消化道的完整性,避免出现术后消化道漏和胸腹腔的继发感染。STER既不同于传统内镜下食管胃腔内的治疗,也不同于经自然腔道的食管胃腔外的内镜治疗,而是巧妙地利用消化道黏膜和固有肌层之间的空间建立隧道进行操作。然而,食管解剖位置特殊,具有管壁薄和易穿孔出血的特点,在扩大内镜治疗GIST适应证的同时,还需要根据所在单位的实际操作能力,有选择性地开展相应的治疗。
在开展STER的过程中,气体相关并发症、发热、疼痛和胸腔积液等是STER的常见并发症。气体相关并发症包括皮下气肿、气胸或气腹,其发生率可高达66.7%。然而气体相关并发症常无需特殊处理,一般会自行消退。若气腹明显,可使用14G穿刺针于右下腹麦氏点穿刺放气。如因气胸导致血氧饱和度小于90%或气道压力高于30mmHg,可行胸腔闭式引流。发热与疼痛经对症处理后常可自行缓解。STER术后发生少量胸腔积液常无需处理,若患者高热或者影响呼吸,应及时于超声引导下置管引流。
(五)专家点评
近年来,由于内镜检查的普及和内镜超声(EUS)技术的发展与成熟,SMT的检出率大幅度提高。其中胃SMT以GIST、平滑肌瘤、异位胰腺较为多见,而GIST是最为常见的类型。GIST在EUS下表现为低回声,大部分直径<2cm,边界光滑,球形,均匀。恶性可有不规则腔外边界。一般而言,GIST来源于固有肌层,多考虑腹腔镜手术切除,但内镜切除有恢复快、创伤小等微创优势,因此部分术者也采取ESD或STER等内镜方式来切除小GIST。不过内镜切除对解剖位置要求较高,且有出血穿孔的风险,同时对术者的要求也较高,操作更为精细。但尽管存在这些风险,应用内镜对GIST进行切除具有精细准确等微创优点,因此受到越来越多的关注。
参考文献
[1] 张津铭, 徐洪雨. 内镜黏膜下切除术治疗结直肠巨大息肉的应用现状[J] . 中华结直肠疾病电子杂志, 2013, 2 (05): 243-245.
[2] 曹晖, 赵刚, 邱伟箐. 胃肠道疾病内镜下治疗的并发症及外科干预[J] . 中国实用外科杂志, 2013,33 (04): 301-303.
[3] KIM J W, KIM H S, PARK D H, et al. Risk factors for delayed postendoscopic mucosal resection hemorrhage in patients with gastric tumor [J] . Eur J Gastroenterol Hepatol, 2007, 19 (5): 409-415.
[4] KAKUSHIMA N, YAHAGI N, FUJISHIRO M, et al. Efficacy and safety of endoscopic submucosal dissection for tumors of the esophagogastric junction [J] . Endoscopy, 2006, 38 (2): 170-174.
[5] HWANG S H, PARK D J, KIM Y H, et al. Laparoscopic surgery for submucosal tumors located at the esophagogastric junction and the prepylorus [J] . Surg Endosc, 2009, 23 (9): 1980-1987.
[6] 李全林, 钟芸诗, 周平红, 等. 内镜下切除技术对食管胃连接部胃肠间质瘤的治疗价值 [J] . 中华胃肠外科杂志, 2012, 15 (3): 236-239.
[7] 闻瑜. 内镜下切除技术治疗食管胃连接部黏膜下肿瘤的有效性及安全性探讨 [D] . 浙江大学, 2014.
[8] 中国医师协会外科医师分会胃肠道间质瘤诊疗专业委员会, 中华医学会外科学分会胃肠外科学组. 胃肠间质瘤规范化外科治疗专家共识 [J] . 中国实用外科杂志, 2015, 35 (06): 593-598.
[9] 中华医学会消化内镜学分会外科学组, 中国医师协会内镜医师分会消化内镜专业委员会, 中华医学会外科学分会胃肠外科学组. 中国消化道黏膜下肿瘤内镜诊治专家共识 (2018版) [J] . 中华胃肠外科杂志, 2018, 21 (8): 841-852.
[10] 徐美东, 张晨. 隧道内镜技术在消化道疾病中的应用价值 [J] . 中华临床医师杂志, 2013, 7 (20): 9027-9030.
[11] 李国仁, 戴建华. 食管 (胃肠) 间质瘤的争议与共识 [J] . 中华胸部外科电子杂志, 2017, 4 (02): 120-126.
[12] ROBB W B, BRUYERE E, AMIELH D, et al. Esophageal gastrointestinal stromal tumor: is tumoral enucleation a viable therapeutic option? [J] . Ann Surg, 2015, 261 (1): 117-124.
[13] 赵海敏, 盛红, 黄立江, 等. 内镜经黏膜下隧道肿瘤切除术治疗食管固有肌层来源黏膜下肿瘤 [J] . 中华胃肠外科杂志, 2015, 18 (5): 478-482.
[14] WANG L, REN W, ZHANG Z, et al. Retrospective study of endoscopic submucosal tunnel dissection (ESTD) for surgical resection of esophageal leiomyoma [J] . Surg Endosc, 2013, 27 (11): 4259-4266.
[15] LIU B R, SONG J T, KONG L J, et al. Tunneling endoscopic muscularis dissection for subepithelial tumors originating from the muscularis propria of the esophagus and gastric cardia [J]. Surg Endosc,2013, 27 (11): 4354-4359.
[16] ZHOU P H, YAO L Q, QIN X Y, et al. Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria [J] . Surg Endosc, 2011, 25 (9): 2926-2931.
知识来源
人卫知识数字服务体系
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

