男68岁,颜面部及双下肢水肿1周
患者,男性,68岁,湖北人。
第一次住院(2007年12月30日):
主诉:颜面部及双下肢水肿1周。
现病史:患者一周前无明显诱因出现颜面部及双下肢水肿,按之凹陷,伴尿液泡沫增多,伴小便量减少,具体量不详,无尿频尿急尿痛,无肉眼血尿,无腰痛,无发热,无胸闷喘憋,无呼吸困难,无腹胀,院外未行特殊检查及治疗,今来我院,门诊测血压150/90mmHg,查尿常规红细胞99.5/μl,尿蛋白+++,以“蛋白尿血尿待查,慢性肾炎?”收住。入科时患者精神状态一般,食欲食量一般,睡眠尚可,体重无明显变化,体力稍减退,大便正常,小便量较平时减少。
既往史:无特殊。
体格检查:体温36.3℃,脉搏64次/分,呼吸19次/分,血压160/100mmHg,身高171c m,体重65kg,神志清楚,全身皮肤黏膜无黄染,全身浅表淋巴结无肿大。眼睑轻度水肿,颈软,双肺呼吸音清晰,双肺未闻及干、湿性啰音。心率64次/分,律齐,各瓣膜听诊区未闻及杂音,腹平坦,无压痛、反跳痛,移动性浊音阴性,肾区无压痛叩击痛,双下肢中度凹陷性水肿。
实验室检查:血常规:血红蛋白132g/L,白细胞7﹒56 ×10 9/L,中性粒细胞67%,血小板204 ×10 9/L。血沉:39mm/h。尿液检查:蛋白+++,红细胞镜检102/μl,2次24小时尿蛋白定量1750mg(610ml)及3656mg(960ml)。大便常规未见异常,潜血阴性。生化系列:总蛋白43﹒2g/L,白蛋白22﹒5g/L,球蛋白20﹒7g/L,总胆红素4﹒6μmol/L,结合胆红素2﹒0μmol/L,丙氨酸氨基转移酶10﹒9U/L,天冬氨酸氨基转移酶25﹒3U/L,γ‐谷氨酰基转移酶10﹒9U/L,碱性磷酸酶64﹒8U/L,肌酐96﹒7μmol/L,尿素氮12﹒69mmol/L,葡萄糖3.82mmol/L,尿酸408.7μmol/L,二氧化碳结合力18.5mmol/L,钾离子5.67mmol/L,钠离子146.7mmol/L,氯离子112.97mmol/L,钙离子0.73mmol/L,磷离子1.89mmol/L。胆固醇3.89mmol/L,甘油三酯0.71mmol/L,载脂蛋白A1.01g/L,载脂蛋白B 0﹒55g/L,高密度脂蛋白胆固醇1.10mmol/L,低密度脂蛋白胆固醇2.16mmol/L。免疫系列:血清免疫球蛋白IgG 5﹒42g/L,IgA 2﹒86g/L,Ig M 0﹒79g/L,补体C3 0﹒83g/L,补体C4 0﹒18g/L,自身抗体检查:ANA、ds‐DNA、抗Sc1‐70 抗体、抗Jo‐1抗体、抗Sm 抗体、抗SSA 抗体、抗SSB 抗体等均为阴性。p ANCA以及cANCA 均阴性。抗“O”22.27U/ml。尿本周蛋白多次检测均阴性。血清蛋白电泳:白蛋白45.2%,α1球蛋白4.6%,α2球蛋白22.4%,β球蛋白17.1%,γ球蛋白10.7%。尿蛋白电泳:β2微球蛋白、溶菌酶、视黄醇均为0,游离清链0.5%,α1微球蛋白1.1%,二聚体4.5%,白蛋白46.5%,转铁蛋白11.3%,IgA 12﹒2%,结合珠蛋白23.9%。血清传染病(乙肝、丙肝、梅毒、HI V)四项均为阴性;凝血功能正常;肿瘤标志物均正常。胸腔穿刺抽液检查提示为漏出液,胸腔积液肿瘤标志物及结核分枝杆菌检查均阴性。
核医学检查:2008年1月3日查血清游离T 3为2.63(参考值3.19~9.15)p mol/L,游离T 4为11.73(参考值9.11~25.47)mol/L,高灵敏TSH 1﹒00(参考值0.3~5)μI U/ml,TGAb 2﹒61%(参考值<30%),T MAb1.13%(参考值<20%)。2008年1月11日查血清游离T 3为0.84p mol/L,游离T 4为4.02p mol/L,高灵敏TSH 7﹒26μI U/ml,TGAb 6﹒25%,T MAb 5﹒51%;血清甲状腺过氧化物酶抗体(TPO‐Ab)阴性,甲状腺球蛋白抗体(TGAb)阴性。
双肾彩超:双肾轮廓清楚,形态正常,左肾大小约12.1c m×6.7cm×6.2c m,右肾大小约11.5c m×4.8c m×5.3c m,左肾实质厚2.0c m,右肾实质厚1.8cm,皮质髓质界限清晰,实质回声增粗增强,肾盂无分离,双输尿管无扩张。
CDFI:双肾内血流信号分布未见异常。
PW:左主肾动脉血流频谱S:52c m/s,D:20cm/s,RI 0﹒61。右主肾动脉血流频谱S:54cm/s,D:16c m/s,RI 0﹒69。
心电图:窦性心律,正常心电图。
心脏彩超:升主动脉(3.7cm)增宽,室间隔(1.2c m)稍厚。
胸部正位片:双侧胸腔少量积液。
双肾上腺超声未见明显异常。双肾上腺CT 检查未见明显异常。
眼底检查:A ∶V =1 ∶2~1 ∶3,血管纡曲明显,黄斑中心反光弱,色素紊乱,未见出血、渗出,双眼底动脉硬化样改变。
出院诊断:①蛋白尿待查:慢性肾炎?肾病综合征?良性小动脉性肾硬化症?②高血压3 级,极高危;③甲状腺功能减退(原发?继发?)。
治疗及转归
患者拒绝肾穿刺活检,住院期间给予贝那普利10mg,2次/天、缬沙坦80mg,1次/天,虫草制剂、左甲状腺素50μg,1次/天治疗,以及低分子右旋糖酐、白蛋白注射液、利尿治疗,病情稍稳定后于2008年1月11日给予泼尼松60mg,1次/天口服,患者水肿逐渐消退,于2008年1月30日出院。出院后坚持服用口服激素以及降压药物治疗。激素足量2个月后患者尿蛋白转阴,随后每2周激素减量5mg,复查尿常规以及24小时尿蛋白结果均阴性。患者激素使用3个月时甲状腺功能完全正常,停用甲状腺素。
第二次住院(2008年7月24日):
患者第一次出院后坚持服用激素以及降压药物,间断复查24小时尿蛋白,尿蛋白逐渐减退,泼尼松减至15mg,每日1次时,再次出现颜面部及双下肢水肿于2008年7月24日再次入住我科。
体格检查:生命体征正常。颜面部以及双下肢水肿,余无明显异常。
实验室检查:血常规正常。尿蛋白+++,红细胞镜检54/μl,24小时尿蛋白定量5.685g(900ml)。便常规未见异常,潜血阴性。生化系列:总蛋白53.7g/L,白蛋白31.4g/L,球蛋白22.3g/L,肌酐63.9μmol/L,尿素氮9.37mmol/L,尿酸282.2μmol/L,胆固醇5.7mmol/L,甘油三酯1.29mmol/L。免疫系列:血清IgG 6﹒57g/L,IgA 2﹒44g/L,Ig M 0﹒92g/L,补体C3 1﹒16g/L,补体C4 0﹒31g/L。自身抗体检查:ANA、ds‐DNA、抗Sc1‐70 抗体、抗Jo‐1 抗体、抗Sm抗体、抗SSA 抗体、抗SSB 抗体等均为阴性。p ANCA 以及cANCA均阴性。尿本周蛋白多次检测均阴性。血清传染病(乙肝、丙肝、梅毒、HI V)四项均为阴性;凝血功能正常;肿瘤标志物均正常。
核医学检查:血清游离T 3为1.02pmol/L,游离T 4为5.34pmol/L,高灵敏TSH 6﹒83μI U/ml,TGAb 8﹒32%,T MAb 5﹒54%。血清甲状腺过氧化物酶抗体(TPO‐Ab)阴性,甲状腺球蛋白抗体(TGAb)阴性。
双肾彩超:未见明显异常。心电图:窦性心律,正常心电图。心脏彩超:升主动脉增宽,室间隔稍厚。胸部正位片:双侧胸腔少量积液。双眼底检查提示双眼底动脉硬化样改变。
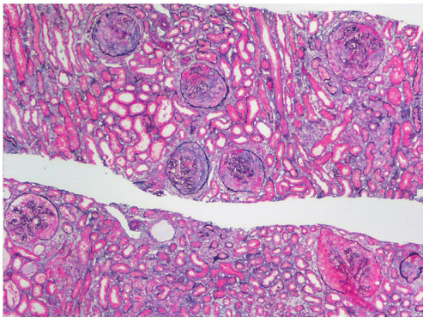
肾脏病理:光镜所见(图14‐1,图14‐2)取材好,2条皮质组织,共22个肾小球,无分叶,5个球性硬化,1个节段硬化,余肾小球体积大小不一,细胞数80~100个/球,系膜细胞轻度增殖,2~4个/系膜区,系膜基质增多,系膜区轻度节段增宽,1个肾小球系膜区少数节段重度增厚,一处内皮细胞泡沫变性,毛细血管袢开放好,轻度僵硬、扩张状,浸润细胞0~3个/球,主为单个核细胞,部分毛细血管袢内见多量红细胞堆积,少数球囊粘连,一处“顶部”病变,囊壁轻度节段不规则增厚伴少量分层,节段壁层上皮细胞泡沫变性。PAS‐Masson:节段肾小球基底膜空泡变性。小管间质病变轻至中度,弥漫小管上皮细胞浊肿、少数细胞颗粒变性、少量小管上皮细胞扁平,管腔内见少量蛋白管型及红细胞管型。间质区域小灶性增宽,散在纤维组织增生及单个核细胞浸润。少数小动脉平滑肌细胞空泡变性。碱性刚果红染色阴性。
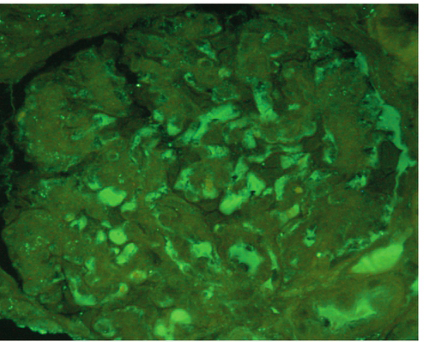
荧光所见:荧光镜下见2个肾小球:IgA(++)及C1q(++)
图14‐1 光镜下肾脏病理改变,Masson×400
图14‐2 光镜下肾脏病理改变,PASM×400
肾小球系膜区及毛细血管袢颗粒状沉积;IgG 阴性、Ig M 阴性、C3及C4 阴性。
小结:肾小球FSGS 样病变;轻至中度小管间质病变;小动脉平滑肌细胞空泡变性。
电镜结果:送检肾组织电镜下可见1个肾小球。毛细血管袢排列基本规则。内皮细胞无明显增生和肿胀。毛细血管基底膜无明显变化,未见明显电子致密物沉积。足突弥漫性融合。系膜节段性轻度增生,部分节段系膜基质内可见少量电子致密物沉积,肾间质纤维增生明显。
第二次住院出院诊断:①原发性肾病综合征、肾小球FSGS 样病变、继发性甲状腺功能减退;②高血压3 级,极高危。
病情分析
该患者既往否认高血压,但是没有经常测量血压,入院后多次血压高,同时眼底有动脉硬化改变,无慢性肾炎病史,超声未见肾动脉狭窄,肾上腺超声及CT 未见异常,考虑高血压为原发性。
患者以全身水肿起病,辅助检查发现存在低蛋白血症、大量蛋白尿、高脂血症,符合肾病综合征的诊断。进一步分析肾病综合征的原因,患者无明确病史,结合辅助检查可排除肿瘤、乙肝、结缔组织疾病等,但是存在高血压,会不会是良性小动脉性肾硬化症导致的肾病综合征,临床上不能排除。第一次住院时患者拒绝肾活检,治疗上能否使用激素存在困惑,如果是良性小动脉性肾硬化症,激素治疗蛋白尿无效,如果是原发性肾病综合征,激素治疗可能有效。与患者交待激素治疗的风险及可能疗效,患者同意足量激素治疗。随着治疗的进行,蛋白尿逐渐减轻,以及第二次住院肾活检,进一步明确患者肾病综合征为原发。
原发性高血压引起的肾脏损害通常称为良性肾硬化。它首先影响肾小球前的动脉血管,主要是入球小动脉和小叶间动脉。表现为小动脉中层的血管平滑肌细胞被结缔组织取代,还常有透明样物质(血浆蛋白)在内膜下的蓄积(玻璃样变性)。作为与小动脉病变相关的肾小球和肾间质小管则出现缺血,表现为肾小球毛细血管基底膜缺血性皱缩,肾小管上皮细胞空泡及颗粒变性,灶状萎缩,间质多灶状淋巴和单核细胞浸润,可伴纤维化。病变晚期可见肾小球硬化和严重的间质小管损伤,即肾小管多灶状和片状萎缩,部分代偿肥大,肾间质纤维化。免疫荧光无特异表现,一般无免疫球蛋白及补体的沉积,有时在肾小球和小动脉壁上可见较弱的 IgM 沉积。电镜检查与光镜所见一致[1]。该患者结合病史、临床表现、辅助检查以及病理结果,诊断原发性FSGS。
患者临床符合肾病综合征,同时伴随有甲状腺功能减退。是肾病综合征导致甲状腺功能减退,还是甲状腺功能减退导致肾病综合征,或者肾病综合征与甲状腺功能减退时相互独立并存?第一次住院时诊断不是十分明确,但是随着尿蛋白的进一步丢失,发现甲状腺功能减退逐渐加重,激素治疗及补充小剂量甲状腺素后患者甲状腺功能有所好转。甲状腺功能恢复正常后停用甲状腺素,多次检测血清T 3、T 4、TSH 没有变化。第二次住院患者肾病综合征复发,甲状腺功能再次出现异常,再次同样治疗后甲状腺功能恢复,最后诊断患者甲状腺功能减退为肾病综合征的并发症。
治疗及转归
给予甲泼尼龙40mg,1次/天,1周静脉注射治疗后,改为泼尼松60mg,1次/天口服,缓慢减量。并用贝那普利10mg,1次/天,缬沙坦80mg,1次/天,左甲状腺素50μg,1次/天,硝苯地平缓释片10mg,2次/天,肠溶阿司匹林片100mg,1次/天,抗血小板预防血栓治疗。足量激素治疗2个月后缓慢减量,尿常规蛋白阴性,24小时尿蛋白定量210mg(1540ml),甲状腺功能逐渐恢复正常。巩固足量激素治疗共4个月,随后每2~3周减量5mg。
讨论
1﹒肾病综合征与良性小动脉肾硬化症的鉴别 患者为老年男性,以颜面部及双下肢水肿起病,临床表现为水肿、低蛋白血症、大量蛋白尿、高脂血症等肾病综合征,同时患者有高血压,有高血压靶器官损害证据(心脏彩超以及眼底动脉检查均有动脉硬化改变,蛋白尿等),不排除良性小动脉肾硬化症。
良性小动脉性肾硬化症的诊断标准[2]:
(1)必需条件:①为原发性高血压;②出现蛋白尿前一般有5年以上的持续性高血压(程度一般>150/100mmHg);③有持续性蛋白尿(一般为轻至中度),镜检有形成分少;④有视网膜动脉硬化或动脉硬化性视网膜改变;⑤除外各种原发性及继发性肾脏疾病。
(2)辅助或参考条件:①年龄40~50岁以上;②有高血压左心室肥厚、冠心病和心力衰竭;③有动脉硬化或脑血管意外史;④血尿酸升高;⑤肾小管功能损害先于肾小球功能损害;⑥病程进展缓慢。病理诊断:肾小动脉硬化程度与肾小球、肾小管和肾间质缺血纤维化病变程度一致,符合原发性高血压引起的良性小动脉肾硬化改变。该患者根据以上标准,结合其临床表现及肾脏病理,可以排除良性小动脉肾硬化诊断。
2﹒原发性局灶性节段肾小球硬化(Focal Segmental Glomeru losclerosis,FSGS)的鉴别诊断
(1)与微小病变性肾小球病的鉴别:由于FSGS 与微小病变性肾小球病的临床表现相似,非硬化肾小球的病理形态相似,所以很容易混淆。曾有学者认为FSGS 与微小病变性肾小球病是同一疾病的两个亚型[3]。病理鉴别的要点是在无病变的肾小球的背景下,发现局灶节段性硬化的肾小球,即使发现一个病变肾小球,也应该诊断FSGS。为此,应该注意以下几点:①要求肾活检标本中要包含足够数量的肾小球,否则容易漏诊。统计表明,10个肾小球的标本,漏诊率为35%,20个肾小球的标本的漏诊率则下降为12%[4]。②对标本应做连续切片,可在不同的层面发现局灶节段硬化的肾小球。③标本覆盖面要广,因为最早受累的肾小球在皮髓质交界区。即使未能发现节段性硬化的肾小球,当微小病变性肾小球病的肾活检标本出现肾小球肥大,灶状的肾小管萎缩和间质纤维化,免疫病理出现系膜区的IgM 沉积,电镜检查发现肾小球上皮细胞增生及严重的空泡变性,临床出现高血压及肾功能受损等情况时,都应考虑FSGS 的可能。
(2)与Ig M 肾病的鉴别:轻重不等的肾小球系膜增生,伴有高强度的Ig M 沉积,临床常有大量蛋白尿或肾病综合征,称为IgM肾病[5]。部分IgM 肾病患者对激素治疗不敏感,预后较差。IgM肾病是否为一独立性肾疾病,一直存在争论,因为大分子的IgM在包括FSGS 在内的多种损伤过程中,均可沉积于肾小球而被系膜细胞摄取。因此,有人主张IgM 肾病中,有一部分潜伏着FSGS,在Ig M 肾病的追踪观察过程中,确实有部分病例演变成了FSGS,所以有人主张IgM 肾病是FSGS 的前奏,有如FSGS 和微小病变性肾小球病的关系。
(3)与年龄性和非活动性球形硬化的鉴别:随着年龄增长,肾小球有一定的年龄性变化,可出现一定比例的硬化,硬化比例为:(年龄÷2-10)%,后者无临床异常,偶尔表现一些轻微的蛋白尿,与FSGS不同[3]。病理检查无活动性病变所见。
(4)与继发性局灶节段肾小球硬化的鉴别:多种病因(单一的或复杂的)都可以引起肾脏继发性FSGS 样病变,后者有明确的导致FSGS 的原因,而且免疫病理与光镜检查也有明确的发现,具有原发病的特征外,局灶节段性肾小球硬化病变重叠到原有的肾小球疾病上,可见到各自的原有的肾小球疾病的特征,如局灶节段增生硬化型IgA 肾病,尽管临床和光镜表现与原发性FSGS 相似,但免疫荧光检查显示肾小球系膜区的高强度的IgA 沉积。而且继发性FSGS 以门部型为主[3]。提示继发性FSGS 的组织学特点包括:①肾小球硬化程度轻重不一、包囊壁增厚,球周纤维化、小管间质病变呈斑片状分布,这些都提示反流性肾病引起的FSGS;②滥用海洛因引起肾脏损害的机制不详,组织学为FSGS 样病变,与特发性FSGS 相比,球性肾小球硬化,上皮细胞损伤及间质纤维化、小管损伤均较明显;③HI V 相关的肾病,肾小球为局灶、节段瘢痕形成,毛细血管袢塌陷,电镜观察发现内皮细胞胞浆中存在网状结构(HI V 相关肾病特有的超微结构特点),小管损伤明显,包括与肾小球瘢痕不相称的囊状扩张。
3﹒肾病综合征与甲状腺功能减退 患者临床符合肾病综合征,同时伴随有甲状腺功能减退。是肾病综合征导致甲状腺功能减退,还是甲状腺功能减退导致肾病综合征,或者肾病综合征与甲状腺功能减退时相互独立并存?研究表明,肾病综合征患者尿液排泄甲状腺素结合球蛋白(TBG)和甲状腺素结合前白蛋白(TBPA)均明显增多,导致血清T 4水平降低,严重时血清T 3水平亦降低[6]。肾病综合征导致的低T 3、低T 4综合征实为一种保护性调节过程的两个阶段。第一阶段的特点是T 3和FT 3降低,反T 3(r T 3)增高,但T 4和FT 4尚正常。第二阶段是除T 3和FT 3进一步降低外,T 4也降低,TSH 一般正常或略低。而甲状腺功能减退相关性肾损害甲状腺功能检查表现为TSH 首先升高,然后依次是FT 4、TT 4、FT 3和TT 3的降低。可见两者是有不同的变化顺序和特征。如将两者混淆,必将延误诊断治疗。本病例动态观察甲状腺功能发现,随着肾病综合征病情的进展,由最初的单纯FT 3的降低演变为FT 3、FT 4的降低以及TSH 的升高。随着肾病综合征激素以及甲状腺素治疗后病情的好转,FT 3、FT 4水平逐渐恢复正常。
综上所述,患者第一次住院拒绝肾穿刺活检,激素治疗有效,以及第二次住院肾活检,证实了患者存在原发性肾小球疾病,而不是良性小动脉性肾硬化症。所以,临床工作中,当患者有大量蛋白尿,有肾病综合征倾向时,如果不排除原发性肾小球疾病时,应尽量肾活检明确病理类型,以免耽误疾病的治疗。同时,原发性肾病综合征还要注意并发的甲状腺功能减退,补充小剂量甲状腺激素可以减轻蛋白尿,缩短病程,提高激素治疗的缓解率。
参考文献
[1]王海燕.肾脏病学.第3版.北京:人民卫生出版社,2008:1662‐1670 .
[2]郑法雷,章友康,陈香美,等.肾脏病临床与进展.北京:人民军医出版社,2005:98‐106 .
[3]邹万忠.肾活检病理学.北京:北京大学医学出版社,2006:61‐67 .
[4]Cor win HL,Schwartz MM,Lewis EJ .The importance of sample size in theinterpretation of the renal biopsy .AmJ Nephrol,1988,8(2):85‐89 .
[5]邹万忠.肾活检病理学.北京:北京大学医学出版社,2006:74‐75 .
[6]Iglesias P,Diez JJ .Thyroid dysfunction and kidney disease.Eur J Endocri nol,2009,160(4):503‐515 .
(陈星华)
【丁香视野】原发性肾病综合征与甲状腺功能减退
早在20 世纪80年代,就有学者报道肾脏疾病与甲状腺功能之间的密切关系[1~4]。甲状腺激素是肾脏发生、发展、维持内环境稳定所必需的激素。一方面,甲状腺素在肾脏代谢和排泄,内环境的变化常导致甲状腺功能减退或者甲状腺功能亢进。另一方面,不同的肾脏疾病和甲状腺疾病的治疗常伴发肾脏功能和甲状腺功能的变化以及不良事件的发生。
甲状腺激素在肾脏的发生、发展以及生理功能方面发挥着重要作用。甲状腺功能也影响机体不同部位的水、电解质平衡。肾脏在甲状腺激素的合成、代谢、排泄过程中也发挥重要作用,并且是甲状腺激素发挥效应的重要的靶器官[2]。甲状腺激素活性的减弱可导致体内水钠潴留,这种效应不是因为抗利尿激素的生产受到抑制,而是因为肾小管重吸收能力下降以及肾小球滤过率下降[5]。甲状腺功能减退可引起肾脏功能紊乱,如血清肌酐水平上升,肾小球滤过率下降,肾血流量减少,钠离子重吸收减少,尿液稀释功能减退,低钠血症等[6]。
不同类型的肾脏疾病也可导致多种类型的甲状腺功能异常。肾病综合征患者的甲状腺激素水平常发生变化[1,4],尿液甲状腺素结合球蛋白(TBG)、甲状腺素结合前白蛋白(TBPA)等蛋白的丢失,导致血清总T 4水平的下降,有些时候总T 3水平也下降。这些激素水平的下降与尿蛋白含量以及血清蛋白水平密切相关。然而,大部分患者不出现甲状腺功能减退的表现,这是因为游离T 3、游离T 4水平正常[1]。轻度肾病综合征或者肾病综合征早期甲状腺自身的代偿可以维持甲状腺功能,但是严重持续的肾病综合征可出现TT 3、TT 4明显下降,TSH 上升。Chadha 等通过实验进一步证实了通过切除先天性肾病综合征患儿的双侧肾脏,逆转了患儿的甲状腺功能减退[7]。
原发性肾病综合征患者甲状腺功能暂时性减低认为是机体的一种保护性适应机制,可减低代谢率,减少机体分解代谢,节约体内能量,减少蛋白质消耗和产生过量的非蛋白氮,从而减轻肾脏的负担[8]。但有些学者观察到甲状腺功能状态与组织糖皮质激素受体水平有关,甲状腺功能降低可引起体内糖皮质激素受体减少。Spanjaard 等还认为T 3呈低水平时,甲状腺激素受体ɑ1可抑制糖皮质激素受体介导的转录活性,使糖皮质激素受体基因表达降低[9]。这可能是部分肾病综合征患者对激素治疗反应不佳的重要原因之一,同时可以解释这部分患者给予甲状腺激素替代治疗后获得缓解的这一事实。其机制可能是甲状腺素水平的升高使每个组织细胞上的激素受体数目增加,并使其发生构象改变,由不能结合激素的非活化状态转为与激素结合的状态,同时使低亲和力的受体结合位点增加。
左甲状腺素作用机制与甲状腺素片相似,口服吸收50%,起效缓慢、平稳,近似于生理激素。实验证明,肾病综合征患者在常规激素治疗基础上加用小剂量左甲状腺素后6个月TT 3、FT 3、TT 4、FT 4水平较治疗前有显著升高,分析原因为左甲状腺素为T 4,70%~80%的T 3由T 4在5′‐脱单碘酶作用下于外周组织中生成,故TT 3及FT 3虽升高但差异无显著性。另外,左甲状腺素组治疗后尿蛋白阴转天数明显缩短,缓解率明显高于一般治疗组,其机制为甲状腺素在肝、肾、肌肉中浓集,甲状腺素的酚基主要在肾脏和巯基结合。应用左甲状腺素后提高了甲状腺素浓度,促进了蛋白质和酚基合成,甲状腺素进入细胞内可能保持游离状态,与低亲和力的胞浆受体,或与高亲和力的核酸及线粒体结合[10],改善细胞代谢,使肾循环改善,从而使肾基底膜得以恢复,肾功能恢复,使原发性肾病综合征病情缓解。
综上所述,原发性肾病综合征患者存在暂时性甲状腺功能低下状态,多数患者随病情好转而逐渐恢复,对原发性肾病综合征患者要常规动态观察甲状腺功能,对估计病情、判断预后、指导治疗有重要意义。对原发性肾病综合征合并甲减者,应在常规治疗的基础上给予小剂量左甲状腺素,有利于尿蛋白转阴,缩短病程,提高缓解率,尤其是对激素不敏感的患者。
参考文献
[1]Feinstein EI,Kaptein EM,Nicoloff JT,et al .Thyroid function in patients with nephrotic syndrome and nor mal renal function .AmJ Nephrol,1982,2(2):70‐76 .
[2]Kaptein EM,Quion‐Verde H,Massry SG.Hemodynamic effects of thy roid hor mone.Contrib Nephrol,1984,41:151‐159 .
[3]Kaptein EM.Thyroid f unctionin renal failure.Contrib Nephrol,1986,50:64‐72 .
[4]Kaptein EM,Feinstein EI,Massry SG.Thyroid hor mone metabolismin renal diseases .Contrib Nephrol,1982,33:122‐135 .
[5]den Hol ander JG,Wulkan RW,Mantel MJ,et al .Correlation bet ween severity of thyroid dysfunction and renal function .Clin Endocrinol(Oxf),2005,62(4):423‐427 .
[6]Montenegro J,Gonzalez O,Saracho R,et al .Changes in renal function in primary hypothyroidism.AmJ Kidney Dis,1996,27(2):195‐198 .
[7]Chadha V,Alon US.Bilateral nephrectomy reverses hypothyroidism in congenital nephrotic syndrome .Pediatr Nephrol,1999,13(3):209‐211 .
[8]Mattoo TK .Hypothyroidismin infants with nephrotic syndrome.Pediatr Nephrol,1994,8(6):657‐659 .
[9]Spanjaard RA,Nguyen VP,Chin WW.Repression of glucocorticoid recep tor‐mediated transcriptional activation by unliganded thyroid hor mone receptor(TR)is TR isofor m‐specific .Endocrinology,1995,136(11):5084‐5092 .
[10]池芝盛,编译.内分泌学基础与临床.北京:科学出版社,1992:154‐159 .
(陈星华)
来源:《内科疑难病例.泌尿分册》
作者:杜新 齐卡
参编:陈光磊 余鹏程 徐德宇 毕礼明 刘伟
页码:132-144
出版:人民卫生出版社
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号
 会员登录
会员登录

