男45岁,少尿,腹胀,血肌酐进行性升高2周
患者,男性,45岁。
主诉:少尿,腹胀,血肌酐进行性升高2周。
现病史:患者有慢性乙型肝炎病史10 余年,乙肝后肝硬化,肝功能失代偿期,早期未用抗病毒药物治疗。1年前,乙肝DNA 复制上升,加用阿德福韦口服(10mg/d),当时肾功能正常(血清肌酐96μmol/L),查尿常规正常。半年前,乙肝DNA 复制下降不明显,加用拉米夫定片口服(100mg/d),肾功能正常(Scr 102μmol/L)。1月前因腹水增多腹胀就诊于某医院,当时查血肌酐144μmol/L,24小时尿蛋白4.21g,无发热咳嗽,无胸闷气急,无尿频尿急尿痛,无关节肿痛,无皮疹紫癜,无腹痛腹泻,无其他肾毒性药物使用史,经限水钠,利尿对症处理,腹胀好转,入本院前复查肾功能血清肌酐452μmol/L。
既往史:慢性乙型肝炎病史10 余年,乙肝后肝硬化,肝功能失代偿期。
体格检查:血压120/72mmHg,心肺无异常体征,腹膨隆,移动性浊音阳性,无扑翼样震颤,神经系统查体阴性。
辅助检查:尿常规:蛋白(+++),红细胞(++++)/HP,24小时尿蛋白定量1.83g,大中分子蛋白尿,血清肌酐(Scr)582μmol/L,肾小球滤过率(GFR)12.2ml/min,血IgA 升高,补体正常。其他风湿病抗体,ANCA 均阴性。肝功能ALT3U/L,乙肝核心抗体阳性,余阴性,乙肝DNA 2 ×10 3/ml,肾脏B 超:左肾11.1cm×5.0cm×4.7cm,皮质1.3c m,右肾10.4c m×4.9c m×4.1cm,皮质1.3cm,肝胆B 超:肝硬化,腹水。
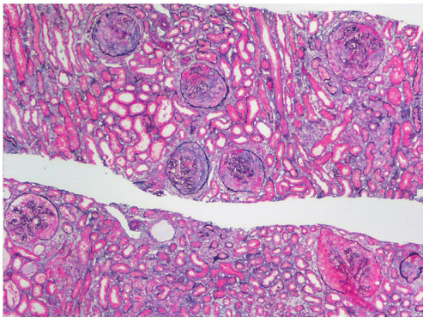
肾活检病理(图43‐1):光镜:肾活检组织,2条皮质组织,27个肾小球,其中4个小球球性硬化,1个小球节段性细胞纤维性新月体形成,1个小球节段性纤维细胞性新月体形成,2个小球包氏囊节段性增厚,其余肾小球病变为弥漫性系膜细胞系膜基质轻至中度增多。肾间质灶性纤维化(<25%),弥漫性水肿,多灶性淋巴细胞、单核细胞、浆细胞浸润(>25%),肾小管灶性萎缩(<25%),肾小管上皮细胞浊肿、颗粒空泡变性(+~++),部分肾小管上皮细胞坏死、脱落,基底膜裸露、断裂,可见小管炎,蛋白管型(+),红细胞管型(++),个别小血管壁增厚。
图43‐1 患者病理表现
图43‐1 患者病理表现(续)
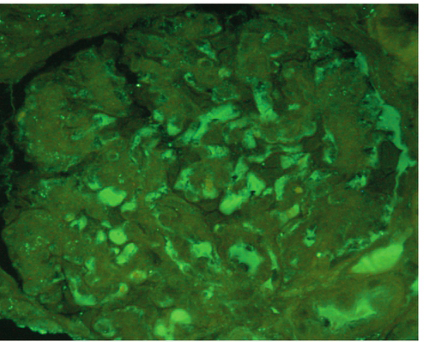
图注A﹒免疫荧光:系膜区IgA 沉积(×200),B﹒肾小管坏死(Masson,×200),C﹒肾小管坏死和基底膜断裂(PAS,×200),D﹒节段性纤维性新月体(PAS,×200)
免疫荧光(IF):6个小球,IgA 强阳性(+++),系膜区弥漫沉积,IgG 弱阳性(±),Ig M 阳性(+),系膜区弥漫沉积,C3 强阳性(+++),系膜区弥漫沉积,C4 阴性,C1q 阴性,Fib 阳性(+)节段性沉积。
间接免疫荧光(IIF):HBsAg 阴性,HBcAg 弱阳性。
Ⅳ型胶原α3基底膜连续阳性,α5基底膜连续阳性;刚果红染色阴性。
病理诊断:IgA 肾病(系膜增生伴节段性新月体形成占7%),急性肾小管间质病变。最后诊断:肝硬化相关性IgA 肾病;急性肾损伤3 级;阿德福韦相关性肾损害。
患者入院后停用阿德福韦,继用拉米夫定片抑制乙肝病毒复制,该患者住院期间以血液透析进行替代治疗3周之间(从3月10日到4月2日接受血透治疗),第1周为1周透析3次,以后逐步减少为1周2次,至停止血透,以后血肌酐逐步下降(图43‐2),到一月后门诊随访时血肌酐下降为120μmol/L,其HBV DNA 也维持在较低水平,肝功能正常。
图43‐2 患者血肌酐的变化随访
讨论
抗病毒药物可引起多种肾脏损害[1]。阿德福韦为阿糖腺苷的类似物,在肾小管上皮细胞内的药物浓度与其毒性作用相关。肾小管上皮细胞的人类有机阴离子转运蛋白(human organic anion transporter,hOAT)和(或)有机阳离子转运蛋白(human organic cation transporter,hOCT)系统的功能上调可使转运入肾小管上皮细胞的抗病毒药物增多,而药物抵抗蛋白(Multidrug‐Resist ance‐Protein,MRP 2,4)的功能异常将使药物由细胞内向细胞外转运减少,上述情况均可使肾小管上皮细胞内的药物浓度增加,可致肾小管上皮细胞损伤[2,3]。阿德福韦还可与MRP 蛋白相互作用。由于阿糖腺苷的类似物在细胞内参与磷酸化作用,阿德福韦还可抑制线粒体复制从而引起肾小管坏死[4]。既往报道表明阿德福韦大于30mg/d 的用量可引起肾毒性,且其肾损伤可在开始用阿德福韦72小时后发生,其发生率约22%~50%[5 ,6]。
阿德福韦是治疗慢性乙型肝炎非常重要的药物[7]。研究表明,阿德福韦可用于治疗拉米夫定抵抗的慢性乙型肝炎,它与拉米夫定合用可改善慢性乙型肝炎的预后[8],而在剂量<10mg/d 时相对安全。慢性乙型肝炎引起肾脏损害包括乙肝病毒相关性肾炎和肝硬化相关性肾炎。最近有报道表明在乙肝病毒阳性的肾移植患者用10mg/d 的阿德福韦对肾脏的毒性较小[9],拉米夫定用于治疗乙肝病毒携带者的膜性肾病可改善肾病的预后[10]。我们的这一病例其病理表现为IgA 肾病,且其肾组织中未发现乙肝抗原的沉积,病理也不是乙肝病毒相关性肾炎表现的典型膜性肾病[11,12],因此,该患者的肾损害诊断为肝硬化相关性肾病,本例的结果表明低剂量的阿德福韦可在肝硬化相关IgA 肾病患者中导致急性肾损伤,停用阿德福韦后该患者的肾功能恢复,因此,低剂量的阿德福韦在临床应用中要严密观察其副作用。
参考文献
[1]Izzedine H,Launay‐Vacher V,Deray G.Antiviral drug‐induced nephro toxicity .AmJ Kidney Dis,2005,45(5):804‐817 .
[2]Wijnholds J,Mol CA,van DL,et al .Multidrug‐resistance protein 5 is a multispecific organic anion transporter able to transport nucleotide ana logs .Proc Natl Acad Sci U S A,2000,97(13):7476‐7481 .
[3]Jedlitschky G,Burchell B,Keppler D.The multidrug resistance protein 5 functions as an ATP‐dependent export pump for cyclic nucleotides .J Biol Chem,2000,275(39):30069‐30074 .
[4]Tanji N,Tanji K,Kambham N,et al .Adefovir nephrotoxicity:possible role of mitochondrial DNA depletion .Hum Pathol,2001,32(7):734‐740 .
[5]Benhamou Y,Bochet M,Thibault V,et al .Safety and efficacy of adefovir dipivoxil in patients co‐infected with HI V‐1 and lamivudine‐resistant hep atitis B virus:an open‐label pilot study .Lancet,2001,9283(358):718‐723 .
[6]Izzedine H,Hulot JS,Launay‐Vacher V,et al .Renal safety of adefovir dipivoxil in patients with chronic hepatitis B:t wo double‐blind,random ized,placebo‐control ed studies .Kidney Int,2004,66(3):1153‐1158 .
[7]Ghany MG,Doo EC.Assessment and management of chronic hepatitis B. Infect Dis Clin North Am,2006,20(1):63‐79 .
[8]Sung JJ,Lai JY,Zeuzem S,et al .Lamivudine compared with lamivudine and adefovir dipivoxil for the treat ment of HBeAg‐positive chronic hepa titis B.J Hepatol,2008,48(5):728‐735 .
[9]Kamar N,Huart A,Tack I,et al .Renal side effects of adefovir in hepatitis B virus‐(HBV)positive kidney al ograft recipients .Clin Nephrol,2009,71(1):36‐42 .
[10]Tang S,Lai F M,Lui YH,et al .Lamivudine in hepatitis B‐associated membranous nephropathy .Kidney Int,2005,68(4):1750‐1758 .
[11]Ori Y,Korzets A,Sandbank J,et al .Cirrhotic glomerulonephritis:an un derdiagnosed condition .Isr J Med Sci,1996,32(12):1222‐1224 .
[12]Lhotta K .Beyond hepatorenal syndrome:glomerulonephritis in patients with liver disease.Semin Nephrol,2002,22(4):302‐308 .
(朱斌 程晓霞 鲁盈)
【丁香视野】抗病毒药物的肾毒性
本例患者因使用核苷类似物抗病毒药物阿德福韦治疗乙肝而引起急性肾小管坏死,临床我们也会遇见抗病毒药物所致急性肾损伤,现就其机制和诊治简述如下。
1﹒抗病毒药物的肾毒性机制[1]
肾小管局部转运异常致肾毒性。抗病毒药物在肾小管上皮细胞转运异常,使得抗病毒药物积聚于肾小管上皮细胞内致细胞损伤,主要有三种机制:①转运蛋白缺陷。核苷类似物是通过hOCT、hOAT 进入细胞的,而其通过MRP 及P‐糖蛋白的清除个体差异很大。hOAT、hOCT、MRP 遗传缺陷的患者对抗病毒药物的转运异常,药物可在肾小管上皮细胞中积聚较高的浓度,从而损伤肾小管上皮细胞。非环状核苷酸西多福韦或阿德福韦通过hOAT1 的细胞吸收致细胞内浓度增高可损伤近端肾小管。替诺福韦和阿德福韦可通过hOAT1 和hOAT3 吸收入细胞内,西多福韦则只通过hOAT1 吸收。其他核苷类似物如齐多夫定、司他夫定、地达诺新、扎西他滨、拉米夫定均为hOAT1 的作用底物,但未发现这些药物可致肾小管功能损伤。替诺福韦及阿德福韦均非hOCT 的底物,HI V 蛋白酶抑制剂携带正电荷可能与OCT 相互作用,也可能为细胞色素P‐450 的作用底物,可通过抑制P‐糖蛋白起作用。②药物致肾小管上皮细胞凋亡。抗病毒药物如干扰素等也可通过免疫介导机制导致肾小管上皮细胞凋亡,而这种毒性作用是通过信号转导通路介导的,如MAPK 通路。③线粒体损伤。另外,核苷类似物等可进入线粒体中,磷酸化而成三磷酸盐致线粒体毒性,导致肾小管上皮细胞损伤。
2﹒临床后果
(1)急性肾小管毒性:抗病毒药物直接导致肾小管上皮细胞变性坏死,形成棕色微细或颗粒状肾小管管型。可引起近端小管缺陷(fanconi 样综合征)或急性肾小管坏死,尤易发生于原有潜在肾脏疾病或与其他肾毒性药物同时使用时。以下分别就各种抗病毒药物的临床肾小管肾毒性发生情况进行简述。
西多福韦:为核苷类似物,肾毒性为剂量依赖性,与近端肾小管细胞功能不全有关,可致蛋白尿(50%病例),血肌酐升高(12%的西多福韦治疗的病例),或者偶可致慢性间质性肾炎,停用西多福韦可使血肌酐恢复至基线水平。在血肌酐水平高于132.6μmol/L,或肌酐清除率<55ml/min,尿蛋白>100mg/dl(++),或有糖尿病的患者不宜用西多福韦治疗。
阿德福韦[2]:为ATP 的类似物,参与多种能量介导的过程。阿德福韦的多种作用如对肾小管转运蛋白的影响。其肾毒性呈剂量依赖,可见于60~120mg/d。近端肾小管毒性可见于用30mg/d剂量长达72周时间的患者,发生率为22%~50%。血肌酐升高大于44.2μmol/L 或血磷下降至<1.5mg/dl 为最敏感和特异的指标。近端肾小管损伤可见于用阿德福韦治疗120mg/d,长达48周的患者,平均恢复时间为15周。近端肾小管功能不全在16%的患者肾毒性发生后41周还难以恢复。30mg/d 的剂量可发生轻微肾毒性而在10mg/d 较少发生肾毒性。
替诺福韦:肾毒性较小。3年的随机试验(替诺福韦对比司他夫丁)其血肌酐水平无显著差异,无fanconi 综合征发生。有少量报道表明替诺福韦可有近端肾小管毒性。大多在用药20周或更长时间后发生肾脏损害。肾活检资料表明肾小球多正常,而表现为近端肾小管损伤。在有肾脏基础疾病患者避免应用替诺福韦,应用替诺福韦者应注意扩容补液,水化以减少其肾小管中的浓度从而避免肾毒性。
膦甲酸:常用于巨细胞病毒感染(CMV infection)。可抑制带状疱疹病毒DNA 聚合酶和病毒反转录酶。发生肾损伤的情况较为多见。有报道表明肾毒性可发生于27%的用药者,静脉液体的水化可以明显减少其肾毒性的发生率。停药后大多数患者肾功能恢复,预后良好。也有少部分患者在停药4周后仍发生肾衰竭。与更昔洛韦组比,其发生肾毒性高到3倍以上。而在另一组研究中,用40mg/(kg •d)的剂量,与阿糖腺苷组相比无显著差异,其显著肾毒性仅发生于3/24 患者。
地达诺新:有个例报道表明应用者可发生急性肾损伤及近端小管功能不全。
(2)晶体肾病:肾脏中晶体沉积可引起肾衰竭。常因抗病毒药物溶解度低,在尿液中析出可堵塞远端肾小管。常见于合并一些临床情况,如严重的血容量不足,有基础肾脏疾病,过量使用抗病毒药物,合用较多的造影剂。
阿昔洛韦:在尿液中(62%~91%)以原型排出,在尿液中溶解性差(在正常尿液p H 中最多只可溶解2.5mg/ml),快速静脉注射易致结晶在肾小管中沉积,低剂量静脉注射或口服毒性小。结晶性肾病常在用药24~48小时后出现。发生率12%~48%。38%~50%的患者不停药肾功能也可恢复。尿检可有血尿和白细胞尿。偏振光可观察到双折光的药物结晶。大多患者短暂透析后肾功能可恢复。防治措施:避免高浓度输注,缓慢输入,水化,避免脱水。
印地那韦:20%经肾脏排泄,尿液p H 3﹒5 的时候易溶解(100mg/ml),而尿液p H 值碱化时其溶解度明显下降,p H6.0溶解度0.35mg/ml,p H7.0溶解度0.02mg/ml,尿液检查光镜下可见到各种形状的结晶,肾衰竭轻微易恢复,预后良好,防治措施:补液水化。
另外,抗病毒药物也可致肾小球病:部分应用干扰素(IFN)的患者有轻到中度蛋白尿,10%血肌酐升高,其病理表现为微小病变、肾小球局灶节段硬化(FSGS)、足细胞增生或新月体肾炎。IFN,伐昔洛韦应用还可导致血栓性微血管病,其机制可能为免疫介导,预后差。部分抗病毒药物还可致肾性尿崩症(NDI):膦甲酸可影响集合管的加压素反应性,影响其浓缩功能,其他如印地那韦、西多福韦、替诺福韦、地达诺新等均可致NDI。另有报道表明印地那韦、西多福韦的长程使用可致慢性肾衰竭。
3﹒抗病毒药物肾毒性的易患因素
就患者个体而言,老年、先前有肾脏基础疾病、血容量不足、脱水、高尿酸血症的患者易发生肾毒性作用。
就药物因素而言,过量使用、静脉应用均为抗病毒药物肾毒性易发因素。另外,与其他药物合用的情况也易致抗病毒药物肾毒性的发生,如和造影剂、氨基糖苷类抗生素、非甾体类抗炎药、血管紧张素转换酶抑制剂等合用。
由此可见,抗病毒药物引起的肾损伤并不少见,其表现形式多种多样,最常见是药物在肾小管上皮细胞内浓度过高致肾小管损伤坏死和药物溶解性差引起晶体肾病,大多数患者停用相关药物后预后良好。用药时应注意评估患者的基础肾功能,选择肾毒性较小的药物,不宜高浓度静推,注意水化补液,发生肾功能损伤时及时停药。
参考文献
[1]Val e R,Haragsim L .Nephrotoxicity as a complication of antiretroviral therapy .Adv Chronic Kidney Dis,2006,13(3):314‐319 .
[2]Servais A,Lechat P,Zahr N,et al .Tubular transporters and clearance of adefovir .Eur J Phar macol,2006,540(1):168‐174 .
(朱斌 程晓霞 鲁盈)
来源:《内科疑难病例.泌尿分册》
作者:杜新 齐卡
参编:陈光磊 余鹏程 徐德宇 毕礼明 刘伟
页码:425-434
出版:人民卫生出版社
- 评价此内容




 3我要打分
3我要打分
近期推荐
热门关键词
最新会议
- 2013循证医学和实效研究方法学研讨会
- 欧洲心脏病学会年会
- 世界帕金森病和相关疾病2013年会议
- 英国介入放射学学会2013年第25届年会
- 美国血液学会2013年年会
- 美国癫痫学会2013年第67届年会
- 肥胖学会 2013年年会
- 2013年第9届欧洲抗体会议
- 国际精神病学协会 2013年会议
- 妇科肿瘤2013年第18届大会
- 国际创伤压力研究学会2013年第29届…
- 2013年第4届亚太地区骨质疏松症会议
- 皮肤病协会国际2013年会议
- 世界糖尿病2013年大会
- 2013年国际成瘾性药年会
- 彭晓霞---诊断试验的Meta分析
- 武姗姗---累积Meta分析和TSA分析
- 孙凤---Network Meta分析
- 杨智荣---Cochrane综述实战经验分享
- 杨祖耀---疾病频率资料的Meta分析
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号
 会员登录
会员登录

